miR-519d-3p靶向HIF-1α抑制高糖诱导的人视网膜微血管内皮细胞功能障碍及血管生成
蔡 晖,宋 颖,石华宗,杨豫湘
0 引言
糖尿病视网膜病变(diabetic retinopathy,DR)作为糖尿病患者眼部的最常见并发症,是导致视力下降、甚至失明的主要原因[1]。目前全球DR患者超过9300万,伴随糖尿病发病率的持续攀升和发病年龄逐渐年轻化,DR已成为全球性的公共卫生问题。目前针对DR的治疗方法,如抗血管内皮生长因子药物的使用、玻璃体内注射类固醇激素、激光光凝和手术治疗等,虽然可以部分缓解疾病进展,但疗效仍不能令人满意[2]。DR的主要病理变化是视网膜微血管病变,与高糖诱导的人视网膜微血管内皮细胞(human retinal microvascular endothelial cells,HRMEC)功能障碍和血管生成增加密切相关。因此,如何逆转HRMEC功能障碍和抗血管生成是眼科专业领域亟需解决的关键问题。作为一类非编码RNA,微小核糖核酸(microRNA,miRNA)参与多种病理生理过程,包括调节细胞增殖、凋亡、分化和各种代谢过程,维持干细胞的干性潜能,参与炎症和免疫反应等[3]。近期研究发现,miR-519d-3p参与调控肿瘤进展、骨关节炎和心肌梗死等疾病进展[4-6],但在DR中的研究较少。本团队前期已报道,低氧诱导因子-1α(hypoxia inducible factor 1 subunit alpha,HIF-1α)在视网膜内皮细胞增殖、炎症、血管生成等方面具有重要作用[7],但调控HIF-1α的miRNA尚不清楚。基于生物信息学分析推测HIF-1α可能是miR-519d-3p的靶基因,值得对该现象进行进一步研究。基于以上依据,本研究采用高糖诱导HRMEC制作细胞模型,旨在明确miR-519d-3p对高糖诱导的HRMEC功能障碍和血管生成的影响,并阐明其对HIF-1α的调控机制,以期从细胞层面证实miR-519d-3p/HIF-1α轴在DR中的重要作用。
1 材料和方法
1.1 材料HRMEC,由中山大学中山眼科中心提供;内皮细胞培养基(1001)、胎牛血清、生长因子、青霉素/链霉素溶液,上海中乔新舟生物科技有限公司;D-(+)-葡萄糖(ST1228)、细胞增殖/毒性检测试剂盒(Cell Counting Kit-8,CCK-8)(C0038)、Hoechst 33342染色试剂盒(C1029),上海碧云天生物技术公司;阴性对照模拟物(5’-UUCUCCGAACGUGUCACGUTT-3’)、miR-519d-3p模拟物(5’-CAAAGUGCCUCCCUUUAGAGUG-3’)、HIF-1α过表达载体[将HIF-1α mRNA(NM_001530.4)编码区序列插入pcDNA3.1(+)载体构建],上海吉玛基因公司;Lipofectamine 3000转染试剂盒(L3000-015),美国赛默飞世尔科技公司;实时荧光定量PCR检测试剂盒(638315),北京宝日医生物技术公司;HIF-1α抗体(ab179483)、β-肌动蛋白(β-actin)(ab8227)抗体,上海艾博抗公司;酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)相关人肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒(EH0302)、人白细胞介素(interleukin,IL)-1β检测试剂盒(EH0185)、人IL-6检测试剂盒(EH0201),武汉菲恩生物科技有限公司;Matrigel基质胶(354234),美国康宁公司;HIF-1α野生型报告载体[包含miR-519d-3p结合位点(HIF-1α-wt)]、HIF-1α突变型报告载体[不包含miR-519d-3p结合位点(HIF-1α-mut)],广州伯信生物科技公司;荧光素酶报告基因检测试剂盒(E1910),美国普洛麦格公司。
1.2 方法
1.2.1 细胞培养HRMEC复苏后采用内皮细胞培养基进行培养,培养箱条件设定为37℃、5% CO2、95%空气。当细胞生长至约90%融合时,用0.25%胰蛋白酶消化细胞,按1∶4传代培养。当细胞传至2~3代后,取生长状态良好的细胞进行实验。
1.2.2 制作高糖细胞模型将D-(+)-葡萄糖用适量PBS溶液配制成5、30mmol/L浓度。取HRMEC在6孔板中铺板,每孔细胞数约为5×106个。向细胞中分别加入5、30mmol/L浓度葡萄糖培养48h,建立正常(NG)和高糖(HG)细胞模型。
1.2.3 实验分组和细胞转染对照组:HG细胞模型转染阴性对照模拟物;甘露醇组:在对照组基础上加入25mmol/L甘露醇;miR-519d-3p过表达组:HG细胞模型转染miR-519d-3p模拟物;miR-519d-3p联合HIF-1α过表达组:HG细胞模型共转染miR-519d-3p模拟物和HIF-1α过表达载体。取HRMEC在6孔板中铺板,每孔细胞数约为5×106个,培养过夜。当细胞生长至约70%~90%融合时,利用Lipofectamine 3000转染试剂进行细胞转染。对照组、甘露醇组、miR-519d-3p过表达组、miR-519d-3p联合HIF-1α过表达组分别转染100pmol阴性对照模拟物、100pmol阴性对照模拟物、100pmol miR-519d-3p模拟物、50pmol miR-519d-3p和2.0μg HIF-1α过表达载体。继续培养24h后,收集细胞供后续使用。
1.2.4 实验指标
1.2.4.1 实时荧光定量PCR法检测各组miR-519d-3p的表达情况提取各组细胞总RNA,并逆转录为cDNA。利用cDNA作为模版在ABI 7100荧光定量PCR仪上进行扩增反应。扩增条件为:95℃ 20min,随后95℃ 10s,58℃ 30s,72℃ 30s,共40个循环。miR-519d-3p引物:5’- CAAAGTGCCTCCCTTTAGAGTG -3’(正向),5’- CGCAGGGTCCGAGGTATTC -3’(反向); U6引物:5’- CTCGCTTCGGCAGCACA -3’( 正向),5’- AACGCTTCACGAATTTGCGT-3’( 反向)。以U6为内参对照,采用2-ΔΔCt法计算各组中miR-519d-3p的相对表达水平。
1.2.4.2Westernblotting法检测各组HIF-1α蛋白的表达情况采用RIPA蛋白裂解液提取各组细胞总蛋白,BCA法测定总蛋白浓度。取40μg总蛋白依次进行电泳、转膜和封闭过程。随后加入HIF-1α抗体(1∶1000稀释)4℃过夜,以β-actin抗体(1∶10000稀释)为内参对照。第2d利用辣根过氧化物酶标记山羊抗兔二抗(1∶5000)37℃孵育1h后,暗室添加超敏发光液并曝光胶片。利用Quantity-one软件对蛋白条带进定量分析,计算HIF-1α蛋白的相对表达水平。
1.2.4.3 荧光素酶报告基因实验检测miR-519d-3p和HIF-1α的结合位点情况取对照组和miR-519d-3p过表达组细胞在24孔板中铺板,每孔细胞数约为2×105个,培养过夜。利用Lipofectamine 3000转染试剂向细胞中分别转染0.8μg HIF-1α-wt和0.8μg HIF-1α-mut报告载体。培养24h后,裂解细胞,利用荧光素酶报告基因检测试剂盒测定各组萤火虫荧光值和海肾荧光值。以萤火虫荧光值为内参对照,计算相对荧光素酶活性。相对荧光素酶活性=(海肾荧光值/萤火虫荧光值)×100%。
1.2.4.4CCK-8法检测各组细胞增殖情况取各组细胞在96孔板中铺板,每孔细胞数约为7×103个。培养24、48、72h后分别向细胞中加入12μL CCK-8溶液,继续培养3h。采用多功能酶标仪测定各组450nm波长时的吸光度(A)值。
1.2.4.5Hoechst33342染色法检测各组细胞凋亡情况取各组细胞在24孔板细胞爬片中铺板,每孔细胞数约为2×105个,培养48h。取出细胞爬片,采用4%多聚甲醛37℃固定30min,并以5%牛血清白蛋白37℃封闭1.5h。利用Hoechst 33342溶液在暗室中染色2min,通过荧光显微镜观察凋亡细胞,并计算细胞凋亡率。细胞凋亡率=[凋亡细胞数量(5个随机视野)/总细胞数量(5个随机视野)]×100%。
1.2.4.6ELISA法检测各组细胞外液TNF-α、IL-1β、IL-6蛋白的表达情况取各组细胞在24孔板中铺板,每孔细胞数约为2×105个,培养48h。收集各组细胞外液,将细胞外液加入反应板中37℃孵育1h,并加入生物素化抗体工作液37℃孵育1h。随后加入酶结合物工作液37℃避光孵育30min。最后加入显色底物37℃避光孵育15min。通过多功能酶标仪分析各组450nm波长下的A值,对比标准曲线,计算TNF-α、IL-1β、IL-6浓度。
1.2.4.7 小管形成实验检测各组新生毛细血管管腔样结构形成情况将24孔板用Matrigel基质胶均匀铺垫,放置30min使其硬化。取各组细胞在24孔板中铺板,每孔细胞数约为2×105个,培养24h。采用倒置显微镜观察新生毛细血管样结构形成情况。采用Image-J软件计算各组单个视野下新生毛细血管管腔样结构数量。
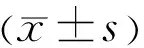
2 结果
2.1NG和HG细胞模型中miR-519d-3p和HIF-1α蛋白的表达情况比较实时荧光定量PCR法检测NG和HG细胞模型中miR-519d-3p的表达水平分别为0.039±0.005和0.022±0.003,且与NG比较,HG中miR-519d-3p表达水平显著减少,差异有统计学意义(t=9.62,P<0.01)。Western blotting法检测NG和HG细胞模型中HIF-1α蛋白的表达水平分别为0.104±0.009和0.627±0.044,且与NG比较,HG中HIF-1α蛋白表达水平显著增加,差异有统计学意义(t=26.53,P<0.01),见图1。

图1 Western blotting法检测NG和HG细胞模型中HIF-1α蛋白的表达情况。
2.2 各组细胞中miR-519d-3p和HIF-1α蛋白的表达情况比较实时荧光定量PCR法检测各组细胞中miR-519d-3p的表达情况比较,差异有统计学意义(F=171.89,P<0.01),且与对照组比较,miR-519d-3p过表达组和miR-519d-3p联合HIF-1α过表达组细胞中miR-519d-3p表达水平均显著增加,差异有统计学意义(t=38.90、29.16,均P<0.01)。Western blotting法检测各组细胞中HIF-1α蛋白的表达情况比较,差异有统计学意义(F=126.53,P<0.01),且与对照组比较,miR-519d-3p过表达组细胞中HIF-1α蛋白表达水平显著减少,而miR-519d-3p联合HIF-1α过表达组细胞中HIF-1α蛋白表达水平显著增加,差异有统计学意义(t=16.21、44.72,均P<0.01)。对照组和甘露醇组细胞中miR-519d-3p和HIF-1α蛋白的表达情况比较,差异无统计学意义(t=0.17、0.13,均P>0.05),见图2,表1。

表1 各组细胞中miR-519d-3p和HIF-1α蛋白的表达情况比较
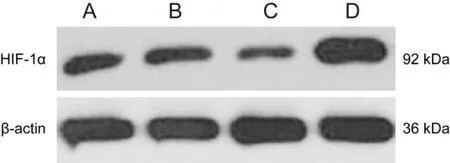
图2 Western blotting法检测各组细胞中HIF-1α蛋白的表达情况 A:对照组;B:甘露醇组;C:miR-519d-3p过表达组;D:miR-519d-3p联合HIF-1α过表达组。
2.3miR-519d-3p和HIF-1α的结合位点检测生物信息学分析显示,HIF-1α可能是miR-519d-3p的靶基因,miR-519d-3p中“CGUGAAA”序列可以与HIF-1α 3’-非编码区(3’-UTR)中“GCACUUU”序列特异性结合,见图3。荧光素酶报告基因实验检测对照组和miR-519d-3p过表达组细胞中HIF-1α-wt载体的相对荧光素酶活性分别为5.237±0.485和2.309±0.183,且与对照组比较,miR-519d-3p过表达组细胞中HIF-1α-wt载体的相对荧光素酶活性显著减少,差异有统计学意义(t=10.44,P<0.01);对照组和miR-519d-3p过表达组细胞中HIF-1α-mut载体的相对荧光素酶活性分别为5.081±0.357和4.837±0.392,差异无统计学意义(t=0.497,P>0.05)。

图3 miR-519d-3p和HIF-1α 3’-UTR之间的结合位点预测。
2.4 各组细胞增殖和凋亡情况比较CCK-8法检测各组细胞A值(24、48、72h)比较,差异有统计学意义(F=39.57、28.29、52.14,均P<0.01)。Hoechst 33342染色法检测各组细胞凋亡率比较,差异有统计学意义(F=74.46,P<0.01)。与对照组比较,miR-519d-3p过表达组细胞24、48、72h A值均显著增加,细胞凋亡率显著减少,差异有统计学意义(t=14.19、17.23、9.88、26.07,均P<0.01)。与miR-519d-3p过表达组比较,miR-519d-3p联合HIF-1α过表达组细胞24、48、72h A值均显著减少,细胞凋亡率显著增加,差异有统计学意义(t=4.65、8.41、5.32、32.02,均P<0.01)。对照组和甘露醇组细胞24、48、72h A值和细胞凋亡率比较差异无统计学意义(t=0.01、0.18、0.06、0.77,均P>0.05),见图4,表2。

表2 各组细胞不同时间点细胞增殖和凋亡率比较

图4 Hoechst 33342染色法检测各组细胞凋亡情况 A:对照组;B:甘露醇组;C:miR-519d-3p过表达组;D:miR-519d-3p联合HIF-1α过表达组。
2.5 各组细胞外液炎症因子表达和血管生成情况比较ELISA法检测各组细胞外液TNF-α、IL-1β、IL-6浓度比较,差异有统计学意义(F=65.59、74.91、57.88,均P<0.01)。小管形成实验检测各组中新生毛细血管管腔样结构数量比较,差异有统计学意义(F=163.50,P<0.01)。与对照组比较,miR-519d-3p过表达组中TNF-α、IL-1β、IL-6浓度均显著减少,新生毛细血管管腔样结构数量显著减少,差异有统计学意义(t=14.94、25.28、7.29、16.19,均P<0.01)。与miR-519d-3p过表达组比较,miR-519d-3p联合HIF-1α过表达组中TNF-α、IL-1β、IL-6浓度均显著增加,新生毛细血管管腔样结构数量显著增加,差异有统计学意义(t=7.32、17.05、26.81、6.34,均P<0.01)。对照组和甘露醇组中TNF-α、IL-1β、IL-6浓度和新生毛细血管管腔样结构数量比较,差异无统计学意义(t=0.20、0.32、0.55、0.17,均P>0.05),见图5,表3。

表3 各组细胞外液炎症因子表达和血管生成情况比较

图5 小管形成实验检测各组新生毛细血管管腔样结构形成情况 A:对照组;B:甘露醇组;C:miR-519d-3p过表达组;D:miR-519d-3p联合HIF-1α过表达组。
3 讨论
DR基本病理变化包括周细胞选择性缺失、毛细血管基底膜增厚、微血管瘤形成、内皮细胞增殖及新生血管导致的视网膜脱离。HRMEC在维持视网膜毛细血管的完整性方面发挥重要作用,高糖引起HRMEC功能障碍,破坏血-视网膜屏障,导致视网膜出血、渗出、脱离,促进DR的发生和恶化。研究发现,多种因素可以引起HRMEC功能障碍,如高级糖基化终产物积累、过氧化物酶体增殖体激活受体γ的失活、慢性炎症、氧化应激异常、生长因子及细胞因子表达失调等[8]。此外,高糖还会影响负责表观遗传修饰和非编码RNA功能的酶的活性,导致非编码RNA表达异常。近年来,miRNAs因其广泛的调节功能而受到青睐,目前已发表的8篇相关论文共报道了93个miRNAs在DR患者和非DR患者中呈差异表达,如miR-27b、miR-320a、miR-423-5p等[9],阐明这些miRNAs的作用机制将为DR治疗提供新的线索。HG诱导HRMEC细胞模型是研究DR的常用体外模型,可用于研究该病的分子机制及防治策略。本研究发现,高糖诱导HRMEC模型中miR-519d-3p表达下调,与既往文献[5]报道一致,表明结果可信。随后本研究通过一系列细胞实验证实,miR-519d-3p可以减轻高糖诱导的HRMEC功能障碍并抑制血管生成。
高糖可以引起视网膜内皮细胞的增殖失调,加速DR进展。同时,高糖还能诱导视网膜血管内皮细胞凋亡增加,而用抗氧化酶处理能保护细胞免受氧化应激,并降低细胞凋亡。研究显示,炎症因子包括TNF-α、IL-1β、IL-6在DR进展中起着重要作用[10]。持续的高血糖导致视网膜缺血性改变,刺激血管内皮生长因子释放,最终促进新生血管生成。近年研究表明,一些异常表达的miRNAs在DR的发生发展中发挥重要作用,如miR-15b、miR-181、miR-373、miR-425-5p等,利用这些miRNAs有望开发DR治疗的新靶点[11-14]。miR-519d-3p位于人基因组19q13.42区域,参与调控细胞增殖、凋亡和炎症等过程。本研究利用miR-519d-3p模拟物在高糖诱导的HRMEC模型中成功过表达miR-519d-3p,经CCK-8法和Hoechst 33342染色法发现,miR-519d-3p过表达组细胞24、48、72h吸光度值较对照组均显著增加,而细胞凋亡率较对照组显著减少。该结果与miR-519d-3p在其他类型细胞中的功能一致,提示miR-519d-3p在DR中具有促进细胞增殖作用。经ELISA法检测发现,miR-519d-3p过表达组细胞外液TNF-α、IL-1β、IL-6的浓度较对照组均显著减少,提示miR-519d-3p在DR中具有抗炎作用。这一结果与miR-519d-3p在初级成纤维细胞中促炎作用相悖,具体原因有待进一步考究。此外,小管形成实验结果显示,miR-519d-3p过表达组新生毛细血管管腔样结构数量较对照组显著减少,与既往文献[4]报道一致,提示miR-519d-3p在DR中具有抗血管生成作用。基于以上结果,可以得出miR-519d-3p在DR发生和发展中均具有重要作用。
众多研究表明,miRNAs参与负性调控目的基因表达,其作用方式主要通过与目的基因3’-UTR中特定核苷酸序列结合,进而导致转录或翻译过程抑制。经TargetScan 8.0(https://www.targetscan.org/vert_80/)、miRDB(https://mirdb.org/)、miRTarBase 7.0(https://mirtarbase.cuhk.edu.cn/)数据库预测miR-519d-3p调控的目的基因,发现HIF-1α预测分数较高,推测HIF-1α可能是miR-519d-3p的靶基因。先前关于胰腺导管腺癌细胞与子宫内膜上皮细胞的研究中也曾报道,miR-519d-3p对HIF-1α具有负调控作用[15-16]。本研究发现,miR-519d-3p过表达组中HIF-1α蛋白表达水平较对照组显著减少,提示miR-519d-3p对HIF-1α具有负调控作用。随后经荧光素酶报告基因实验验证miR-519d-3p中“CGUGAAA”序列可与HIF-1α中“GCACUUU”序列特异性结合,提示HIF-1α是miR-519d-3p的靶基因。
HIF-1α蛋白分子量约为92kDa,作为肿瘤治疗中的一个明星分子靶点,其广泛参与细胞增殖和凋亡、肿瘤转移、血管生成及葡萄糖代谢等过程[17]。近年来,HIF-1α被报道与糖尿病及其并发症的发生和发展密切相关。Ilegems等[18]研究揭示HIF-1α可以介导糖尿病小鼠模型中胰岛β细胞的损伤,而其抑制剂PX-478则可改善胰岛β细胞的胰岛素分泌指数。Zhang等[19]发现DR小鼠模型中视网膜血管生成与HIF-1α水平的增加密切相关,沉默HIF-1α可以降低血管内皮生长因子的表达,并以时间依赖的方式抑制血管生成。Jiang等[20]报道HIF-1α通过血红素氧合酶1介导的对线粒体动态控制可以改善糖尿病肾病的肾小管损伤。本研究发现,miR-519d-3p联合HIF-1α过表达组细胞24、48、72h 吸光度值较miR-519d-3p过表达组均显著减少,细胞凋亡率较miR-519d-3p过表达组显著增加,细胞外液TNF-α、IL-1β、IL-6浓度较miR-519d-3p过表达组均显著增加,新生毛细血管管腔样结构数量较miR-519d-3p过表达组显著增加,与既往文献[19]报道结果一致,提示HIF-1α可以逆转miR-519d-3p的作用。由此得出,HIF-1α是miR-519d-3p发挥功能的关键下游分子,miR-519d-3p/HIF-1α通路在DR发生和发展中均具有重要作用。
综上所述,高糖诱导HRMEC模型中miR-519d-3p表达下调,而HIF-1α蛋白表达上调。HIF-1α是miR-519d-3p的靶基因。miR-519d-3p靶向HIF-1α增加细胞增殖并降低细胞凋亡和炎症反应,从而减轻高糖诱导的HRMEC功能障碍并抑制血管生成。本研究尚存几点不足:(1)由于本研究不涉及组织样本,故未能检测miR-519d-3p和HIF-1α表达水平的相关性;(2)未能从基因干扰层面观察沉默miR-519d-3p对高糖诱导的HRMEC功能障碍和血管生成的影响;(3)未能使用HIF-1α抑制剂佐证miR-519d-3p/HIF-1α通路的功能。

