糖通饮经miRNA-21/TGF-β1/Smad信号转导对糖尿病肾病大鼠肾脏功能的保护作用
潘艳伶,陈洪民,伏红颖,杨红,凌湘力(.贵州医科大学附属医院,贵州 贵阳 550004;.贵州医科大学,贵州 贵阳 550004)
糖尿病肾病(Diabetic nephropathy,DN)是糖尿病患者最常见的并发症之一,也是导致终末期肾病的主要因素。近年研究[1]表明,DN 的发病机制可能与炎症、氧化应激、糖脂代谢紊乱、肾脏血流动力学紊乱等有关。在临床上糖尿病一旦引发肾脏损伤,即使采取综合治疗,将血糖、血压、血脂等控制在理想范围内,仍不能阻止DN 的持续性恶化[2]。因此探寻有效治疗靶点,对DN 进行积极防治具有重要意义。
转化生长因子β1(TGF-β1)与DN 密切相关,是其发病的核心因子,可通过活化Smad 信号通路,刺激细胞外基质聚集和生成,最终导致肾小球硬化,加速DN 进展[3]。而MicroRNA-21(miRNA-21)是细胞转录调节水平的相关因子,可通过影响肾小球内皮新生细胞的形态、肾小球滤过膜屏障完整性等促进蛋白尿、管型尿等的发生,加剧DN 病情的恶化[4]。其在导致DN 肾脏损伤,影响肾功能过程中起着重要作用,有望成为治疗DN 的新靶点。且有研究[5-6]证明,miRNA-21 与TGF-β1/Smad3 通路存在联系,在糖尿病状态下,miRNA-21 参与TGF-β1/Smad3 通路诱导肾小球硬化和肾间质纤维化损伤,影响肾脏功能。
全国名中医凌湘力教授根据DN 气阴两虚、痰瘀浊毒阻络的病机,创制了经验方“糖通饮”。该方可以保护DN 患者肾功能,且在减轻蛋白尿、改善糖脂代谢方面具有一定优势,长期应用于临床取得较好疗效[7],但作用机制尚不清楚。故本研究拟基于miRNA-21/TGF-β1/Smad 信号转导探讨糖通饮对DN大鼠的肾脏保护作用,以期进一步明确其防治DN 的分子机制。
1 材料与方法
1.1 动物健康雄性SD 大鼠60 只,SPF 级,体质量(180±20)g,由辽宁长生生物技术公司提供,动物质量合格证号:210726201100220348,动物生产许可证号:SCXK(辽)2020-0001。本实验经贵州医科大学实验动物伦理委员会批准,批文号:2000575。
1.2 药物及试剂糖通饮颗粒制剂,广东一方制药公司,批号:2011273;厄贝沙坦片,长春修正药业集团公司,批号:210805。高脂高糖饲料(常规饲料58%、精炼猪油20%、蔗糖20%、胆固醇2%),长春长生生物科技公司,批号:20210922;链脲佐菌素(STZ),美国Sigma 公司,批号:V 900890;0.1 mol·L-1柠檬酸钠缓冲液(pH=4.5)、苏木素-伊红(HE)染色试剂盒、过碘酸雪夫氏(PAS)染色试剂盒,北京索莱宝科技公司,批号:C1013、G1120、G1281;兔抗TGF-β1单克隆抗体、兔抗Smad2 单克隆抗体、兔抗Smad3 单克隆抗体,英国Abcam 公司,批号:EPR18163、EP784Y、EP568Y;兔抗p-Smad3 单克隆抗体、兔抗p-Smad2 单克隆抗体,美国Cell Signaling Technology 公司,批号:#3108、#9520;抗Ⅲ型胶原(Col-Ⅲ)单克隆抗体,武汉三鹰生物技术公司,批号:22734-1-AP;血糖试纸,美国强生公司,批号:4720780;空腹血糖、血尿素氮、血肌酐、总胆固醇、甘油三酯检测试剂,德国Roche 公司,批号:61397401、63750501、62531101、64336501、60813801;尿蛋白定量试剂盒,南京建成生物工程研究所,批号:C035-2-1;逆转录试剂盒、PCR 荧光定量试剂盒,上海翊圣生物科技公司,批号:11141ES10、1184ES25;miRNA 荧光定量PCR 试剂盒,广州锐博生物技术公司,批号:R11068.5;BCA 蛋白浓度测定试剂盒,上海碧云天生物技术公司,批号:P0010S。
1.3 主要仪器稳豪倍易型血糖仪,美国强生公司;Cobas c702 型全自动生化分析仪,德国Roche 公司;1730R 型高速冷冻离心机,上海贝晶生物技术公司;TGL-20M 型高速冷冻离心机,湖南迈克尔实验仪器公司;Tanon-5200 型化学发光成像分析系统,上海天能科技公司;CFX96 型实时荧光定量PCR 仪,美国Bio-Rad 公司;HistoCore 切片机,德国Leica 公司;BX53 型生物显微镜,日本OLYPUMS 公司;WD-2102B 型全自动酶标仪、DYCZ-24DN 型迷你双垂直电泳仪、DYCZ-40D 型迷你转印电泳仪,北京六一生物科技公司。
1.4 分组、模型复制及给药60 只雄性SD 大鼠适应性喂养1 周后,随机抽取10 只作为正常组,其余50 只作为造模组,进行DN 模型复制。正常组给予常规饲料喂养,其余大鼠给予高脂高糖饲料喂养;8 周后所有大鼠禁食不禁水12 h,对造模组大鼠给予含1% STZ 的柠檬酸-柠檬酸钠缓冲液(pH=4.5),按20、25、30 mg·kg-1行腹腔注射,共3 次,每次间隔72 h;正常组则注射相应剂量的柠檬酸钠缓冲液。于末次注射72 h 后检测大鼠空腹血糖3 次(每次间隔24 h),若空腹血糖≥16.7 mmol·L-1,且伴有明显的饮水量和尿量增加,则判定大鼠2 型糖尿病模型复制成功。
高脂高糖饲料继续喂养2 型糖尿病模型大鼠3 周后,转移至代谢笼,收集24 h 尿液,24 h 尿蛋白定量≥30 mg,则判定DN 大鼠模型形成[8]。将50 只DN大鼠随机分为模型组、厄贝沙坦组(13.5 mg·kg-1,临床等效剂量)及糖通饮低、中、高剂量组(6.21、12.42、24.84 g·kg-1,为临床等效剂量的0.5、1、2 倍),每组10 只;灌胃给药,每日1 次,连续8 周;对照组与模型组给予等体积生理盐水灌胃。
1.5 考马斯亮蓝法检测24 h 尿蛋白灌胃8 周后,代谢笼收集大鼠24 h 尿液,记录各组大鼠24 h 尿液总量;将收集好的24 h 尿液以3 000 r·min-1(离心半径8 cm)离心10 min,取上清液。严格按照尿蛋白定量试剂盒说明书步骤进行操作,采用酶标仪以波长595 nm、光径1 cm、双蒸水调零,测定各管吸光度,并按照说明书方法计算24 h 尿蛋白定量。
1.6 全自动生化分析仪检测血清空腹血糖、血尿素氮、血肌酐、总胆固醇、甘油三酯水平给药结束后,禁食不禁水12 h,股动脉取血,以3 000 r·min-1(离心半径8 cm)离心10 min,取血清,采用全自动生化分析仪检测各组大鼠空腹血糖、血尿素氮、血肌酐、总胆固醇、甘油三酯水平。
1.7 HE 及PAS 染色法观察肾组织病理改变给药结束后处死大鼠,取各组大鼠左肾置于4%多聚甲醛溶液中固定48 h;经乙醇梯度脱水、石蜡包埋后制成4 μm 厚度的切片。将各组切片经二甲苯脱蜡、乙醇梯度脱水后,分别严格按照试剂盒说明书步骤进行HE 及PAS 染色;乙醇梯度脱水,二甲苯透明,中性树胶封片;于光镜下观察各组大鼠肾组织病理改变。
1.8 RT-PCR 法检测肾组织miRNA-21、TGF-β1、Smad2、Smad3、Col-III mRNA 表达水平取各组大鼠右肾组织0.05 g,TRIzol 法分离纯化肾组织总RNA,检测RNA 纯度和含量;按照试剂盒说明书行逆转录,反应条件:25 ℃、5 min,42 ℃、30 min,85 ℃、5 min,4 ℃、5 min;用RT-PCR 试剂盒配制20 μL PCR 反应体系,反应条件:预变性95 ℃、15 min,变性95 ℃、10 s,退火60 ℃、30 s,循环40 次,单个样本重复检测3 次。扩增反应后行熔解曲线分析,判断产物是否有非特异性扩增;分析扩增曲线,计算Ct 值,以U6/GAPDH 作为内参,采用2-ΔΔCt法进行相对定量分析。检测miRNA-21 mRNA表达,以U6 作为内参,引物由广州RiboBio 公司设计合成;检测TGF-β1、Smad2、Smad3、Col-ⅢmRNA 表达,以GAPDH 为内参,引物均由上海Sangon 公司设计合成,引物序列见表1。

表1 RT-PCR 引物序列Table 1 The RT-PCR primer sequences
1.9 Western Blot 法检测肾组织TGF-β1、Smad2、Smad3、p-Smad2、p-Smad3、Col-Ⅲ蛋白表达取各组大鼠右肾组织0.1 g,加入500 μL 含有PMSF的RIPA 裂解缓冲液(含有1%磷酸酶抑制剂∶1%PMSF)进行组织匀浆;以12 000 r·min-1(离心半径8 cm)离心20 min,取上清;采用BCA 法检测肾组织蛋白浓度。加入1.5×上样缓冲液,煮沸后,经聚丙烯酰胺凝胶电泳分离蛋白,将其转移至PVDF 膜上;用5 %脱脂牛奶封闭,1×TBST 洗膜后,分别孵育一抗GAPDH(1∶7 000)、TGF-β1(1∶1 000)、Smad2(1∶1 000)、Smad3(1∶1 000)、p-Smad2(1∶1 000)、p-Smad3(1∶1 000)、Col-Ⅲ(1∶1 000),4 ℃下过夜,洗涤;根据抗体的种属特异性加入HRP 标记的不同来源的二抗(1∶7 000),常温下孵育1 h;采用增强化学发光法显色,使用天能凝胶成像系统曝光、拍照;采用ImageJ 软件对各蛋白条带灰度值进行半定量分析,以目的蛋白与GAPDH(内参)的比值表示其相对表达量。
1.10 统计学处理方法采用SPSS 26.0 统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 糖通饮对DN 大鼠一般情况的影响正常组大鼠反应灵敏,皮毛、饮食、大小便均正常;模型组大鼠出现活动减少,消瘦,毛色暗淡及多饮、多食、多尿表现。与模型组比较,给药组大鼠普遍出现活动增多,毛色较光亮,多饮、多食得到改善,以糖通饮中、高剂量组及厄贝沙坦组改善明显。结果表明,糖通饮能改善DN 大鼠的精神状态、活动、饮食等一般情况。
2.2 糖通饮对DN 大鼠相关生化指标的影响结果见表2。与正常组比较,模型组的空腹血糖、24 h 尿蛋白、血尿素氮、血肌酐、总胆固醇、甘油三酯水平均明显升高(P<0.05)。与模型组比较,糖通饮各剂量组的空腹血糖、24 h 尿蛋白、血尿素氮、血肌酐、总胆固醇、甘油三酯水平均明显降低(P<0.05),且以糖通饮中、高剂量组降低更为明显;厄贝沙坦组的空腹血糖、总胆固醇、甘油三酯无明显变化(P>0.05),其余指标明显降低(P<0.05)。结果表明,糖通饮在降低DN 大鼠血糖、血脂水平的同时,对其肾功能具有一定保护作用。
表2 糖通饮对糖尿病肾病大鼠相关生化指标的影响(±s,n=6)Table 2 Effect of Tangtong Drink on biochemical indicators in diabetic nephropathy model rats(±s,n=6)
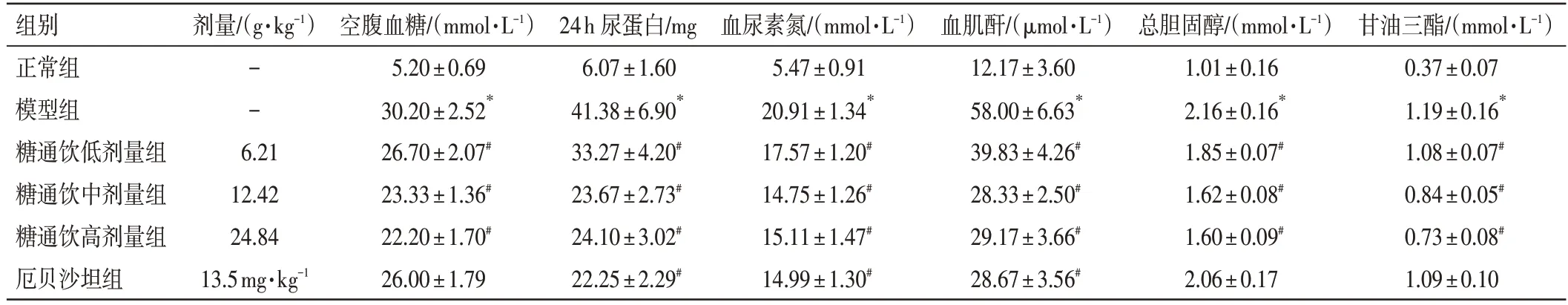
表2 糖通饮对糖尿病肾病大鼠相关生化指标的影响(±s,n=6)Table 2 Effect of Tangtong Drink on biochemical indicators in diabetic nephropathy model rats(±s,n=6)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
甘油三酯/(mmol·L-1)0.37±0.07 1.19±0.16*1.08±0.07#0.84±0.05#0.73±0.08#1.09±0.10组别正常组模型组糖通饮低剂量组糖通饮中剂量组糖通饮高剂量组厄贝沙坦组剂量/(g·kg-1)--6.21 12.42 24.84 13.5mg·kg-1空腹血糖/(mmol·L-1)5.20±0.69 30.20±2.52*26.70±2.07#23.33±1.36#22.20±1.70#26.00±1.79 24h 尿蛋白/mg 6.07±1.60 41.38±6.90*33.27±4.20#23.67±2.73#24.10±3.02#22.25±2.29#血尿素氮/(mmol·L-1)5.47±0.91 20.91±1.34*17.57±1.20#14.75±1.26#15.11±1.47#14.99±1.30#血肌酐/(μmol·L-1)12.17±3.60 58.00±6.63*39.83±4.26#28.33±2.50#29.17±3.66#28.67±3.56#总胆固醇/(mmol·L-1)1.01±0.16 2.16±0.16*1.85±0.07#1.62±0.08#1.60±0.09#2.06±0.17
2.3 糖通饮对DN 大鼠肾脏组织病理变化的影响HE染色结果见图1-A。正常组肾脏结构清晰完整;模型组肾小球系膜细胞增生,基底膜增厚,肾小管萎缩,小管间质间均可见有炎性细胞的浸润。与模型组比较,各给药组的肾小球和肾小管病变程度均出现减轻,且以糖通饮中、高剂量组及厄贝沙坦组改善更明显。
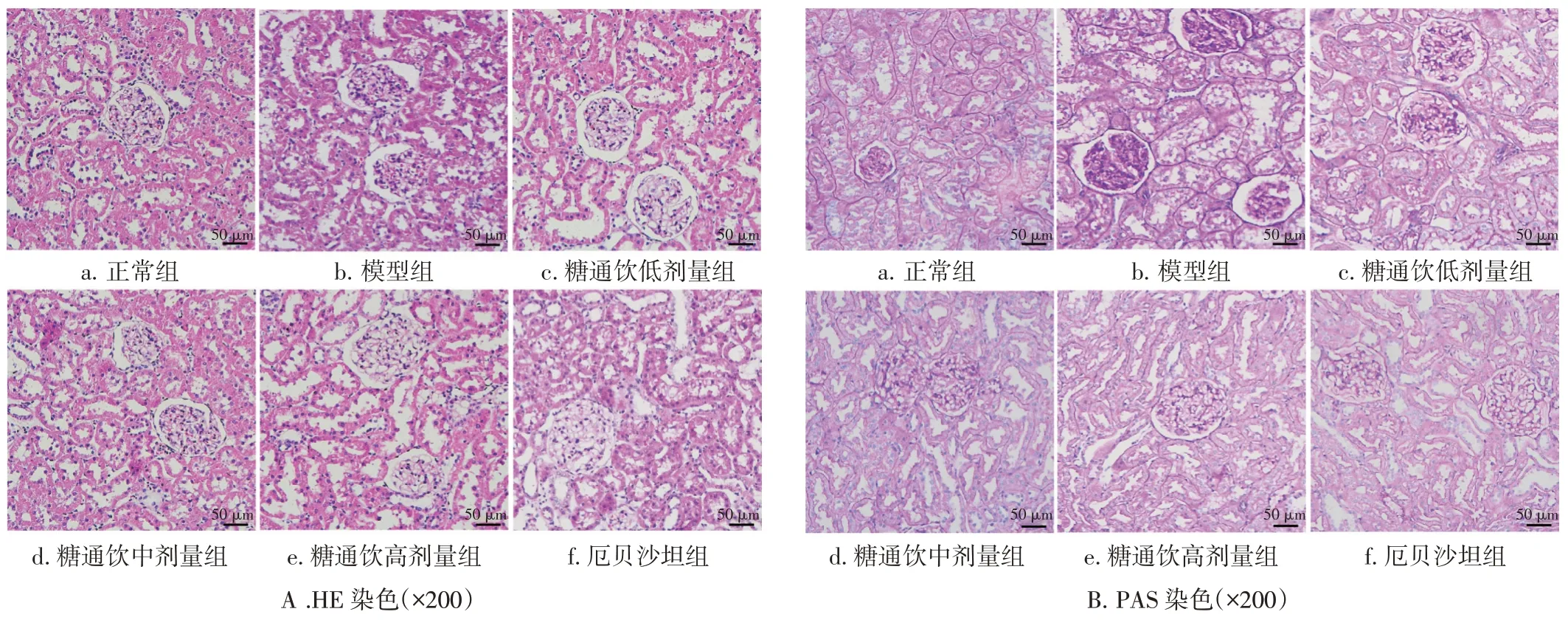
图1 糖通饮对糖尿病肾病大鼠肾脏组织病理变化的影响Figure 1 The effect of Tangtong Drink on renal histopathological changes in diabetic nephropathy model rats
PAS 染色结果见图1-B。正常组PAS 阳性染色物质主要沿肾小球毛细血管壁及肾小管壁散在分布,其间并未出现阳性物质的沉积;模型组肾小球系膜区可见明显阳性物质的沉积。与模型组比较,各给药组PAS 阳性染色物质均有不同程度减少,其中以糖通饮中、高剂量组及厄贝沙坦组改善更明显。结果表明,糖通饮能有效改善DN 大鼠肾脏组织的病理变化。
2.4 糖通饮对DN 大鼠肾组织miRNA-21、TGF-β1、Smad2、Smad3、Col-ⅢmRNA 表达的影响结果见图2。与正常组比较,模型组大鼠肾组织miRNA-21、TGF-β1、Smad2、Smad3、Col-ⅢmRNA 表达均明显上调(P<0.05)。与模型组比较,糖通饮中、高剂量组及厄贝沙坦组大鼠肾组织miRNA-21、TGF-β1、Smad2、Smad3、Col-ⅢmRNA 表达均明显下调(P<0.05)。
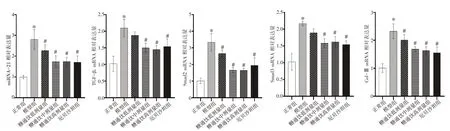
图2 各组大鼠肾脏组织miRNA-21、TGF-β1、Smad2、Smad3、Col-ⅢmRNA 相对表达水平比较(±s,n=6)Figure 2 Comparison of relative mRNA expression levels of miRNA-21,TGF-β1,Smad2,Smad3 and Col-Ⅲin renal tissue among each group of rats(±s,n=6)
2.5 糖通饮对DN 大鼠肾组织TGF-β1、Smad2、Smad3、p-Smad2、p-Smad3、Col-Ⅲ蛋白表达的影响结果见图3。与正常组比较,模型组大鼠肾组织TGF-β1、Smad2、Smad3、p-Smad2、p-Smad3、Col-Ⅲ蛋白表达均明显上调(P<0.05)。与模型组比较,糖通饮中、高剂量组及厄贝沙坦组大鼠肾组织TGF-β1、Smad2、Smad3、p-Smad2、p-Smad3、Col-Ⅲ蛋白表达均明显下调(P<0.05)。

图3 各组大鼠肾脏组织TGF-β1、Smad2、Smad3、p-Smad2、p-Smad3、Col-Ⅲ蛋白相对表达水平比较(±s,n=6)Figure 3 Comparison of relative protein expression levels of TGF-β1,Smad2,Smad3,p-Smad2,p-Smad3 and Col-Ⅲin the renal tissue among each group of rats(±s,n=6)
3 讨论
糖尿病肾病(DN)在临床上主要表现为持续性的蛋白尿,而在病理上主要表现为肾小球肥厚、肾小球基底膜均质性增厚[9]。DN 属中医“消渴”变证,按其临床表现当属于消渴并“虚劳”“肾劳”“水肿”等范畴,中医医家大都认为本病是肺、脾、肾三脏相干所致。全国名中医凌湘力教授认为,DN 作为中医消渴久病引发的变证之一,是在气阴两虚为本的基础上进一步演变而来。因消渴日久耗伤气阴,气虚则推动血液、津液运行乏力,阴虚血亏则血行不畅,日久累聚成瘀,与痰浊胶结,久蕴可生成热毒,内生诸邪阻滞肾络,肾络受阻,肾不藏精,精微下泄而出现蛋白尿;精微流失日久又加重气阴耗伤,故DN 是虚实夹杂互损之复杂病证,其本为气阴俱虚,其标为痰瘀毒浊,病位在肾而涉及肝、脾。凌湘力教授根据DN 病机立法创制“糖通饮”[7],方中君药黄芪及臣药生地黄、山药、山萸肉培补肝肾、调养气阴以固本虚;佐使药以丹参、丹皮、地骨皮、茯苓、草决明、泽泻入方,以求标实痰瘀浊毒得除,肾络得以疏通;诸药合用具有益气养阴保肾、清热活血化痰泄浊之功,全方补泄兼施,标本同治。
现代药理研究显示,黄芪的有效成分黄芪多糖、黄芪甲苷等能提高胰岛素敏感性,双向调节糖代谢,通过调节内质网应激、减轻炎症反应、减少细胞凋亡、抑制肾纤维化进程等机制来发挥对DN 的治疗作用[10]。生地黄的有效成分地黄多糖、梓醇等能有效降糖、降脂,改善胰岛素抵抗[11],并能减轻糖尿病大鼠血管氧化应激损伤,减少TGF-β1、结缔组织生长因子等加重肾脏负担的因子表达[12]。山茱萸中的环烯醚萜苷能够改善糖尿病血管病变大鼠的肾小球内基质增生、基底膜增厚,保护血管内皮[13]。山药所含山药多糖亦被证实有显著降糖作用,能改善糖耐量[14]。地骨皮及泽泻具有良好的降血糖、降血脂作用[15-16],且地骨皮中的有效成分甜菜碱、山柰酚能有效抑制肾小球系膜细胞异常增殖与细胞外基质过度分泌,延缓肾小球硬化的发展[17]。茯苓多糖与丹参多酚酸盐具有抑制肾间质纤维化,延缓近端小管损伤,减少蛋白尿的作用[18-19]。丹皮及草决明的有效成分亦能通过抑制晚期糖基化终末产物的积累来延缓DN 进程[20-21]。本研究结果亦表明,糖通饮能有效降低DN 大鼠尿蛋白,减轻肾脏损伤,保护肾功能,并同时具备降低血糖、血脂,改善其糖脂代谢的作用。
DN 的发病由诸多因子参与,TGF-β1被认为是DN 发病过程中的中心环节,处于DN 相关生长因子网络中心地位[22]。在DN 发生发展中,高糖、炎症因子、氧化应激等多种因素均可使TGF-β1激活并磷酸化与其具有高度亲和力的Tβ2R 受体,并结合形成复合物;然后与Tβ1R 结合,其丝-苏氨酸残基区通过磷酸化被激活;活化的Tβ1R 与受体活化性Smad 蛋白2/3 结合,Smad2/3 磷酸化后再与Co-Smad(Smad4)结合形成低聚体复合物;经过R-Smad—Co-Smad 模式转位到细胞核中,激活核内细胞外基质成分的启动因子成分,从而使细胞外基质增加,使DN的肾脏病变呈进行性发展[23]。研究[24]表明,TGF-β1与其下游的Smad2/3 在DN 模型动物及DN 患者的肾小球、肾小管和肾小管间质中的表达显著上调。
miRNA-21 是一个特殊的miRNA,其差异性表达与肾脏的纤维化相关,其在正常肾脏组织中表达少,而在DN 模型动物的肾小管间质和肾小球纤维化区域皆高表达[25],即DN 肾脏病变程度及肾功能损伤与miRNA-21 的表达呈正相关。有研究[26]证实,miRNA-21 基因缺失能够保护DN 小鼠肾脏,抑制肾脏纤维化,保护其肾脏功能,其机制可能与调控TGF-β1及相关基质蛋白有关。本研究结果发现,与正常组比较,DN 大鼠肾脏组织miRNA-21、TGF-β1、Smad2、Smad3、Col-ⅢmRNA 表达均明显上调,TGF-β1、Smad2、Smad3、p-Smad2、p-Smad3、Col-Ⅲ蛋白表达亦明显上调。而与模型组比较,糖通饮给药组大鼠肾脏组织miRNA-21、TGF-β1、Smad2、Smad3、Col-ⅢmRNA 表达均明显下调,TGF-β1、Smad2、Smad3、p-Smad2、p-Smad3、Col-Ⅲ蛋白表达亦明显下调。
综上所述,糖通饮可能通过下调miRNA-21 的表达,抑制TGF-β1/Samd 信号转导,从而有效降低细胞外基质进行性累积,从而改善DN 大鼠的肾脏损伤,保护其肾脏功能。

