miRNA-34a联合miRNA-4530在乳腺癌中的表达及其对新辅助化疗疗效的预测
张 静 石义鹭 王 妍 张 洋 欧瑞津 闫 敏 王晓宇 孙 平
1.牡丹江医学院解剖教研室,黑龙江牡丹江 157000;2.牡丹江医学院附属红旗医院,黑龙江牡丹江 157000;3.牡丹江医学院病原教研室,黑龙江牡丹江 157000;4.牡丹江医学院基础医学院,黑龙江牡丹江 157000
尽管目前已有一些分子标志物可用于预测乳腺癌新辅助化疗疗效,但因价格昂贵而临床应用受限[1-2]。因此,临床急需准确、创伤小、可重复、并方便检测的新型标志物[3-4]。本研究探讨循环血miRNA-34a、miRNA-4530 水平与乳腺癌患者新辅助化疗效果的关系,以验证前期研究结果,为后续研究提供基础。并分析循环血miRNA-34a 水平、miRNA-4530 水平、miRNA-34a 联合miRNA-4530对乳腺癌新辅助化疗疗效的预测效能。
1 资料与方法
1.1 一般资料
选取2020 年1—12 月经牡丹江医学院附属红旗医院就诊的70 例进行新辅助化疗的原发性乳腺癌患者,依据新辅助化疗疗效将完全缓解(complete remission,CR)和部分缓解(partial remission,PR)划分为敏感组,疾病进展(disease progression,PD)和稳定(stablize disease,SD)划分为耐药组,每组各35 例。敏感组患者年龄35 ~65 岁,平均(52.45±8.69)岁;病理分期:Ⅱ期20 例,Ⅲ期15 例;分子分型:Luminal A 型13 例,Luminal B 型10 例,人表皮生长因子受体-2(human epidermal growth factor receptor-2, HER-2)过表达型8 例,三阴型4 例。耐药组患者年龄36 ~66 岁,平均(52.85±8.46)岁;病理分期:Ⅱ期21 例,Ⅲ期14 例;分子分型:Luminal A 型14 例,Luminal B 型11 例,HER-2 过表达型7 例,三阴型3 例。两组患者一般资料比较,差异无统计学意义(P> 0.05),具有可比性。本研究通过医院医学伦理委员会批准,患者均知情同意。
纳入标准:均由病理检查确诊;临床分期为Ⅱ、Ⅲ期;年龄≥18 岁;预计患者生存期≥8 周,预计新辅助化疗周期为6 ~8 周。排除标准:既往接受过新辅助化疗者;合并有其他组织器官恶性肿瘤者。
1.2 方法
1.2.1 循环血miRNA-34a、miRNA-4530 的检测 分别于开始化疗前,第1 个、第2 个化疗周期结束,化疗结束时,所有患者抽取空腹肘正中静脉血液5 ~10 ml,真空采血管收集,室温静置30 min 后,4℃下1600 r/min 离心10 min 获得血浆,放置于-80℃备用。利用RT-RNA 法检测循环血miRNA-34a、miRNA-4530 表达。
1.2.2 循环血miRNA-34a、miRNA-4530 水平与乳腺癌患者新辅助化疗效果的关系 根据前述分组,利用SPSS 20.0 统计学软件,对敏感组和耐药组患者循环血miRNA-34a、miRNA-4530 水平进行对比分析,以验证前期研究结果,为后续研究提供基础。
1.2.3 循环血miRNA-34a、miRNA-4530 水平预测乳腺癌新辅助化疗疗效的效能 根据前述检测结果,利用SPSS 20.0 统计学软件,采用受试者工作曲线(receiver operating curve, ROC)分析循环血miRNA-34a水平、miRNA-4530 水平、miRNA-34a 联合miRNA-4530预测乳腺癌新辅助化疗疗效的效能[4]。
1.3 疗效评定标准
根据实体瘤疗效评估标准(solid tumor response evaluation criteria, RECIST),对所有纳入研究中的采用主流药物蒽环类+紫杉类(anthracyclines+taxoids,EC-T)化疗6 ~8 周期的乳腺癌患者进行评估。所有靶病灶完全消失为CR;靶病灶直径之和比基线水平减少至少30% 为PR;以整个研究过程中所有测量的靶病灶直径之和的最小值为参照,靶病灶直径之和相对增加至少20% 或出现一个或多个新病灶视为PD;靶病灶减小的程度未达到PR,增加的程度也未达到PD 水平,介于两者之间视为SD[5]。
1.4 统计学方法
采用SPSS 21.0 统计学软件进行数据处理,计量资料用均数±标准差(s)表示,采用t检验及方差分析,计数资料用[n(%)]表示,采用χ2检验,P< 0.05 为差异有统计学意义。预测效能的分析使用ROC 曲线分析敏感度与特异度。
2 结果
2.1 不同病理分期、分子分型患者的循环血miRNA-34a、miRNA-4530的检测结果比较
病理分期Ⅱ期患者的循环血miRNA-34a、miRNA-4530 表达水平均高于Ⅲ期患者,差异有统计学意义(P< 0.05),分子分型Luminal A 型、Luminal B 型、HER-2 过表达型、三阴型患者的循环血miRNA-34a、miRNA-4530 表达水平均逐渐降低,差异有统计学意义(P< 0.05)。见表1。

表1 不同病理分期、分子分型患者的循环血miRNA-34a、miRNA-4530的检测结果比较(x ± s)
2.2 两组循环血miRNA-34a、miRNA-4530水平比较
敏感组患者的循环血miRNA-34a、miRNA-4530表达水平均高于耐药组,差异有统计学意义(P< 0.05),见表2。

表2 两组循环血miRNA-34a、miRNA-4530水平比较(x ± s)
2.3 循环血miRNA-34a、miRNA-4530水平预测乳腺癌新辅助化疗疗效的效能分析
循环血miRNA-34a、miRNA-4530 表达水平联合检测预测乳腺癌新辅助化疗疗效的敏感度、特异度高于单独检测,差异有统计学意义(P< 0.05),见表3。
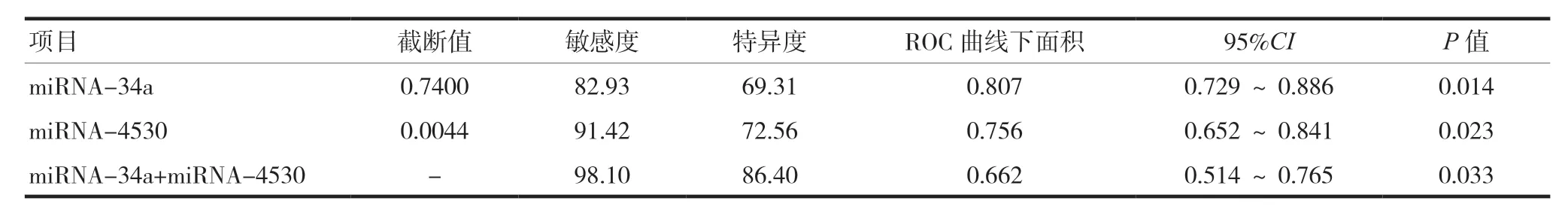
表3 循环血miRNA-34a、miRNA-4530水平预测乳腺癌新辅助化疗疗效的效能分析
3 讨论
检测外周血miRNA 采样简单、价格低廉、可连续动态监测[6-7]。已有研究证实,循环血miRNA-34a表达水平的变化能对新辅助化疗的疗效进行准确地预测,但具有较长的敏感时间,需要到化疗的第二个周期[8]。此外,循环血miRNA-4530 也可作为预测化学治疗反应性的标志物,但诊断效能较低[9]。理论上讲,将循环血miRNA-34a 和miRNA-4530联合作为跟踪和预测乳腺癌新辅助化疗反应性的标志物,则可避免单一miRNAs 预测效能低下,增加其预测敏感度和特异度[10]。如能实现这一研究目标,则会将新的可能性提供给乳腺癌新辅助化疗疗效预测,将提给乳腺癌的临床治疗供更进一步的依据,减少患者不必要的治疗,为乳腺癌患者争取手术及有效治疗的机会。
有研究[11]通过分析乳腺癌患者的血清miRNA-34 水平,并在新辅助化疗前、化疗第2 个周期、化疗结束时重复检测,发现化疗前,乳腺癌患者的血清miRNA-34 表达水平明显高于健康志愿者;化疗前、化疗第2 个周期、化疗结束时,治疗有效组和无效组患者的血清miRNA-34 水平之间的差异均无统计学意义;治疗反应和血清miR-34表达水平变化关系密切;化疗第2 周期、化疗结束时,治疗有效组患者的血清miR-34 水平均低于化疗前,但无效组变化不明显。ROC 曲线显示,血清miRNA-34 表达水平的变化能对新辅助化疗的疗效进行准确地预测。但是应该注意,在乳腺癌新辅助化疗疗效的预测中,循环血miRNA-34 水平在化疗第2 周期后才有统计学意义。新辅助化疗治疗乳腺癌患者的化疗周期为3 周,化疗2 个周期为6 周,而通常情况下,患者化疗周期为4 ~6 个。可以看出,在新辅助化疗疗效的预测中,虽然外周血miRNA-34 表达水平变化能够将准确依据提供出来,但是单一依靠miRNA-34 具有较晚的表现时间,这就对其临床应用造成了一定程度的限制[12]。
随后,有研究通过分析78 例Ⅱ~Ⅲ期接受新辅助化疗的乳腺癌患者,结果表明,ROC 曲线分析结果显示,曲线下面积为0.662,具有一定的预测价值[13-14]。此外,也有研究证实[15-16],miRNA-4530 通过靶向乳腺癌细胞中的血管生成抑制蛋白1(vasohibin 1,VASH1促进血管生成,对乳腺癌生物活性起到影响。由此可见,外周血miRNA-4530 水平也可作为对乳腺癌新辅助化疗疗效进行预测的指标之一,但其预测效能较低,AUC 仅为0.662。
目前关于miRNAs 预测乳腺癌新辅助化疗疗效的研究中,已有多项研究联合≥2 个miRNAs 进行预测,其目的是避免单一miRNAs 预测效能低下,增加其预测敏感度和特异度[17-18]。本研究结果表明,病理分期Ⅱ期患者的循环血miRNA-34a、miRNA-4530 表达水平均高于Ⅲ期患者,差异有统计学意义(P< 0.05),分子分型Luminal A 型、Luminal B 型、HER-2 过表达型、三阴型患者的循环血miRNA-34a、miRNA-4530 表达水平均逐渐降低,差异有统计学意义(P< 0.05)。敏感组患者的循环血miRNA-34a、miRNA-4530 表达水平均高于耐药组,差异有统计学意义(P< 0.05)。循环血miRNA-34a、miRNA-4530 表达水平联合检测预测乳腺癌新辅助化疗疗效的灵敏度、特异度高于单独检测,差异有统计学意义(P< 0.05),证实联合检测价值高。
不足之处在于样本数量较少、观察时间较短,造成研究结果可能存在偏差,今后应该扩大样本量、延长随访时间,进行进一步深入细致的研究。
综上所述,乳腺癌中的miRNA-34a联合miRNA-4530表达预测新辅助化疗疗效的价值高,值得推广。

