猪多杀性巴氏杆菌的分离鉴定、血清分型及耐药性分析
张哲玮,曹维维,代小童,甘 晶,饶 静,袁 龙,贝为成
(1.华中农业大学 动物医学院 农业微生物学国家重点实验室,湖北 武汉 430070;2.湖北洪山实验室,湖北 武汉 430070;3.广西扬翔农牧有限责任公司,广西 贵港 537100;4.生猪健康养殖协同创新中心,湖北 武汉 430070)
多杀性巴氏杆菌(Pasteurellamultocida,Pm)属于巴氏杆菌科,巴氏杆菌属,是动物呼吸道重要病原菌,可造成猪、牛、羊、兔、禽、野生动物和宠物等多种宿主感染,具有极强的致病性[1]。猪Pm能引发猪肺疫和猪萎缩性鼻炎[2],造成严重的呼吸道症状并诱发其他病原混合或继发感染,增加死亡率,降低饲料转化率,对我国养猪业造成严重的经济损失[3]。根据Pm荚膜抗原的差异,可将其分为A、B、D、E、F 5种血清型,其中A型和D型主要引起猪肺疫,此外D型还可以引起猪传染性萎缩性鼻炎,而B型则能引起出血性败血症。近10年,我国Pm的优势血清型主要为A型和D型,但研究显示A型的检出率已逐年高于D型[4-6]。目前Pm的商品化疫苗无法提供有效保护,猪场更多依赖抗生素进行防治,然而滥用抗生素造成的多重耐药现象给该病的防控带来了极大挑战。
本研究通过收集不用地区规模化养猪场中具有呼吸道症状猪的口鼻拭子及组织病料,通过细菌分离鉴定、生化试验及血清分型,明确猪多杀性巴氏杆菌病在该地区的流行现状,进而对分离菌株的耐药性和致病性进行探究,旨在为猪场的精准用药、减缓Pm耐药性及疫苗的研发提供科学依据和防控方案。
1 材料与方法
1.1 材料
1.1.1病料及试验动物 病料主要来源于广西、湖北、内蒙古3个省规模化养猪场中有呼吸道症状猪的口鼻拭子及组织病料。SPF级,6~8周龄,体质量20 g左右的雌性昆明小鼠购买及饲养于华中农业大学实验动物中心。
1.1.2培养基及主要试剂 胰蛋白胨大豆肉汤培养基(TSB)、胰蛋白胨大豆琼脂培养基(TSA)购自BD Difco公司;DL2000 DNA Marker、2×Taq Master Mix购自南京诺唯赞生物科技有限公司;新生牛血清购自AusgeneX公司;革兰染色试剂盒购自北京索莱宝生物科技有限公司;细菌药敏纸片和细菌微量生化反应管均购自青岛海博试剂有限公司;细菌基因组DNA提取试剂盒购自北京天根生化科技有限公司。
1.1.3主要仪器设备 酶标仪Victor NIVO 3S(南京莱医特电子科技有限公司);DNA纯度和质量检测分光光度计(Beckman公司);紫外分光光度计(美国Thermo公司);多功能显微镜(日本OLYMPUS公司);图像采集系统(日本OLYMPUS公司);恒温培养箱(上海新苗医疗器械制造有限公司)。
1.2 方法
1.2.1病猪口鼻拭子及组织病料的收集与处理 对收集到的有呼吸道症状猪只的口鼻拭子和组织病料样品进行记录,记录后对样品进行处理。口鼻拭子的处理:将拭子放入装有适量生理盐水的EP管中充分混匀。病料的处理:首先用酒精棉轻轻擦拭病变较为明显的病料表面,并用点燃的酒精棉来回经过至表面干燥,用消毒后器械将病料剪成“口”字型,用未接触环境的内侧面轻轻涂布平板。
1.2.2病原菌分离培养及革兰染色 将处理后的口鼻拭子及无菌剪取的肺脏等病变组织,划线接种于含10%新生牛血清的TSA平板上,置于37℃恒温培养箱培养18~24 h,挑取疑似菌落并进行传代培养,取纯培养物进行革兰染色、镜检。
1.2.3生化试验 参考常见细菌系统鉴定手册[7],无菌挑取纯培养物于葡萄糖、乳糖、蔗糖、果糖、海藻糖、山梨醇等12种生化反应管中,37℃培养24~48 h,观察并记录结果。
1.2.4细菌基因组DNA的提取 细菌基因组DNA的制备根据天根生物公司的细菌基因组DNA提取试剂盒说明书步骤进行操作。
1.2.516S rDNA的PCR鉴定及测序比对 以步骤1.2.4制备的细菌基因组DNA作为模板进行细菌16S rDNA的PCR检测,用通用引物扩增16S rDNA全长序列,上游引物序列:5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物序列:5′-GGTTACCTTGTTACGACTT-3′,预计扩增片段长度1 500 bp 左右。PCR扩增体系:PrimerSTAR Max Premix(2×) 10 μL,H2O 7 μL,上、下游引物各1 μL,模板1 μL,总计20 μL。扩增程序:95℃预变性5 min; 95℃变性30 s,55℃退火30 s,72℃延伸1.5 min,共30个循环;72℃最后延伸10 min。用含有EB染料的1.1%琼脂糖凝胶电泳分析PCR扩增产物,将鉴定正确的PCR产物送往武汉擎科生物公司进行测序,并将测序结果与GenBank中已有序列进行BLAST比对。
1.2.6荚膜血清型分型 荚膜血清型分型鉴定所用引物参考文献[8],引物序列见表1。PCR反应体系:PrimerSTAR Max Premix(2×)10 μL,H2O 7 μL,上、下游引物各1 μL,模板1 μL,总计20 μL。反应程序:95℃预变性5 min;95℃变性1 min,58℃退火30 s,72℃延伸1 min,共30个循环;72℃延伸10 min。用含有EB染料的1.1%琼脂糖凝胶电泳分析PCR扩增产物。

表1 荚膜血清型分型鉴定引物及相关信息
1.2.7生长曲线的测定 将本次分离菌株与实验室前期分离并保存的PmA、PmD菌株于含10%新生牛血清的TSA平板上划线复苏,37℃过夜培养,挑取单菌落传代一次,再挑取单菌落到含10%新生牛血清的TSB中,恒温摇床振荡培养12 h作为种子液。将上述种子液按1∶100转接种于含10%新生牛血清的TSB中,37℃、180 r/min振荡培养12 h,期间每隔1 h取样测D600 nm值,根据测定结果绘制生长曲线。
1.2.8药敏试验 采用Kirby-Bauer法对20种药品进行药敏试验。将分离菌株于含10%新生牛血清的TSA平板上划线复苏,37℃过夜培养,挑取单个菌落接种于含10%新生牛血清的TSB中,于37℃振荡(180 r/min)培养12 h,用生理盐水调整菌液浓度至0.5麦氏单位(1.5×108CFU/mL)。用灭菌棉签蘸取适量菌液均匀涂布于含10%新生牛血清的TSA平板上,待培养基表面充分吸收菌液后放置药敏纸片,并使其紧贴培养基表面,于37℃恒温培养箱培养18~24 h,测量抑菌圈直径,记录测量结果,并根据杭州微生物试剂有限公司药敏结果判定标准评价菌株对药物的敏感性。
1.2.9小鼠致病性试验 将分离菌株与实验室前期分离并保存的PmA、PmD菌株分别接种于含10%新生牛血清的TSB中,于37℃振荡培养12 h并进行细菌计数。将小鼠分为9组(其中感染组8组、对照组1组),每组5只小鼠。用生理盐水将菌液稀释至攻毒浓度(PmA型菌株攻毒浓度为40 CFU/只,PmD型菌株攻毒浓度为2×105CFU/只),感染组小鼠腹腔注射0.2 mL稀释菌液,对照组小鼠腹腔注射0.2 mL无菌生理盐水,同时对实际攻毒菌液进行细菌计数。各组小鼠攻毒后隔离饲养,观察并记录临床症状、死亡情况等,同时剖检死亡小鼠并做细菌分离鉴定。
2 结果
2.1 病原菌分离培养及染色镜检将病料在TSA平板上接种培养,挑取单菌落纯化后,从广西及内蒙古病猪肺脏中分离到6株疑似Pm菌株。分离菌株在TSA平板上生长良好,37℃过夜培养后,可见培养基上长出圆润、灰白色、透明或半透明的菌落,且PmA型菌株比PmD型菌株菌落表面更为黏腻,革兰染色镜检均可见短杆状或球杆状的革兰阴性菌(图1)。
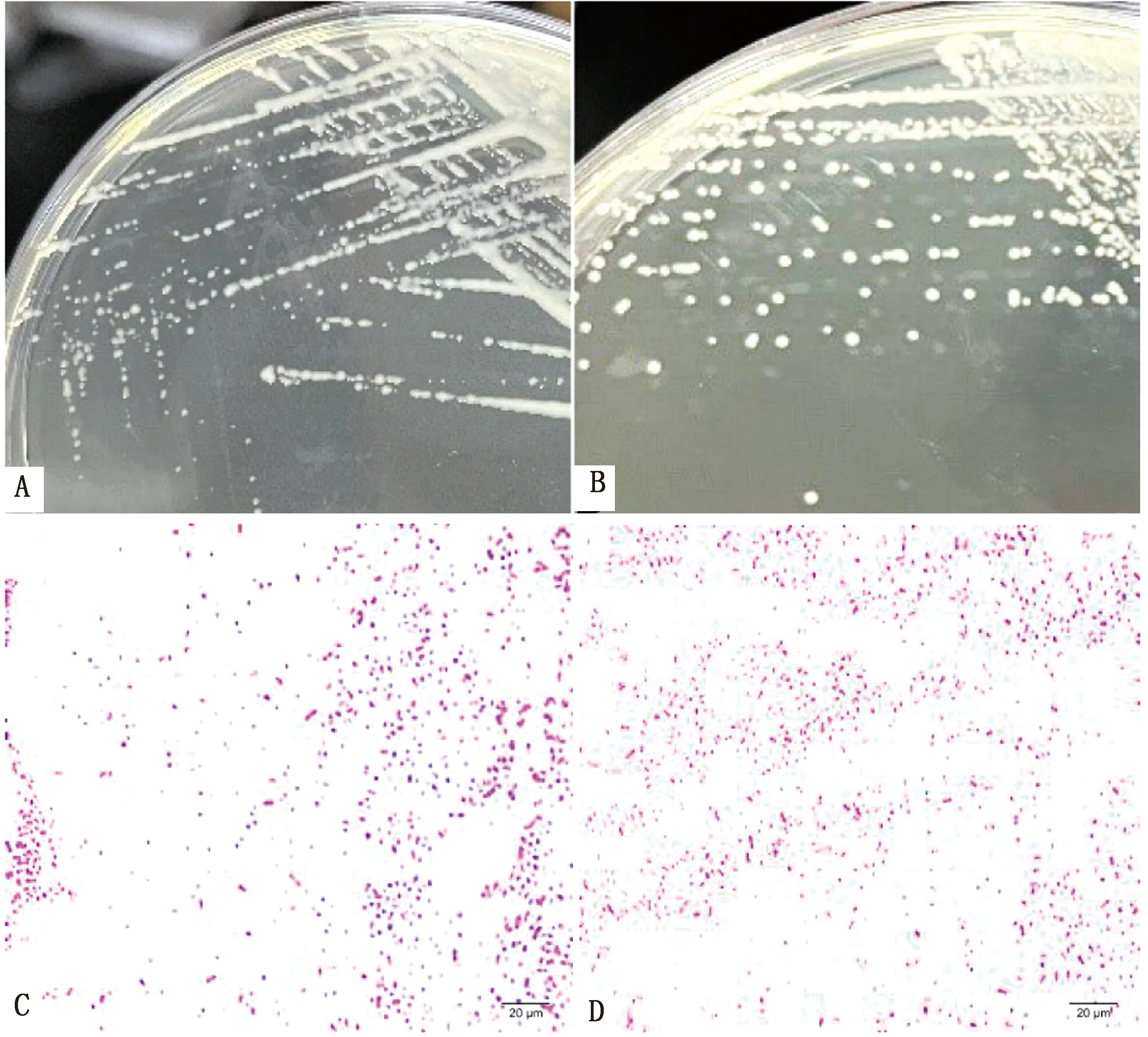
A,C.Pm血清A型菌株的菌落形态;B,D.Pm血清D型菌株的菌落形态
2.2 生化特性鉴定将分离的临床菌株进行生化试验,结果显示6株分离菌株的生化结果一致,能发酵多种单糖、双糖及醇类,但不发酵乳糖,海藻糖,枸橼酸盐、尿素酶、甲基红,V-P试验结果为阴性,吲哚试验结果为阳性,将鉴定结果与《伯杰细菌鉴定手册》比对分析,符合Pm的生化特性(表2)。

表2 分离菌株的生化鉴定结果
2.3 16S rRNA基因序列分析及比对用通用引物对6株临床分离菌株进行PCR扩增,结果显示,在1 500 bp处有特异性条带,与预期相符(图2)。将扩增产物送至武汉擎科生物公司进行测序,并将测序结果在NCBI上进行比对分析,结果显示6株分离菌株与Pm的相似性均在97%以上。

M1.DL2000 DNA Marker;1~6.分离菌株;7.阴性对照
2.4 血清型分型鉴定用5对分型引物对6株临床分离菌株进行PCR扩增,结果显示,6株Pm中有1株为荚膜血清A型(条带大小为1 044 bp),其他5株为荚膜血清D型(条带大小为657 bp)(图3)。
2.5 生长曲线测定结果将临床分离菌株与实验室前期分离并保存的PmA、PmD型菌株分别进行生长曲线测定,结果显示,Pm血清A型、Pm血清D型菌株均在7 h左右时达到对数生长期,10 h左右达到平台期,虽然不同菌株间生长曲线的走势不完全相同,但均显示出基本一致的生长状态(图4,5)。
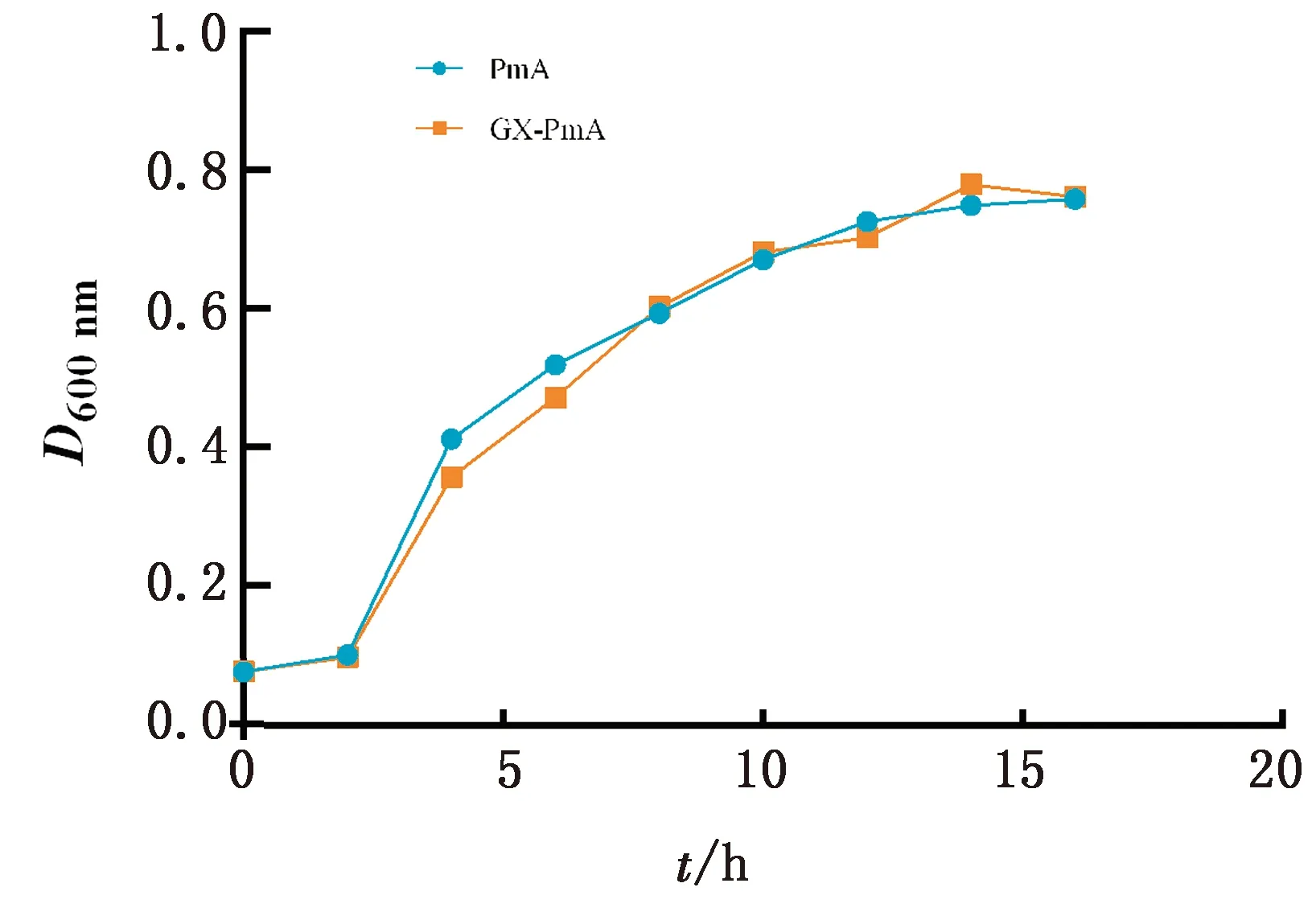
图4 Pm血清A型菌株生长曲线
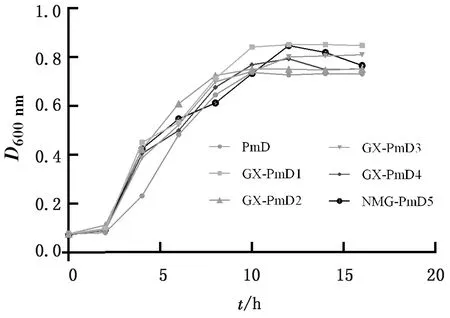
图5 Pm血清D型菌株生长曲线
2.6 耐药性分析药敏试验结果显示,6株临床分离菌株对米诺环素、多西环素、四环素、卡那霉素、头孢哌酮、头孢曲松、头孢他啶、头孢呋辛、头孢拉定、头孢唑啉、头孢氨苄、哌拉西林、羧苄西林、氨苄西林、苯唑西林、青霉素等药物均表现为敏感,且对β内酰胺类药物表现出高度敏感;其中GX-PmA对新霉素、丁胺卡那中度敏感。NMG-PmD5对红霉素中度敏感,对新霉素和庆大霉素耐药。
2.7 致病性试验致病性试验结果显示,在感染后5 h,部分小鼠开始出现运动减少、食欲减退的现象;在感染后10 h,可见小鼠精神萎靡、双眼蒙蔽、背毛杂乱,对外界刺激反应迟缓。GX-PmD4组小鼠攻毒后死亡时间最短,于10 h出现死亡,PmA组、GX-PmA组小鼠攻毒后20 h出现死亡,其余小鼠死亡时间多发生于20~24 h,而PmD组、GX-PmD2组小鼠未出现死亡,对照组小鼠均未出现死亡(表3)。结果证实Pm血清A型菌株小鼠致病性强于Pm血清D型菌株,且PmA及GX-PmD4菌株对小鼠的致病性强于其他分离菌株。
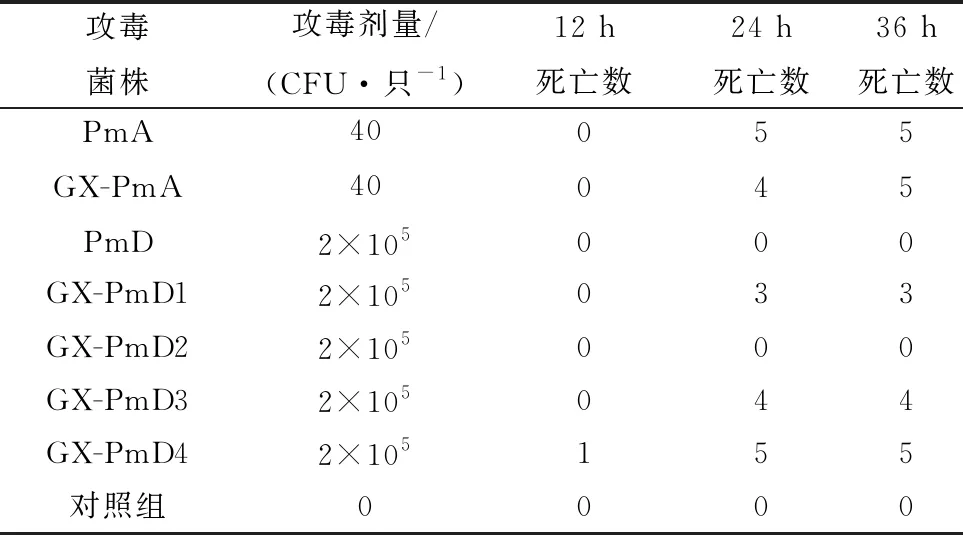
表3 分离菌株对昆明小鼠的致病性结果(n=5) 只
剖检小鼠可见,对照组未见明显病变,感染组小鼠脏器可见其不同程度的出血,其中肺脏出血较为明显,脾脏充血肿大,部分小鼠肝脏出现淤血或局部有坏死点(图6)。收集死亡小鼠肺脏进行细菌分菌鉴定,结果显示平板上菌株的菌落形态与Pm一致,经PCR鉴定证实小鼠肺脏分离菌为Pm(图7)。
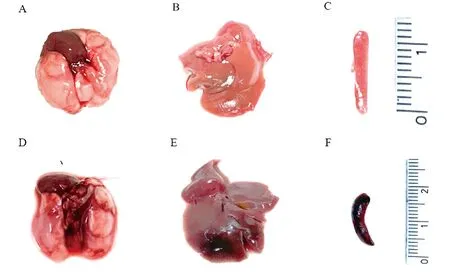
A,B,C.分别为对照组小鼠肺脏、肝脏、脾脏;D,E,F.分别为攻毒组小鼠肺脏、肝脏、脾脏
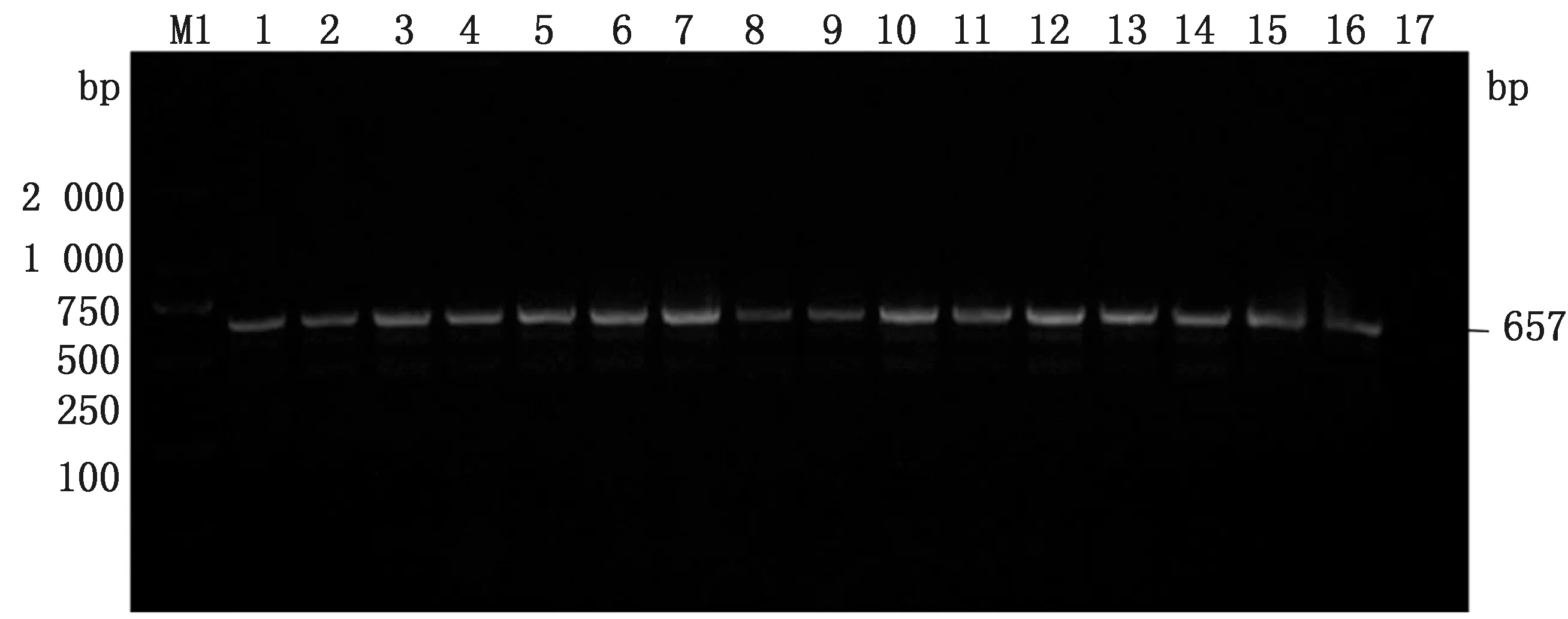
M1.DL2000 DNA Marker;1~16.分离菌株;17.阴性对照
3 讨论
猪Pm是危害我国生猪业健康发展的重要呼吸道病原菌,临床上常与多种细菌、病毒及支原体混合感染,在冬春季节环境多变、猪群抵抗力低下时,常造成内源性感染,影响猪群正常生长发育、降低饲料转化率、增加养殖费用,还可引发急性死亡,造成严重的经济损失[9]。本研究通过大量收集临床病料并通过细菌分离培养、染色镜检以及生化鉴定、PCR检测等方法成功分离出6株猪Pm,其中荚膜血清A型1株,D型5株,这与我国目前流行的优势血清型一致[10]。近年来,常有在猪群中分离到荚膜血清F型Pm的报道,且被证实有较强的致病力,因此Pm F型菌株也可能成为未来我国猪群中流行的重要血清型之一,这可能是未来猪Pm流行病学调查的重点[11-13]。
随着集约化养殖模式的发展,猪呼吸道疾病的发病率激增,抗生素滥用现象导致细菌的多重耐药现象屡见不鲜。我国学者对2017年我国临床分离菌株的耐药情况分析显示,Pm对青霉素、磺胺类、氨基糖苷类药物的耐药率相对较高。本研究显示广西临床分离菌株未见耐药现象,这可能与分离菌株来自于不同的区域及养殖场日常用药情况相关,但内蒙古分离株表现出明显的新霉素、庆大霉素耐药现象,这与近年来的文献报道较为一致[14]。有研究证实,针对目前流行的Pm,β-内酰胺类药物(青霉素、氨苄西林和头孢噻呋)、大环内酯类药物(替米考星)和氟喹诺酮类药物(恩诺沙星)比推荐使用的土霉素和氟苯尼考更为有效[15]。因此,预防为主、防治结合的科学思维必不可少,在日常养殖中,应结合养殖场实际情况制定科学合理的防控措施,做好饲养管理工作,密切关注猪群生长状况,定期对猪舍及相关用具进行消毒,同时做好圈舍通风工作,及时掌握猪群耐药情况并结合临床报道的有效抗菌剂进行治疗具有重要意义[16-17]。因此,一旦猪只发病,应结合医嘱实施药物治疗,并持续监测呼吸道病原体的耐药性,以减少该病带来的经济损失。
本研究通过对分离菌株及实验室保存的菌株进行毒力分析比较,证实Pm血清A型菌株对小鼠的致病力强于D型菌株,这与相关文献报道结果一致[18],同时从分离菌株中筛选出了致病力较强的分离菌株PmA和GX-PmD4,为实验室后期灭活苗的制备及新型疫苗的研究奠定了基础。随着基因组学的不断发展,Pm强弱毒株之间的差异逐渐被挖掘出来。研究证实,尽管强弱菌株间的基因组高度相似,但其在临床症状、病理变化、组织细菌载量、共有毒力基因的体内转录水平等方面仍存在较大差异[19-22]。因此,强毒株的筛选对后期的致病性机制研究、筛选差异毒力基因、疫苗的研发等工作奠定了基础。

