益生菌固态发酵料对羔羊断奶前、后血液免疫、抗氧化指标及粪便消化酶的影响
郭云霞,丁亚伟,徐艳辉,王海玉,李 月,郝庆红,3*,郄艳菊,段春辉,刘月琴
(1.河北农业大学 生命科学学院,河北 保定 071001;2.河北农业大学 动物科技学院,河北 保定 071001;3.河北省饲用微生物技术创新中心,河北 保定 071001;4.河北省功能性饲料添加剂技术创新中心,河北 石家庄 050000)
断奶是羔羊生长发育的关键阶段。断奶期羔羊饲料结构的转变及转群造成的应激等,均会影响羔羊的消化吸收能力,降低机体免疫和抗氧化机能等,极易引发以腹泻为主要特征的消化道疾病,使其生长受阻甚至死亡,其严重制约着养羊业的发展。在应激状态下,羔羊肠道屏障受损,非特异免疫和特异性免疫激活,IL-1β和TNF-a分泌会显著上升,炎症因子可使肠道黏膜发生变化,进而表现相关基因转录水平降低[1-2],同时应激促使机体产生的氧自由基,会大大增加机体的应激损伤,产生氧化应激反应。断奶应激是导致断奶羔羊腹泻的主要致病因素,提高机体免疫力和抗应激能力是缓解羔羊断奶应激的有效措施。
随着人们对微生物发酵饲料质量的认可及生物技术的迅速发展,发酵饲料在养殖上的应用效果越来越受到人们的重视,也成为饲料行业研究的重要方向。生物发酵饲料可产生多种活性益生菌菌体、蛋白质降解产物及活性小肽等[3],这些小分子活性多肽可缓解大肠杆菌K88(E.coliK88)感染所致的肠道上皮细胞炎症反应和肠道通透性改变[4],且乳酸菌又可诱导产生Th2细胞因子,白细胞介素-4(IL-4)和白细胞介素-10(IL-10),促使B细胞发育和产生抗体(IgG1、IgE),这些细胞因子在免疫应答诱导和调节中起关键作用[5]。发酵饲料可减轻肠道黏膜损伤,缓解幼畜腹泻发生[6]。啤酒酵母发酵产物可显著促进肉牛胃肠道消化率,同时提高肠道免疫应答,增强免疫力[7]。在羔羊早期阶段添加酵母发酵产物可显著促进羔羊瘤胃微生物定殖和纤溶潜能,提高羔羊肠道发育和消化率,促进羔羊生长发育[8]。微生物发酵饲料研究多集中于单胃动物,对反刍动物尤其是断奶前、后羔羊的影响鲜有报道。本试验以断奶前、后羔羊为研究对象,通过断奶前、后补饲发酵饲料,以血液免疫指标、抗氧化指标、生长激素及粪便中酶活为研究目标,以期为发酵饲料在增强机体免疫力和缓解断奶应激方面提供理论依据。
1 材料与方法
1.1 试验材料复合益生菌剂:乳酸杆菌RSG-1(≥1.0×108CFU/mL);枯草芽孢杆菌B-1(≥1.0×108CFU/mL);地衣芽孢杆菌Y5-39(≥1.0×108CFU/mL),所有菌株由河北农业大学生命科学学院生物医药系分离并保存。玉米、豆粕和麸皮发酵底物购自某饲料公司。45日龄体质量相近哺乳羔羊由衡水志豪畜牧科技有限公司提供。
1.2 益生菌发酵饲料发酵底物由玉米、豆粕和麸皮按60%∶25%∶15%比例配合,乳酸杆菌RSG-1∶枯草芽孢杆菌B-1∶地衣芽孢杆菌Y5-39=1∶1∶4,接菌量10%,含水量45%,室温(25~30℃)发酵14 d。发酵饲料营养成分为干物质51.40%,粗蛋白19.62%,代谢能12.00%,中性洗涤纤维21.15%,酸性洗涤纤维9.42%,钙0.76%,磷0.53%。
1.3 羔羊饲养管理及试验设计选择45日龄、体质量(12.43±0.22)kg、健康的湖羊哺乳羔羊48只(雌、雄各1/2),60日龄断奶,按照体质量和性别随机分为4组,每组12只。试验设计见表1。预饲期5 d,断奶前10 d~断奶后4 d连续饲喂发酵饲料。羔羊断奶前随母哺乳并补饲颗粒料,断奶后转入羔羊圈,饲料不变。羔羊圈提前进行清扫和消毒,试验期间羔羊自由采食和饮水,每日07:00和17:00 2次饲喂。参照NRC(2007)版营养需要标准,配制不同的基础颗粒料,使发酵料组营养水平和对照组营养水平一致,各组饲料配方及营养水平见表2。

表1 各组试验设计
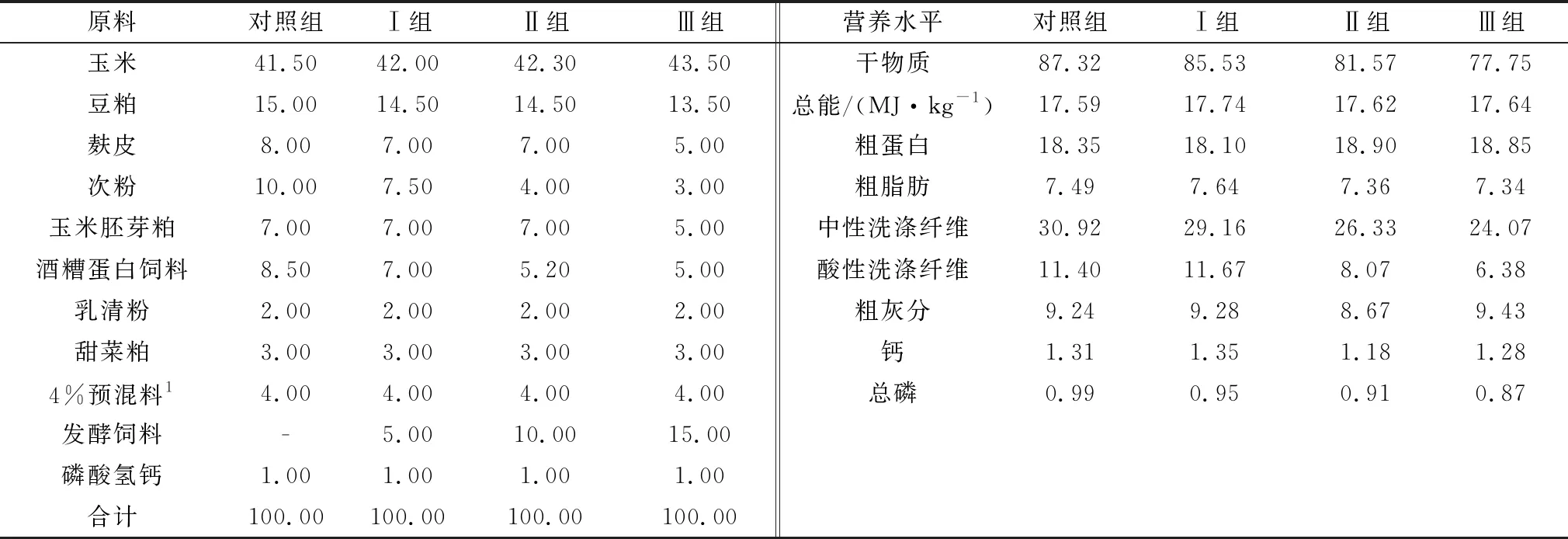
表2 羔羊颗粒组成及营养水平(干物质基础) %
1.4 试验样品采集及方法
1.4.1样品采集 分别于断奶前1 d(断奶第0天)和断奶后4 d,空腹采集血样2份,每份5 mL,其中1份血样于EDTA抗凝管中,备测血常规;另1份于促凝管中,8 000 r/min离心10 min,收集上层血清,-20℃保存,备测免疫和抗氧化及生长激素等指标。直肠采粪法采集羔羊粪便,备测消化酶活性。
1.4.2测定方法 采用PE-6800全自动血细胞分析仪测定白细胞总数(WBC)、嗜酸粒细胞(NEU)、淋巴细胞(LYM)。
采用江苏酶免实业有限公司试剂盒按照说明书分别测定白细胞介素1β(IL-1β,检测范围3~140 ng/L)、白细胞介素-6(IL-6,检测范围 6~180 ng/L)、肿瘤坏死因子-α(TNF-α,检测范围25~1 000 ng/L);免疫球蛋白M(IgM,检测范围0.2~18.0 m g/L)、免疫球蛋白G(IgG,检测范围50~1 500 mg/L)、免疫球蛋白A(IgA,检测范围0.8~30.0 mg/L);生长激素(GH,检测范围0.2~8.0 μg/L)、胰岛素(insulin,检测范围5~80 mIU/L)和胰岛素样生长因子(IGF-1,检测范围15~400 μg/L)。
采用江苏酶免实业有限公司试剂盒按照说明书分别测定谷胱甘肽过氧化物酶(GSH-Px,ADS-W-G003)、超氧化物歧化酶活性(SOD,ADS-F-YH001-96)、丙二醛含量(MDA,ADS-F-YH002-96)含量、血清总抗氧化能力(T-AOC,ADS-W-YHKY004-96)。
采用睿信生物科技有限公司试剂盒按照说明书分别检测粪便消化酶(淀粉酶、胰蛋白酶、纤维素酶、脂肪酶)的活性。
1.5 数据统计与分析试验数据采用Excel 2021软件对数据进行整理,采用SPSS 22.0进行单因素方差分析(One-way ANOVA),各处理组均值采用Duncan氏多重比较,各处理组与断奶日龄中交互作用分析采用一般线性模型中多因素方差分析,以P<0.01表示差异极显著,P<0.05表示为差异显著,P>0.05为差异不显著。
2 结果
2.1 益生菌发酵料对羔羊断奶前、后血液免疫指标的影响由表3可知,与对照组相比,饲喂发酵饲料后WBC数量在断奶前试验Ⅰ和Ⅲ组极显著提高(P<0.01),Ⅱ组极显著下降(P<0.01)。试验Ⅱ组极显著低于其他各组(P<0.01),而试验Ⅰ与Ⅲ组相比呈显著增加(P<0.05);断奶后对照组与发酵料各组间差异不显著(P>0.05)。随着发酵饲料的饲喂,对照组和试验Ⅱ组WBC呈增加趋势,试验Ⅰ和Ⅲ组略有下降且差异不显著(P>0.05),试验处理与日龄的交互作用差异不显著(P>0.05)。LYM结果显示,断奶前、后发酵饲料各组与对照组差异均不显著(P>0.05)。NEU结果发现,饲喂发酵料组可使断奶前试验Ⅱ组与其他各组相比呈极显著下降(P<0.01),其他各组间差异不显著(P>0.05);断奶后试验Ⅰ组显著高于其他处理组(P<0.05),其他各组间差异不显著(P>0.05);交互作用统计分析发现试验处理与日龄的交互作用差异不显著(P>0.05)。
与对照组相比,饲喂发酵料组对断奶前血清IL-1β含量差异不显著(P>0.05),断奶后Ⅲ组极显著低于其他各组(P<0.01),其他各组间差异不显著(P>0.05);结果显示断奶后羔羊血清IL-1β极显著高于断奶前(P<0.01),试验处理与日龄的交互作用差异极显著(P<0.01)。饲喂发酵料试验Ⅲ组对断奶前血清IL-6呈显著高于其他各组(P<0.05),其他各组间差异不显著(P>0.05);断奶后各组IL-6含量均高于断奶前,其中试验Ⅱ组显著低于对照组(P<0.05),其他各组间差异不显著(P>0.05)。与对照组相比,TNF-α断奶前饲喂发酵料试验Ⅰ和Ⅱ组极显著降低(P<0.01),而试验Ⅲ组差异不显著(P>0.05);断奶后试验Ⅰ组显著下降(P<0.05),而试验Ⅰ和Ⅱ组极显著低于Ⅲ组(P<0.01);试验处理与日龄的交互作用差异不显著(P>0.05)。
与对照组相比,IgG断奶前试验Ⅰ和Ⅱ组极显著增加(P<0.01),试验Ⅲ组提高但差异不显著(P>0.05);断奶后试验Ⅰ和Ⅱ组显著高于对照组(P<0.05),试验Ⅲ组与对照组相比差异不显著(P>0.05);随着断奶日龄的增加,各处理组IgG含量均呈极显著下降(P<0.01),但试验处理和日龄交互作用分析差异不显著(P>0.05)。IgA断奶前、后各处理组差异均不显著(P>0.05)。IgM含量断奶前试验Ⅱ组极显著高于对照组(P<0.01),试验Ⅱ组显著高于试验Ⅰ和Ⅲ组(P<0.05);断奶后试验Ⅲ组极显著高于其他各组(P<0.01),其他各处理组间差异均不显著(P>0.05);断奶后IgM均极显著高于断奶前(P<0.01),但试验处理与日龄交互作用差异不显著(P>0.05)。
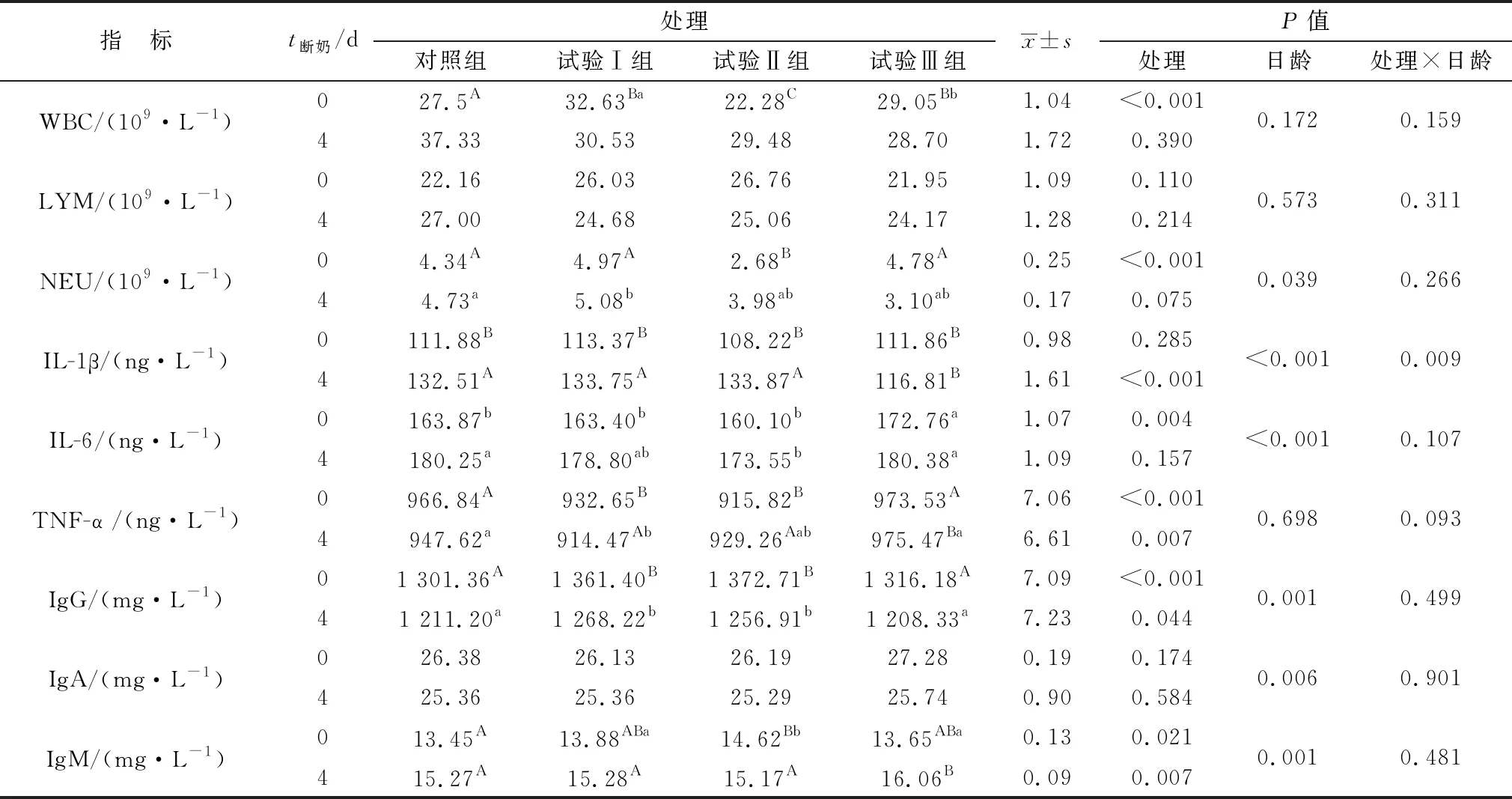
表3 益生菌发酵料对羔羊断奶前、后血液免疫指标的影响
2.2 益生菌发酵料对羔羊断奶前、后血液抗氧化指标的影响由表4可知,与对照组相比,断奶前饲喂发酵饲料试验Ⅰ和Ⅱ组可显著降低MDA含量(P<0.01),而Ⅲ组差异不显著(P>0.05);断奶后试验Ⅱ组显著低于其他各组(P<0.05),而其他各组间差异不显著(P>0.05);断奶前与断奶后MDA含量呈极显著下降(P<0.01),但试验处理与日龄交互作用差异不显著(P>0.05)。SOD含量断奶前试验Ⅰ和Ⅲ组极显著高于对照组和试验Ⅱ组(P<0.01),断奶后发酵饲料各组均极显著高于对照组(P<0.01);断奶后SOD含量极显著低于断奶前(P<0.01),但试验处理与日龄交互作用差异不显著(P>0.05)。GSH-Px含量在断奶前Ⅱ组显著高于对照组和其他处理组(P<0.05),其他各组间差异不显著(P>0.05);断奶后Ⅲ组极显著高于对照组和试验Ⅰ组(P<0.01),显著高于Ⅱ组(P<0.05);断奶后与断奶前相比呈极显著增加(P<0.01),但试验处理与日龄交互作用差异不显著(P>0.05)。T-AOC含量断奶前发酵饲料组均极显著高于对照组(P<0.01),其中试验Ⅲ组极显著高于Ⅰ和Ⅱ组(P<0.01);断奶后试验Ⅰ和Ⅲ组显著高于对照组Ⅱ组(P<0.05),断奶后与断奶前相比呈极显著增加(P<0.01),但试验处理与日龄交互作用差异不显著(P>0.05)。
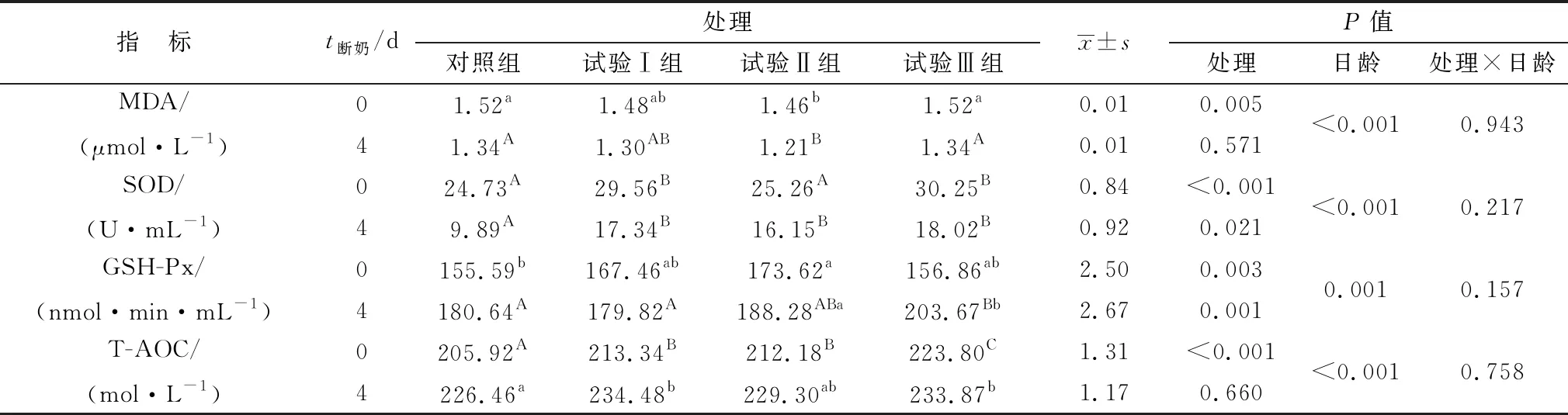
表4 益生菌发酵料对羔羊断奶前、后血液抗氧化指标的影响
2.3 益生菌发酵料对羔羊断奶前、后血液GH、INS和IGF-1的影响由表5可知,断奶前饲喂发酵料试验Ⅰ和Ⅲ组血清GH含量显著高于对照组和试验Ⅱ组(P<0.05);断奶后GH在各处理间差异不显著(P>0.05);试验处理与日龄交互作用差异不显著(P>0.05)。INS含量断奶期饲喂发酵料各组均极显著高于对照组(P<0.01),其中Ⅲ组极显著高于试验Ⅰ和Ⅱ组(P<0.01);断奶后饲喂发酵料血清INS在各组呈下降趋势,其中试验Ⅰ组极显著低于对照组(P<0.01),其他各组差异不显著(P>0.05);试验处理和日龄交互作用差异不显著(P>0.05)。IGF-1含量断奶前试验Ⅱ和Ⅲ组极显著高于对照组和试验Ⅰ组(P<0.01),断奶后各试验组间差异不显著(P>0.05);断奶后各组极显著高于断奶前(P<0.01),试验处理与日龄差异不显著(P>0.05)。

表5 益生菌发酵料对羔羊断奶前、后血液GH、INS和IGF-1含量的影响
2.4 益生菌发酵料对羔羊断奶前、后粪便消化酶含量的影响由表6可知,断奶前和断奶后各发酵料组CL含量极显著高于对照组(P<0.01),饲喂发酵料断奶前各组间差异不显著(P>0.05),断奶后试验Ⅲ组显著高于Ⅱ组(P<0.05);与断奶前相比,断奶后试验Ⅰ和Ⅲ组CL均极显著增加(P<0.01),试验处理和日龄交互作用差异不显著(P>0.05)。α-AL含量断奶前试验Ⅰ和Ⅱ组显著高于对照组(P<0.05),试验Ⅲ组极显著高于对照组(P<0.01),试验Ⅰ组显著高于Ⅱ组(P<0.05);断奶后试验Ⅱ组显著高于对照组(P<0.05),试验Ⅲ组极显著高于对照组(P<0.01);与断奶前相比,断奶后极显著增加(P<0.01),试验处理和日龄交互作用具有显著性差异(P<0.01)。LPS含量断奶前各试验组极显著高于对照组(P<0.01),其中试验Ⅱ组显著高于试验Ⅲ组(P<0.05);断奶后试验Ⅱ和Ⅲ组极显著高于对照组和试验Ⅰ组(P<0.01);断奶后LPS极显著高于断奶前(P<0.01),试验处理与断奶日龄呈显著性相关(P<0.05)。断奶前、后饲喂发酵料各组Try含量均极显著高于对照组(P<0.01),其中断奶前试验Ⅱ组极显著高于试验Ⅰ和Ⅲ组(P<0.01),断奶后试验Ⅱ和Ⅲ组极显著高于对照组和试验Ⅰ组(P<0.01)。断奶后Try极显著高于断奶前(P<0.01),试验处理与断奶日龄呈极显著性相关(P<0.01)。

表6 益生菌发酵料对羔羊断奶前、后粪便消化酶的影响
3 讨论
3.1 益生菌发酵料对羔羊断奶前、后血清生理及免疫指标的影响本试验结果显示,在断奶前饲喂10%发酵饲料WBC添加组极显著低于对照组,5%和15%组极显著高于对照组,而断奶后对照组与发酵饲料各组间差异不显著。NEU在断奶前10%添加组极显著低于其他各组,断奶后差异不显著。各指标统计分析发现试验处理与日龄的交互作用差异不显著。WBC是反映动物机体的炎症指标,受年龄、品种、日粮、环境等多种外界因素的影响[9]。王娟娟等[10]和黄杏秀等[11]报道,10%发酵饲料组可增加断奶仔猪血液中白细胞数量和淋巴细胞转化率,这与本试验羔羊断奶前饲喂发酵料5%和15%组WBC升高结果一致,但淋巴细胞数量差异不显著,这可能与发酵饲料中的乳酸菌、芽孢杆菌及其代谢产物可增加血液中白细胞数量有关[12]。断奶后对照组和10%添加组WBC具有升高趋势,而5%和15%组有下降趋势但差异不显著,可能是由于断奶应激引发血清中WBC的变化,断奶前、后腹泻羔羊血清中白细胞显著高于健康羔羊[13-14]。本试验中10%添加组断奶前WBC极显著的低于其他各组,这可能与10%添加组腹泻率最低有关。
细胞因子为一类在细胞间传递信息的蛋白质或小分子多肽,在免疫应答调节和效应中起重要作用[15],辅助性T细胞1型(Th1)细胞因子(IL-1β、IL-2、TNF-α)可激活细胞介导的免疫反应,而Th2细胞因子(IL-4、IL-6和IL-10)可促进B细胞分化增殖,并驱动体液免疫反应[16]。利用复合菌培养物和β-葡聚糖证实可显著提高肉羊血清中白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6/-8(IL-6/-8)的含量[17]。添加发酵全价料,可显著增加产蛋鸡血清中IL-1β、IL-6和TNF-a的含量[18]。也有报道,饲喂发酵豆粕,不仅显著提高断奶犊牛的生长性能,还显著降低断奶1 d的犊牛促炎细胞因子、肿瘤坏死因子(TNF-a)、白介素-1β(IL-1β)和白介素-6(IL-6)的含量,在断奶第3 天TNF-a和 IL-6含量显著降低,表明发酵豆粕可显著缓解断奶应激[19]。试验结果显示,IL-1β断奶后15%发酵料组极显著低于其他各组;IL-6断奶前15%添加组显著高于对照组和其他发酵料组,断奶后发酵饲料各组均显著高于断奶前,且10%添加组显著低于对照组和其他发酵料组;TNF-α断奶前5%和10%添加组极显著低于对照组和15%添加组,断奶后5%和10%添加组显著低于对照组和其他各组。结果表明,细胞因子的分泌可能是由于发酵饲料中乳酸杆菌细胞壁中的肽聚糖、磷脂酸等的免疫活性相关[20]。
另外,血清免疫球蛋白浓度可作为动物体液免疫的关键指标,其在保护宿主免受致病菌或病毒方面起关键作用[21],主要包括IgG、IgM和IgA3种免疫球蛋白种类[22]。据报道,微生物发酵饲料可显著提高肉羊、肉牛、猪等血清中IgA、IgG和IgM水平[23-25],与本研究结果一致,表明饲喂一定的发酵饲料在一定程度上提高断奶前、后羔羊的免疫力。
3.2 益生菌发酵料对羔羊断奶前、后血清抗氧化指标的影响总抗氧化能力可充分反映酶和非酶防御系统的抗氧化能力,抗氧化酶包括SOD和GSH-Px,氧自由基及过氧化氢清除来应对氧化应激损伤,脂质过氧化过程中产生的MDA可以进入细胞,结合入蛋白形成羰基衍生物,发挥细胞毒性作用[26],因此,MDA的浓度可作为判定脂质过氧化的指标。发酵饲料中微生物代谢会产生多种抗氧化复合物,能有效清除自由基[27]。研究表明,日粮中添加发酵饲料可显著提高仔猪血液中SOD含量,增强机体清除自由基的能力,提高抗应激效果[10]。薛晨[28]证实,微生物发酵饲料可显著提高肉牛血清中SOD、GSH-Px活性和T-AOC含量,降低MDA含量,增强了抗氧化能力,减少氧化应激的损伤。本研究结果发现,断奶前、后10%添加组MDA含量均显著下降,SOD含量断奶前5%和15%组极显著增加,断奶后发酵料组均极显著高于对照组,GSH-Px活性断奶前10%添加组显著高于对照组,断奶后15%添加组极显著高于对照组,T-AOC含量断奶前发酵料组均极显著高于对照组,而断奶后5%和15%添加组显著高于对照组。综合分析,10%添加组断奶期可显著降低体内抗氧化系统破坏,缓解羔羊断奶应激,增加抗氧化能力。15%断奶后的抗氧化能力较强,推测可能是由于发酵饲料的添加量大,其中的抗氧化产物及有益微生物更多,使15%添加量在断奶后呈现较强的抗氧化能力。
3.3 益生菌发酵料对羔羊断奶前、后血清GH、INS和IGF-1含量的影响生长激素(GH)、胰岛素(INS)、胰岛素样生长因子-1(IGF-1)在动物生长发育过程中发挥着重要的作用。GH主要由垂体前叶分泌的单链蛋白质激素,通过与靶细胞表面的生长激素受体(GHR)介导,通过不同途径将信号传递到细胞内,从而发挥促进动物生长和调节代谢等多种生物学功能[29]。刘泽等[30]在肉鸭上饲喂复合益生菌发酵料可显著提高血清中GH、INS和IGF-1的含量。吴先华[31]证实在断奶仔猪上饲喂发酵豆粕,可显著提高血清中GH含量。IGF-1是机体内重要的内分泌生长因子,是GH的重要介质。GH可直接激活GHR,刺激IGF-1合成,其作用于靶细胞发挥生长激素的生理功能[32]。饲喂发酵全价料可显著增加育成猪血清中IGF-1的含量[33],增强CC-AT/增强连接蛋白β与IGF-1启动子结合,促进IGF-1蛋白在肝脏表达,达到促生长目的[34]。INS是IGF家族中第1个被发现的成员,主要调控血糖平衡。研究发现,利用地衣芽孢杆菌和酵母菌替代莫能菌素可显著提高育肥羊的生长性能,血清中GH、IGF-1和INS的含量均显著增加[35]。本研究结果显示,断奶前5%和15%添加组GH和INS显著高于对照组,断奶后GH在各组间无显著性差异;INS发酵饲料组显著低于对照组;断奶前IGF-1含量10%和15%显著低于对照组,断奶后极显著增加,但与对照组差异不显著。综合分析,断奶前发酵饲料中的消化酶活性可促进营养物质的消化吸收,进而促进羔羊生长,断奶后受断奶应激的影响,生长激素呈上升趋势,但与对照组无显著性差异,表明发酵饲料可缓解断奶应激,维持机体稳定。
3.4 益生菌发酵料对羔羊断奶前、后粪便消化酶指标的影响消化酶在机体营养物质消化吸收过程中起重要作用,主要包括胰蛋白酶(Try)、脂肪酶(LPS)、淀粉酶(AL)和纤维素酶(CL),是确保反刍动物营养物质消化吸收主要消化酶,其活性与机体对营养物质消化利用率密切相关。据报道,复合益生菌发酵以玉米、豆粕和麸皮为发酵底料,饲喂后可显著提高蛋鸡十二指肠食糜AL及空肠食糜Try和LPS活性[36]。粪便消化酶活性可在一定程度上代表肠道消化酶活性。本研究发现,CL、α-AL、LPS和Try等消化酶活性在断奶前、后发酵饲料各组均显著高于对照组,断奶前、后呈显著性差异,处理和日龄交互作用显著。消化酶活性增加,可能是由于发酵饲料中抗营养因子的降解刺激消化酶分泌。在微生物发酵饲料过程中,芽孢菌种分泌丰富的水解酶系(Try、AL和CL等),可降低饲料抗原蛋白、植酸、蛋白酶抑制因子和抗性淀粉等抗营养因子的含量[37-39],提升了饲料品质,促进了营养物质消化吸收。同时发酵过程中微生物产生的这些外源消化酶亦可作为内源酶的补充,进而增强了粪便消化酶活性。另外,复合乳酸菌可显著增加犊牛空肠和回肠胰蛋白酶活性和回肠脂肪酶活性,增强营养物质消化吸收能力[40]。发酵饲料中有益菌的数量显著增加,可以提高消化酶活性。

