高剂量白酒糟对山羊瘤胃发酵、菌群结构及炎性基因的影响
张余蓬,郭灵君,罗怡茜,张芝金,李亚均,朱 瑞,张德志,2,李前勇,2,3*
(1.西南大学 动物医学院,重庆 荣昌 402460;2.重庆市兽医科学工程研究中心,重庆 荣昌 402460;3.重庆市肉牛工程技术研究中心,重庆 荣昌 402460)
白酒糟是白酒酿造后剩余的产物,又名丢糟。资料显示,白酒糟中粗蛋白质为(16.75±1.64)%,干物质(89.40±3.18)%,粗灰分(9.91±2.04)%,粗脂肪(4.83±2.29)%,粗纤维(28.57±3.10)%,中性洗涤纤维(53.43±5.29)%,酸性洗涤纤维(45.93±3.76)%,非蛋白氮(3.68±1.41)%,淀粉(13.68±3.32)%,钙(0.46±0.17)%,总磷(1.55±0.66)%,Fe、Cu、Mn、Zn含量也较丰富[1],是一种传统的动物饲料原料。动物饲料中补饲一定比例的白酒糟可显著提高干物质的采食量、平均日增质量、营养物质的表观消化率,进而提高生长性能,显著降低料重比,可达到降低饲养成本、提高经济效益的作用[2-4]。近年来,随着豆粕、玉米等大宗饲料原料价格的不断上涨,动物生产尤其是牛羊养殖中白酒糟的使用现象越来越普遍,据报道,重庆地区肉牛饲养中酒糟的使用率达94.41%,在育肥肉牛日采食量中酒糟添喂比例在70.00%以上的牛只可占调查牛只的13.50%~14.50%,繁殖母牛采用高剂量(占日采食量的50.00%~60.00%)酒糟添喂的牛只也达9.38%~13.73%[5],高剂量酒糟饲喂现象在牛羊生产中比较常见。
然而,白酒糟中不仅富含蛋白质、粗纤维、粗脂肪、淀粉及部分矿物元素等营养物质,还含有各种醇类、醛类、酸类、霉菌毒素等有害物质,动物长期高剂量或突然大剂量饲喂,会引起牛、羊机体不适,导致瘤胃内环境紊乱,瘤胃发酵功能异常,进而影响牛、羊健康,诱发瘤胃黏膜及其下层组织的炎症、酒糟中毒等疾病[6],目前国内关于牛羊酒糟中毒的病例报道较常见[7-9],但国内外对高剂量酒糟饲喂对瘤胃发酵功能及黏膜组织损伤的影响研究鲜见报道。为此,本试验通过饲粮中添加65.00%和75.00%白酒糟,探究高剂量白酒糟对山羊瘤胃的发酵功能、菌群结构及瘤胃炎性基因的影响,旨在为白酒糟在牛、羊养殖的安全使用中提供部分理论依据。
1 材料与方法
1.1 试验设计选用重庆荣昌本地健康杂交山羊15只(购自重庆荣昌某山羊养殖基地),3月龄,体质量(14.16±1.30)kg及体况相近。试验采用单因素完全随机试验设计,随机分成3组,每组5只,对照组(LC)饲喂基础饲粮,Ⅰ组替换65%饲粮白酒糟(LM),Ⅱ组替换75%饲粮白酒糟(LH),以《肉羊饲养标准》(NY/T816-2004)为参考设计日粮中能量和蛋白水平[10],试验日粮组成和营养水平如表1所示。每只羊独立圈舍,半漏缝式地板,自由饮水,分别于每日09:00和18:00喂食。预试期14 d,正式试验期90 d。期间定期进行疫苗接种、驱虫、环境消毒等。
1.2 样本采集与测定
1.2.1瘤胃液采集 在试验第90天晨饲前利用胃导管采取参试山羊瘤胃液,丢弃含有大量唾液的部分,每只羊采集50 mL,将瘤胃液经4层无菌纱布过滤后,取5 mL瘤胃液立即测量pH,其余瘤胃液于-80℃冰箱冷冻保存,以便后续试验。

表1 试验日粮组成和营养水平 %
1.2.2瘤胃组织采集 山羊瘤胃液采集完成之后,由经验丰富的外科兽医在山羊瘤胃腹侧切除约10 g的瘤胃组织。采集的瘤胃组织经生理盐水和无水乙醇洗涤干净,液氮冷冻0.5 h后储存于-80℃冰箱中,用于RNA的提取。
1.2.3瘤胃液发酵参数测定 瘤胃液pH采用PHS-3E 酸度计测定,测定前用标准品对酸度计进行校准。瘤胃液VFA浓度由7890B-7000D GC-MS/MS气相色谱仪与质谱仪联用测定,使用氦气作为载气,流速为1.2 mL/min。在分离模式下进行注射,注射量为2 μL。烘箱温度在90℃保持1 min,加热速度为25℃/min到100℃,并且以20℃/min的速度升到150℃,保持36 s,以25℃/min的速度升至200℃,保持30 s,运行3 min后。进样器入口和传输线温度分别为200和230℃。瘤胃液组胺和LPS浓度参照羊LPS、组胺ELISA检测试剂盒(上海优选生物科技有限公司)说明书测定。
1.2.4瘤胃液16S rDNA测序 将合格的样品用细菌通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACNNGGGTATCT-AAT-3′)扩增细菌16S rDNA基因的V3~V4区。PCR反应体系(25.0 μL):12.5 μL 2×Taq Plus Master Mix、3 μL BSA(2 mg/L)、1.0 μL Forward Primer(5 μmol/L)、1.0 μL Reverse Primer(5 μmol/L)、2.0 μL DNA,最后加入5.5 μL ddH2O 补足至25.0 μL。反应参数:95℃预变性5 min;95℃变性45 s,55℃退火50 s,72℃延伸45 s,28个循环;72℃延伸10 min。PCR产物使用1%琼脂糖凝胶电泳检测扩增目的条带大小,并用Agencourt AMPure XP核酸纯化试剂盒纯化。纯化后的PCR产物用于构建微生物多样性测序文库,在北京奥维森基因科技有限公司使用Illumina Miseq PE300高通量测序平台进行Paired-end测序。
1.2.5瘤胃组织炎性基因表达量测定 各瘤胃组织RNA的提取参照RNAiso Plus(TaKaRa)说明书提取。按照TaKaRa反转录说明书步骤,将各样本RNA反转录成cDNA。在八连管中加入10 μL TB Green Premix Ex Taq Ⅱ,1 μL PCR Forward Primer,1 μL PCR Reverse Primer,2 μL cDNA模板,1 μL dd H2O,共20 μL。qRT-PCR扩增程序为95℃预变性30 s,1个循环;95℃变性5 s,65℃延伸30 s,40个循环。各基因引物如表2所示,内参基因为β-actin。

表2 基因引物序列
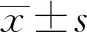
2 结果
2.1 高剂量白酒糟对山羊瘤胃发酵参数的影响如表3所示,试验90 d后,与对照组相比,65%白酒糟组和75%白酒糟组山羊瘤胃液pH显著降低(P<0.05);同时随着白酒糟饲喂量的增多,山羊瘤胃pH呈下降趋势。与对照组比较,65%白酒糟组山羊瘤胃液乙酸和丁酸含量无显著性变化(P>0.05),而75%白酒糟组山羊瘤胃液乙酸和丁酸含量显著降低(P<0.05),各组间丙酸、异丁酸、异戊酸、戊酸含量均未发生显著变化(P>0.05)。 与对照组相比,65%白酒糟组乙丙比无显著性变化,75%白酒糟组乙丙比显著下降(P<0.05),65%和75%白酒糟组总VFA含量显著降低(P<0.05)。与对照组比较,65%和75%白酒糟组瘤胃液组胺和LPS浓度极显著上升(P<0.01)。
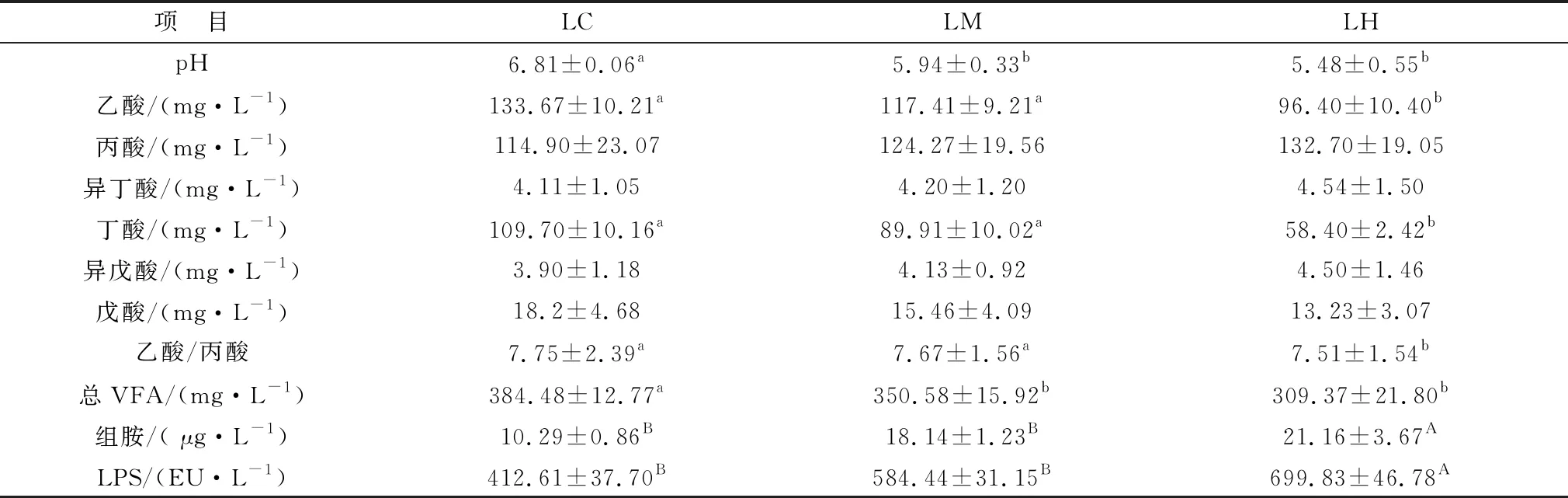
表3 高剂量白酒糟对山羊瘤胃发酵参数的影响
2.2 高剂量白酒糟对山羊瘤胃微生物群落的影响
2.2.1OTU韦恩图结果分析 如图1所示,3组共同拥有612个OTU,LC和LH组共有196个OTU,LH和LM组共有135个OTU,LC和LM组共有83个OTU,LC组独有300个OTU,LH组独有97个OTU,LM组独有83个OTU,与对照组相比,白酒糟组的OTU有所降低。
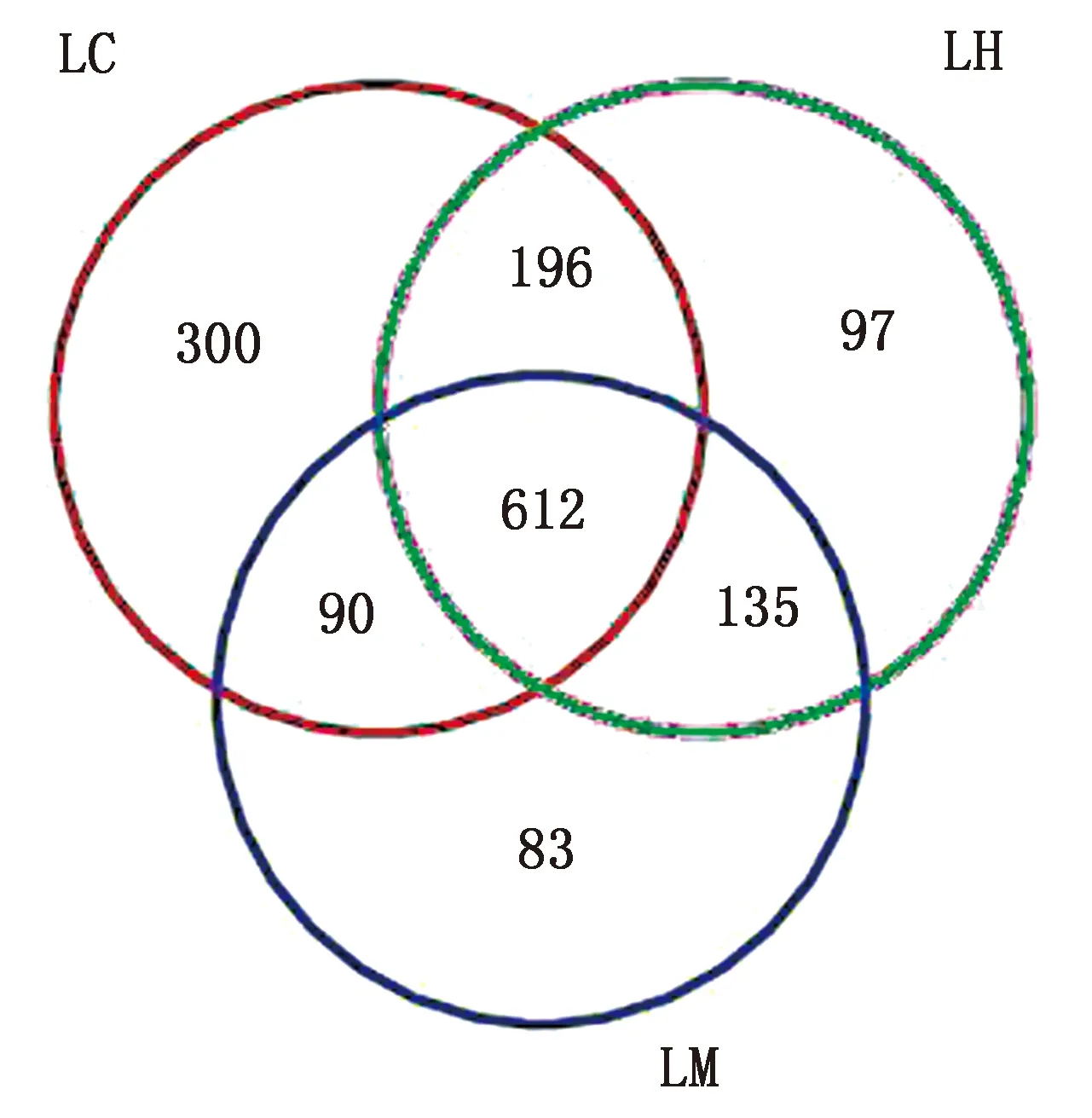
图1 OTU韦恩图
2.2.2Alpha多样性分析 如图2 A、B所示,稀释性曲线趋于平缓,表明有合理的测序数据量,而香农曲线趋于平缓,表明测序数据量大,足以反映样品中的大部分微生物信息。
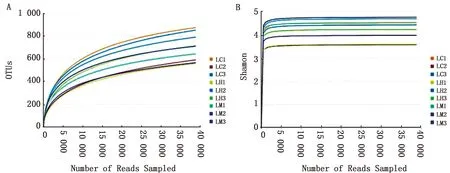
图2 稀释性曲线(A)和香农曲线(B)
表4显示了最低序列数最终样本数及其Alpha指数的并列分析,Chao1、Shannon、Simpson和Observed指数在各组之间没有显著性差异(P>0.05),且白酒糟组Alpha指数相比对照组有所下降。各组间种群数量及结构类似,但菌群丰度较大,菌群多样性处于较高水平。

表4 山羊瘤胃液Alpha多样性指数
2.2.3山羊瘤胃微生物门水平比较 本试验的优势菌门为厚壁菌门(Firmicutes)和拟杆菌门(Bac'teroidota),占瘤胃微生物门类90%以上(图3)。其中,厚壁菌门和拟杆菌门在酒糟组和对照组中无显著性差异(P>0.05),但厚壁菌门随着白酒糟饲喂量的增多呈下降趋势,拟杆菌门随着白酒糟饲喂量的增多呈上升趋势。
2.2.4山羊瘤胃微生物科水平比较 在科水平上的优势菌为普雷沃菌科(Prevotellaceae)、瘤胃菌科(Ruminococcaceae)、毛螺菌科(Lachnospiraceae)、真杆菌科(Eubacterium)(图4)。其中,普雷沃菌科、瘤胃菌科随着白酒糟饲喂量的增多呈上升趋势,而毛螺菌科呈下降趋势,但各组间的差异均不显著(P>0.05)。
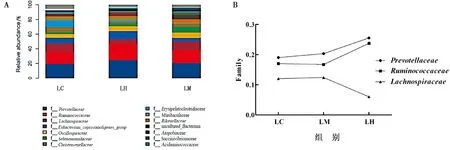
A.优势菌门;B.组间优势菌门变化

A.优势菌科;B.组间优势菌科水平变化
2.2.5山羊瘤胃微生物属水平比较 在属水平上的优势菌为普雷沃菌属(Prevotella)、瘤胃球菌属(Ruminococcus)(图5),但普雷沃菌属丰度与白酒糟饲喂量呈正比例趋势。
2.3 高剂量白酒糟对山羊瘤胃炎性基因表达的影响结果如图6所示,与对照组相比,65%和75%白酒糟组山羊瘤胃组织中p65/COX2/VCAM1 mRNA相对表达量极显著升高(P<0.01)。
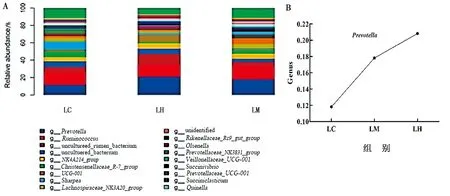
A.优势菌属;B.组间优势菌属水平变化

*.差异显著(P<0.05);**.差异极显著(P<0.01)
3 讨论
3.1 高剂量白酒糟对山羊瘤胃发酵参数的影响瘤胃pH是判断瘤胃发酵状况及其瘤胃微生物状态是否正常的标志性指标[11]。对瘤胃消化和代谢的主要影响是纤维物质的分解和VFA的吸收[12]。纪宇等[13]添加不同比例白酒糟饲喂育肥山羊发现,随着白酒糟比例的增高,瘤胃pH下降,本试验结果与其相似,可能白酒糟中的酸性物质较多,加之谷物在瘤胃内二次发酵,瘤胃pH显著降低。VFA是厌氧消化过程中一个重要的中间产物,瘤胃发酵产生乙酸、丙酸、丁酸占据总VFA的95%左右[14]。本试验中饲喂65%和75%白酒糟导致山羊瘤胃总VFA含量降低,同时,75%白酒糟组乙酸、丁酸的浓度也明显降低。有研究发现[15],丁酸和乙酸可以相互转化,从丁酸到乙酸有1个ATP生成,增加了能量供应。曹广等[16]研究表明,饲喂2%和5%的发酵酒糟均能使牦牛瘤胃液中的丁酸浓度显著降低,与本试验结果类似。VFA是肠道中抑制病原微生物的重要因素,当VFA浓度升高时可抑制沙门菌的生长,瘤胃中抑制病原微生物的能力还与pH有关。由此推测,较高剂量的白酒糟饲喂,可能有导致山羊肠道致病菌感染的风险。
组胺和LPS等致炎物质可通过瘤胃屏障进入血液和淋巴液中,引发全身炎症[17]。ASCHENBACH等[18]研究发现,瘤胃中的大量组胺可以通过瘤胃屏障进入血液,导致全身组胺的增加,加速瘤胃的炎症反应。此外,组胺还可作炎症诱导剂,参与炎性细胞因子的调控和表达,进而诱导炎症的发生、发展[19-21]。本试验65%,75%白酒糟组山羊瘤胃液组胺含量显著高于对照组,与SUN等[22]和CHANG等[23]研究结果类似,可能由于饲喂白酒糟会降低瘤胃液pH,造成瘤胃发酵异常,微生物结构改变,产生大量脱羧细菌,进而让组氨酸脱羧形成组胺[24]。LPS是一种超强的致炎因子,一旦进入内循环发生紊乱,就会造成动物机体免疫系统混乱,巨噬细胞通过释放大量的炎症细胞因子来应对身体的免疫反应[25-26]。本试验65%和75%白酒糟组山羊瘤胃液LPS浓度显著高于对照组,与MIZUGUCHI等[27]和MONTERIRO等[28]研究结果一致,可能因饲喂白酒糟会显著降低瘤胃液pH,使许多革兰阴性菌加速破裂、溶解,细菌壁大量释放LPS,导致LPS浓度显著升高[29]。
3.2 高剂量白酒糟对山羊瘤胃微生物群落的影响本试验基于山羊瘤胃微生物门水平的优势菌为厚壁菌门和拟杆菌门,且占瘤胃微生物门类的90%以上,与郭婷婷等[31]研究甘露寡糖对奶牛瘤胃微生物结构的影响时的结果相符,也与索效军等[32]利用16S rDNA扩增子测序分析湖北黑头羊瘤胃微生物多样性结果一致。拟杆菌门主要功能是从碳水化合物和蛋白质中获取能量,含有更多的制造维生素C、B2、B5和H的菌类,本试验拟杆菌门随着白酒糟饲喂的增多呈上升趋势,提示饲喂白酒糟可使瘤胃摄取能量的能力得到适应性增加;而厚壁菌门随着白酒糟饲喂量的增多呈下降趋势。有研究发现[33],肥胖者与苗条者相比,都出现了体内的厚壁菌门减少,拟杆菌门增多的现象,本试验结果与之一致,提示饲喂白酒糟可能会增加山羊的脂肪,提升动物的生产性能。造成这一改变发生的原因是很宽泛的,并不是某种细菌增加或减少造成的,因为微生物多样性在同一个体内随时间变化不大[34]。基于科和属水平的归类,山羊瘤胃中的普雷沃菌占绝对优势,都归属于拟杆菌门,可分解非纤维素植物多糖,如木聚糖等,在利用果胶和分解蛋白质等方面起关键性作用[35-36]。本试验中,毛螺菌科(Lachnospiraceae)随白酒糟饲量的增加呈下降趋势,其分类下的瘤胃球菌属(Ruminococcus)是山羊瘤胃中的第二大菌属,擅长消化胃肠道中的糖蛋白,含有较多的制造维生素B1和叶酸的菌类[37-38],提示了饲喂高剂量白酒糟可能会降低瘤胃的消化代谢能力。最新人类研究表明[39-40],普雷沃菌与促炎功能有关,随着普雷沃菌丰度的增加,会减少IL-18的产生,从而加剧肠道炎症,并可能导致机体自身免疫,还可能引发慢性功能性胃肠道疾病。本试验中,普雷沃菌科和属相对丰度均随白酒糟饲喂量的增多呈上升趋势,提示饲喂大量白酒糟可能会引发山羊胃肠道产生炎症,引起病变。
3.3 高剂量白酒糟对山羊瘤胃炎性基因表达的影响p65/COX2/VCAM1是NF-κB信号通路中的细胞因子,在炎症和免疫信号通路中发挥重要作用,p65是最常见的异源二聚体,也是作用最强,分布最广,活性最强的信号分子,被激活后可参与大量的基因表达和调控[41]。在一定程度上,可以近似地认为p65的功能作用就是NF-κB的功能作用。p65可促进下游多种黏附分子、炎症因子的表达[42]。本试验中,65%和75%白酒糟组瘤胃液的p65 mRNA表达量显著升高,与赵晨旭[43]研究奶牛亚急性瘤胃酸中毒结果一致,LPS和组胺可以诱发瘤胃上皮细胞炎症,激活NF-κB炎症通路,促进炎性细胞因子的释放,进而诱发瘤胃上皮细胞的炎性反应。
COX2的作用机制是促进单核细胞、巨噬细胞、成纤维细胞、血管平滑肌或内皮细胞等细胞,从而诱发后续的炎症反应[44]。COX2在正常组织的细胞中的活性非常低,然而,当细胞受到炎症的刺激时,它在炎症细胞中的表达量比正常水平增加10~80倍,而且在炎症部位的PEG2、PGI2和PGE1的水平也会升高,导致炎症反应和组织损伤[45]。仇玮等[46]研究胃癌病例患者时发现,NF-κB、COX2和VEGF的表达量增高,可能与胃癌的血管生成有关,并起促进作用,本试验65%,75%白酒糟组的COX2 mRNA表达量显著上升,可能会诱发促炎因子释放,造成瘤胃炎症。
VCAM1在肿瘤转移、炎症、寄生虫感染和自身免疫性疾病等病变过程当中具有不可替代的作用[47]。NF-κB可调控VCAM1基因的表达。因为NF-κB在所有细胞中广泛存在,故此VCAM1具备特殊性的细胞表达[48]。KHACHIGIAN等[49]证实了p65可直接地调节VCAM1基因的表达。沈开慧等[50]研究VCAM1含量与神经损伤和炎性反应的关系,发现VCAM1含量的多少与患者的神经损伤和炎症反应严重程度直接相关。本试验饲喂65%和75%白酒糟导致山羊瘤胃液VCAM1 mRNA相对表达量显著升高,可能是p65表达上调,导致VCAM1上调,进而可激活瘤胃组织的炎症通路。

