保定地区羊源致病性粪肠球菌的分离鉴定及其毒力性与耐药性分析
林倩颖,侯铭源,贾 丽,杨 明,武英豪,李连敏,袁丽宁,马玉忠*,杨 威
(1.河北农业大学 动物医学院,河北 保定 071000; 2.河北省畜牧兽医研究所,河北 保定 071000)
粪肠球菌(Enterococcusfaecalis)是一种兼性厌氧的革兰阳性球菌,广泛存在于自然界,是人和动物胃肠道内定植的机会致病菌[1]。然而,根据近年来的研究发现,人和动物感染粪肠球菌的病例不断增加,在感染革兰阳性菌的病例中,感染率仅次于葡萄球菌[2]。尿路感染、败血症、心内膜炎等与粪肠球菌感染密切相关[3]。
近年来,抗生素在兽医临床与畜牧养殖上的广泛使用导致动物源性粪肠球菌的耐药性增强,感染率上升,为畜牧业造成了严重的经济损失。本试验拟通过采集保定地区患有肺炎、腹泻羊的样本,对其进行药敏试验、致病性试验、毒力基因检测、耐药基因检测,探究河北保定地区羊源致病性粪肠球菌的毒力性与耐药性,为该病的防治提供参考。
1 材料与方法
1.1 材料KF链球菌琼脂购自青岛海博公司;LB肉汤培养基、营养琼脂培养基、伊红美蓝培养基购自北京奥博星公司;药敏片为杭州滨和微生物试剂公司生产;2×Taq PCR MasterMix、DNA Marker购自北京天根公司;16S rRNA基因通用引物、粪肠球菌毒力基因引物、耐药基因引物由生工生物工程(上海)公司合成。6~7周龄SPF级BALB/c小鼠,雌、雄各1/2,体质量20~24 g,购自河北医科大学实验动物中心。
1.2 病料来源从保定地区选取同时发生肺炎和腹泻的病羊30只,对病羊进行解剖和观察病变组织,对病变组织拍照记录并分析,取病羊肝脏、肺脏等病变组织,进行病原的分离鉴定。
1.3 细菌的分离纯化将采集好的病变组织涂抹至营养琼脂平板上,37℃ 恒温培养24 h。挑取灰白色、针尖大小的圆形菌落,接种于LB肉汤中,37℃振荡培养12 h,将菌液均匀涂布至KF链球菌琼脂培养基培养24 h,选择深红色圆形菌落纯化培养,随后革兰染色,镜检。
1.4 溶血性试验将纯化后的菌株接种至含有5%无菌绵羊血的营养琼脂平板上,37℃恒温培养24 h,观察其是否溶血,在5%绵羊血培养基上如有直径1 mm左右圆形灰白色菌落,且呈现β溶血,可初步判断为粪肠球菌。
1.5 16S rRNA鉴定采用水煮法提取细菌DNA作为模板,并用16S rRNA基因通用引物进行PCR扩增。扩增产物交由生工生物工程(上海)公司测序,测序结果在NCBI上BLAST比对。阳性菌株以菌液和灭菌甘油水1∶1 比例置于-20℃ 保存。
1.6 药敏试验采用K-B纸片扩散法,根据2018年美国临床委员会(CLSI)推荐的抗菌药物敏感性试验执行标准,对所分离出的粪肠球菌进行13种常见药物的耐药性测定。
1.7 致病性试验将分离纯化后的粪肠球菌接种至LB肉汤,37℃恒温培养过夜,参考文献[4]将菌液浓度调整至1.0×108CFU/mL。将90只小鼠随机分为18组,每组5只,1组为对照组,其余17组为试验组。试验组小鼠分别腹腔注射0.2 mL菌液,对照组小鼠注射等量LB肉汤培养基,观察其发病与死亡情况。剖检死亡小鼠,记录其病理剖检变化。
1.8 毒力基因检测采用PCR方法检测胶原蛋白黏附素(ace)、表面蛋白(esp)、溶血素(cyl)、粪肠球菌心内膜炎抗原(efaA)、蛋白明胶酶(gelE)、透明质酸酶(hyl)、聚合物质(asa1)等7种毒力基因。引物设计与退火温度参照文献[5-6],引物信息见表1。以待检菌株DNA为模板进行扩增,将PCR产物通过凝胶电泳检测。
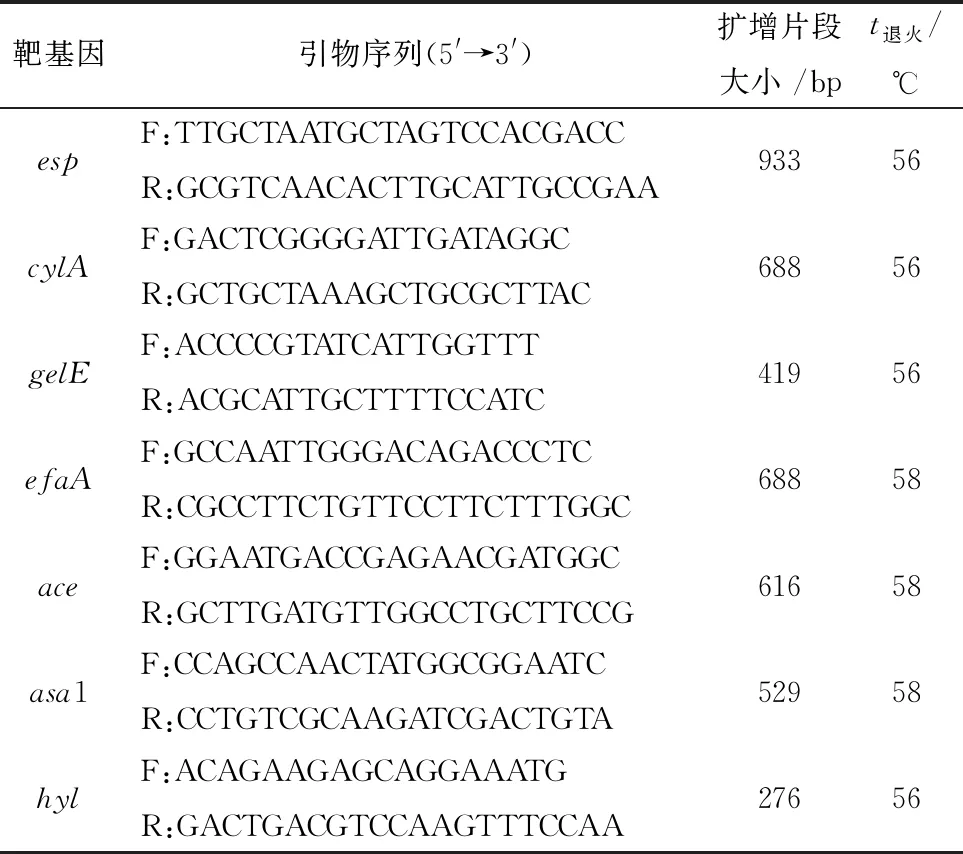
表1 粪肠球菌毒力基因引物序列
1.9 耐药基因检测为检测分离菌的耐药基因携带情况,参考文献[7-8]设计四环素类耐药基因tetM、tetA,氨基糖苷类耐药基因aac(6′)、aph(2″)-Ⅰ、aph(3′)-Ⅲa、ant(6)-Ⅰ,万古霉素类耐药基因vanM,大环内酯类耐药基因ermB,β-内酰胺类耐药基因TEM的引物,引物信息见表2。对目的菌株进行PCR检测。

表2 粪肠球菌耐药基因引物序列
2 结果
2.1 病羊的病理剖检变化剖检病羊,观察其组织器官病理变化,发现肺部淤血,呈暗红色,表面有大量纤维素性渗出物,触摸失去正常肺脏组织应有的弹性(图1);心脏壁变软;胆囊肿胀,充满胆汁(图2);肾脏质地变软(图3);皱胃黏膜出血,幽门部出血肿胀(图4);盲肠出血,黏膜脱落。
2.2 细菌的分离纯化与形态学观察分离出的细菌在绵羊血琼脂培养基上长出表面光滑、圆形凸起、边缘整齐、针尖大小的半透明菌落,呈β溶血,有溶血环(图5)。革兰染色镜检,油镜下可见大量蓝紫色球菌(图6)。在KF 链球菌琼脂培养基上长出红色点状菌落(图7)。
2.3 16S rRNA鉴定以待测菌株DNA为模板,并用16S rRNA基因通用引物进行PCR扩增,扩增产物交由生工生物工程(上海)股份有限公司测序,测序结果在NCBI上BLAST比对,17株分离株与粪肠球菌的同源性为98%~99%,确定为粪肠球菌(图8)。

图1 肺部纤维素性渗出
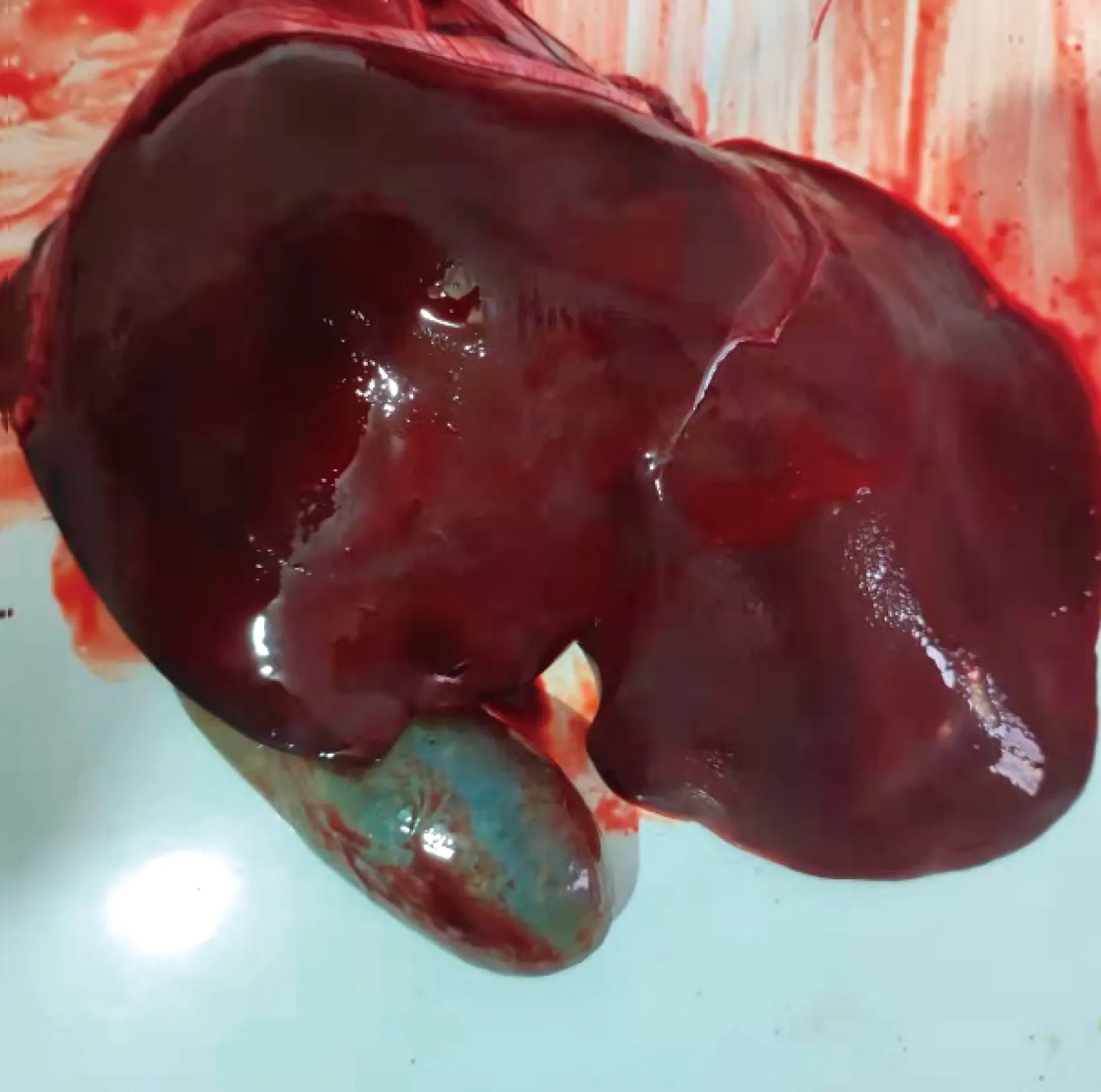
图2 胆囊肿胀

图3 肾脏质地变软
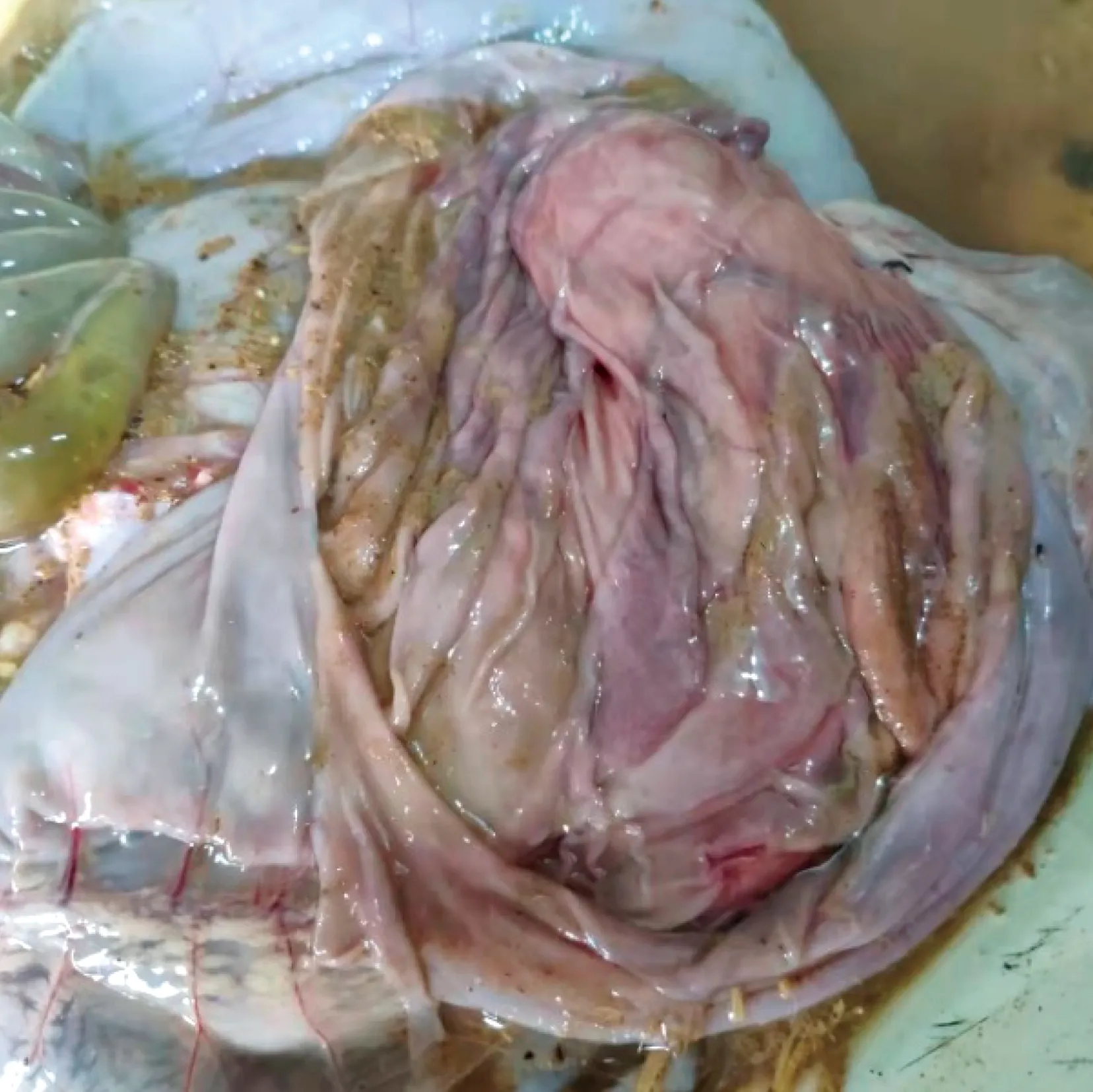
图4 皱胃黏膜出血
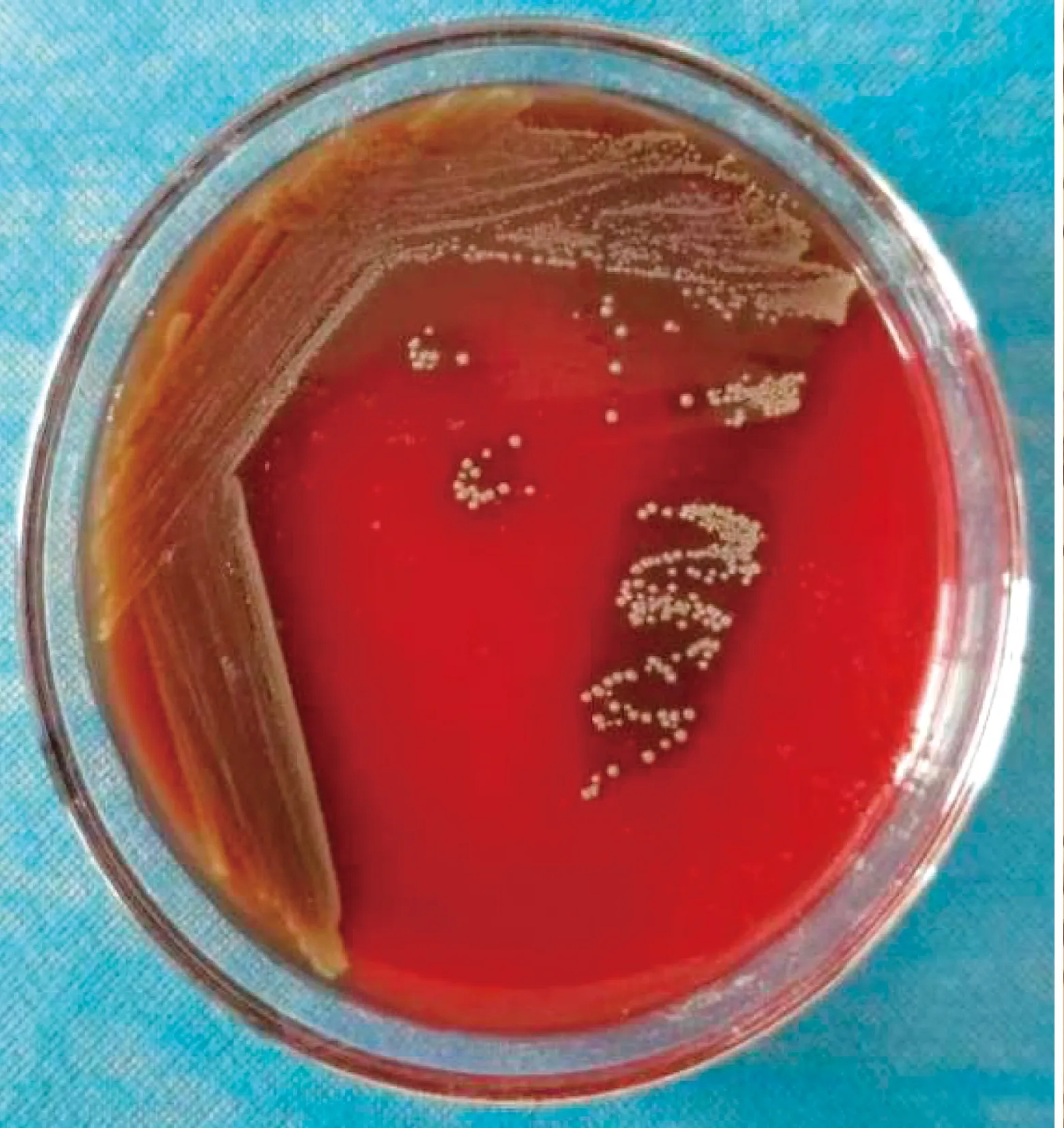
图5 血平板上菌落形态

图7 KF链球菌琼脂平板上菌落形态
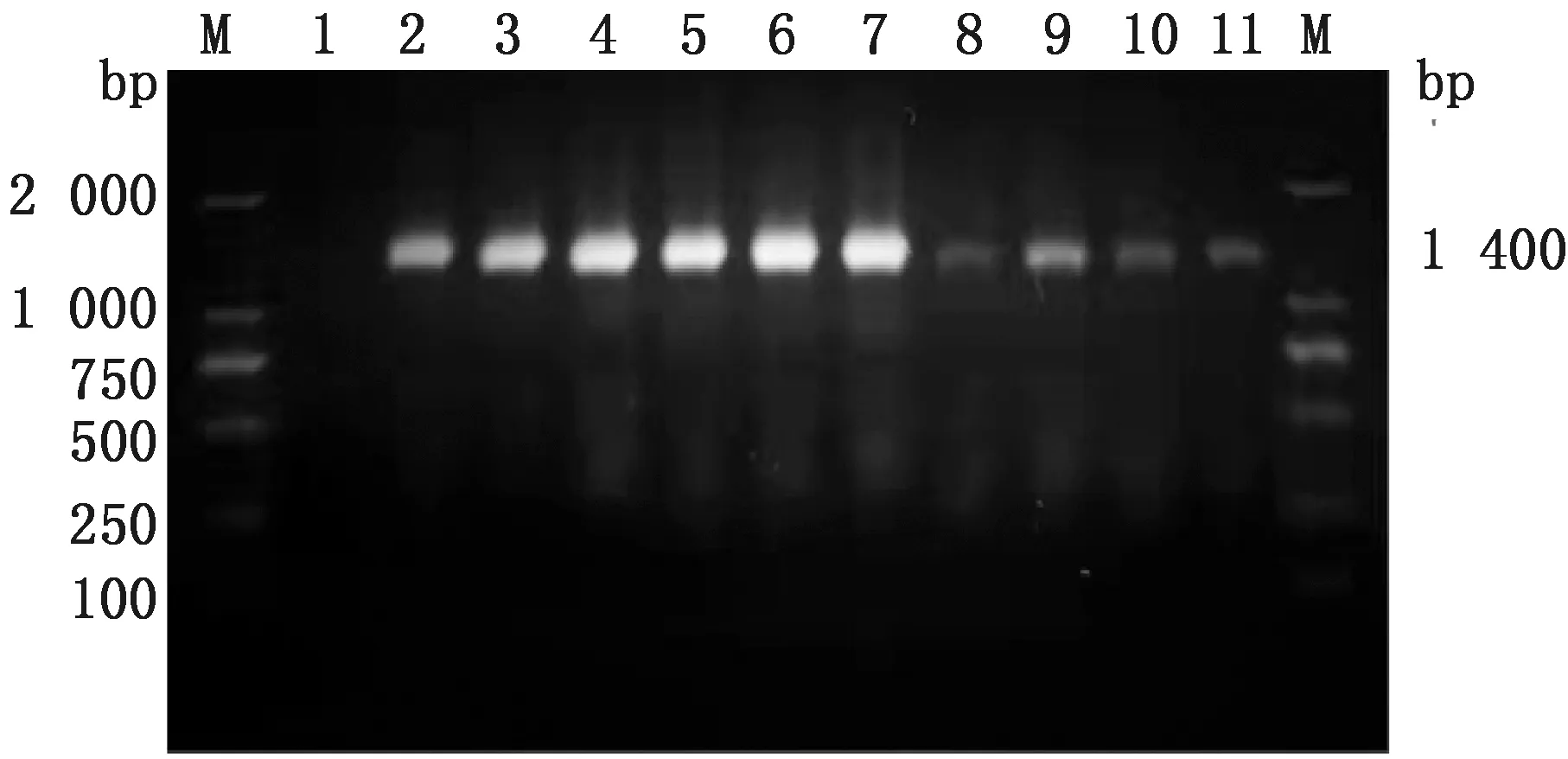
M.DL2000 DNA Marker;1.阴性对照;2~11.被检菌株
2.4 药敏试验耐药情况见表3,17株粪肠球菌对阿奇霉素、红霉素、庆大霉素、克林霉素4种药物的耐药率为100.00%。对氧氟沙星、万古霉素、四环素、利福平的耐药率较高,分别为88.24%,82.35%,64.71%和58.82%。对青霉素G耐药率较低为0.00%。
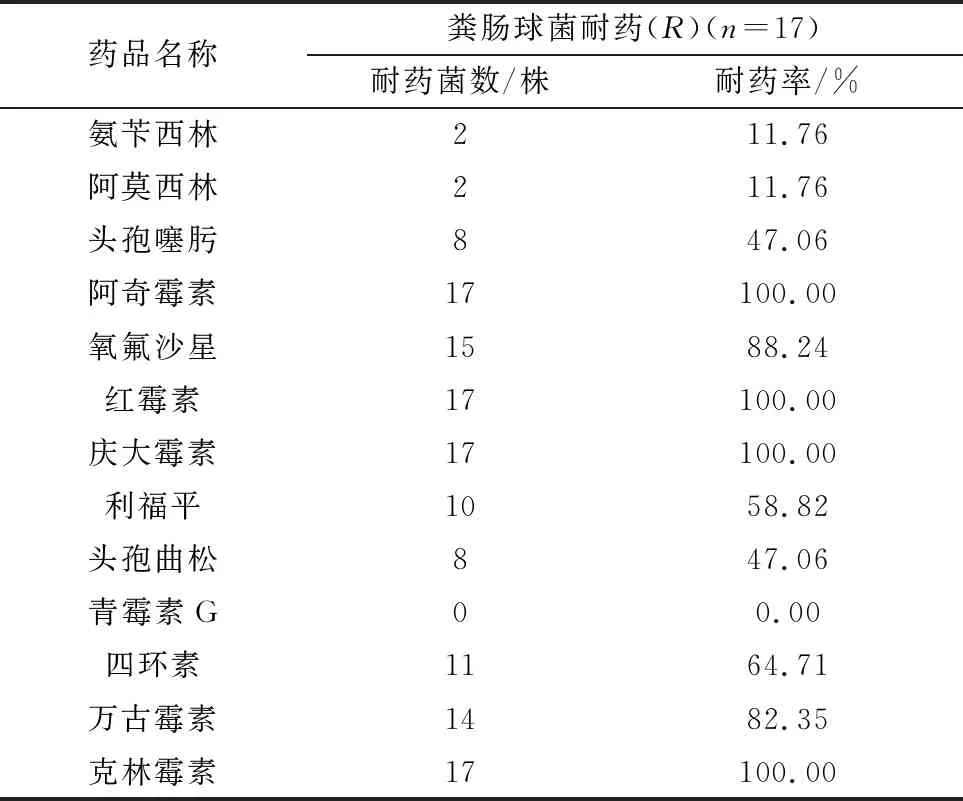
表3 粪肠球菌耐药率
2.5 致病性试验试验组小鼠注射菌液24 h内出现精神萎靡、行动迟缓、进食量减少等表现,注射24 h 后开始出现死亡,72 h后试验组小鼠全部死亡。对照组小鼠未出现临床症状。将死亡小鼠剖检后发现(图9),肝脏(图10a)、脾脏(图10c)肿大,脾脏表面有坏死灶,肺脏(图10e)淤血,呈暗红色,盲肠(图10f)表面有出血点。死亡小鼠剖检结果与病羊病理剖检特点吻合,表明粪肠球菌感染可能是引起病羊发生肺炎、腹泻的原因。
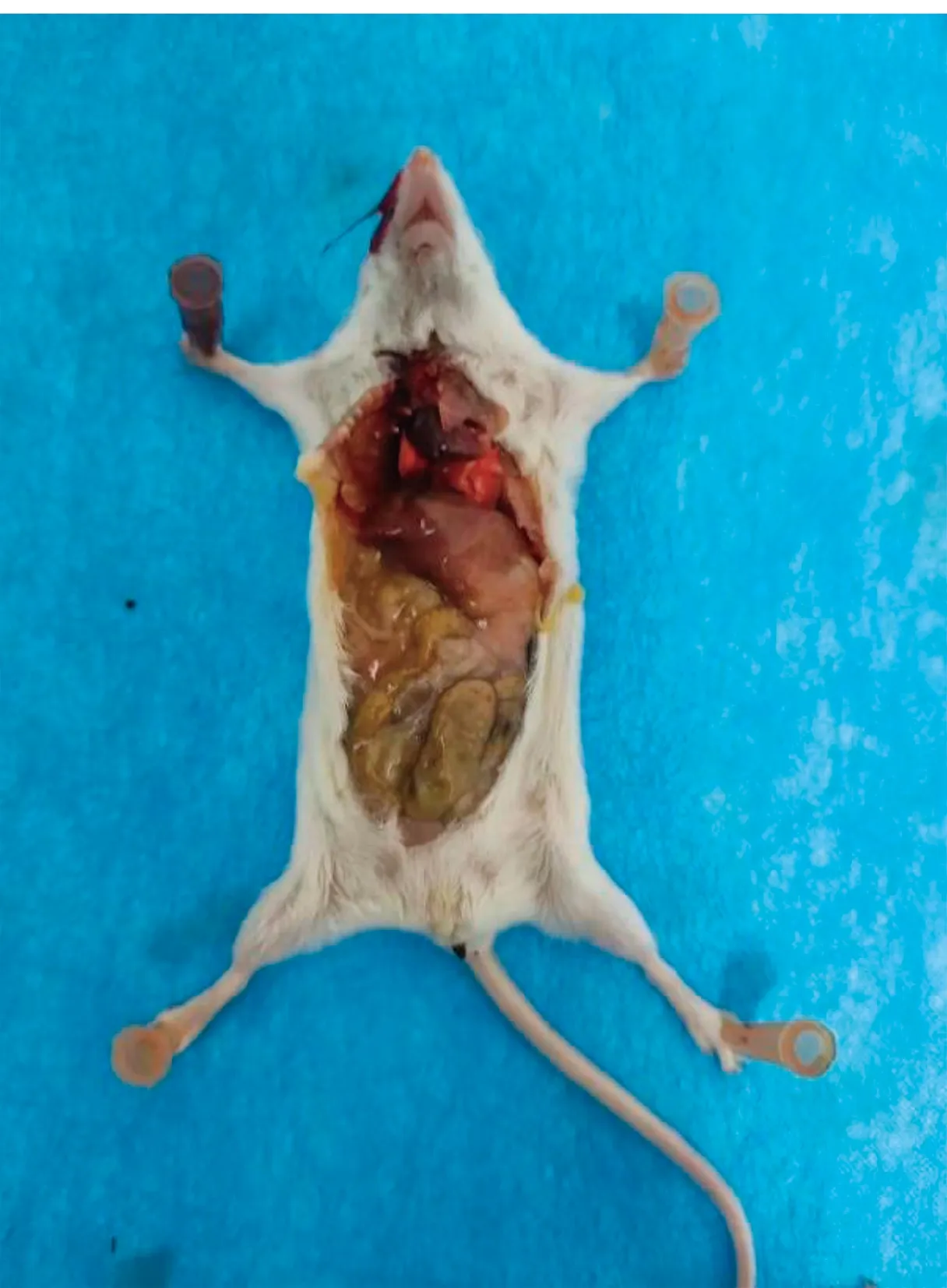
图9 攻毒组小鼠剖检图
2.6 毒力基因共检出6种毒力基因(表4,图11~14),其中ace基因检出率最高为100.00%。未检出hyl基因。其中大多数菌株同时存在2种及以上毒力基因。

a.肝脏;b.心脏;c.脾脏;d.肾脏;e.肺脏;f.盲肠
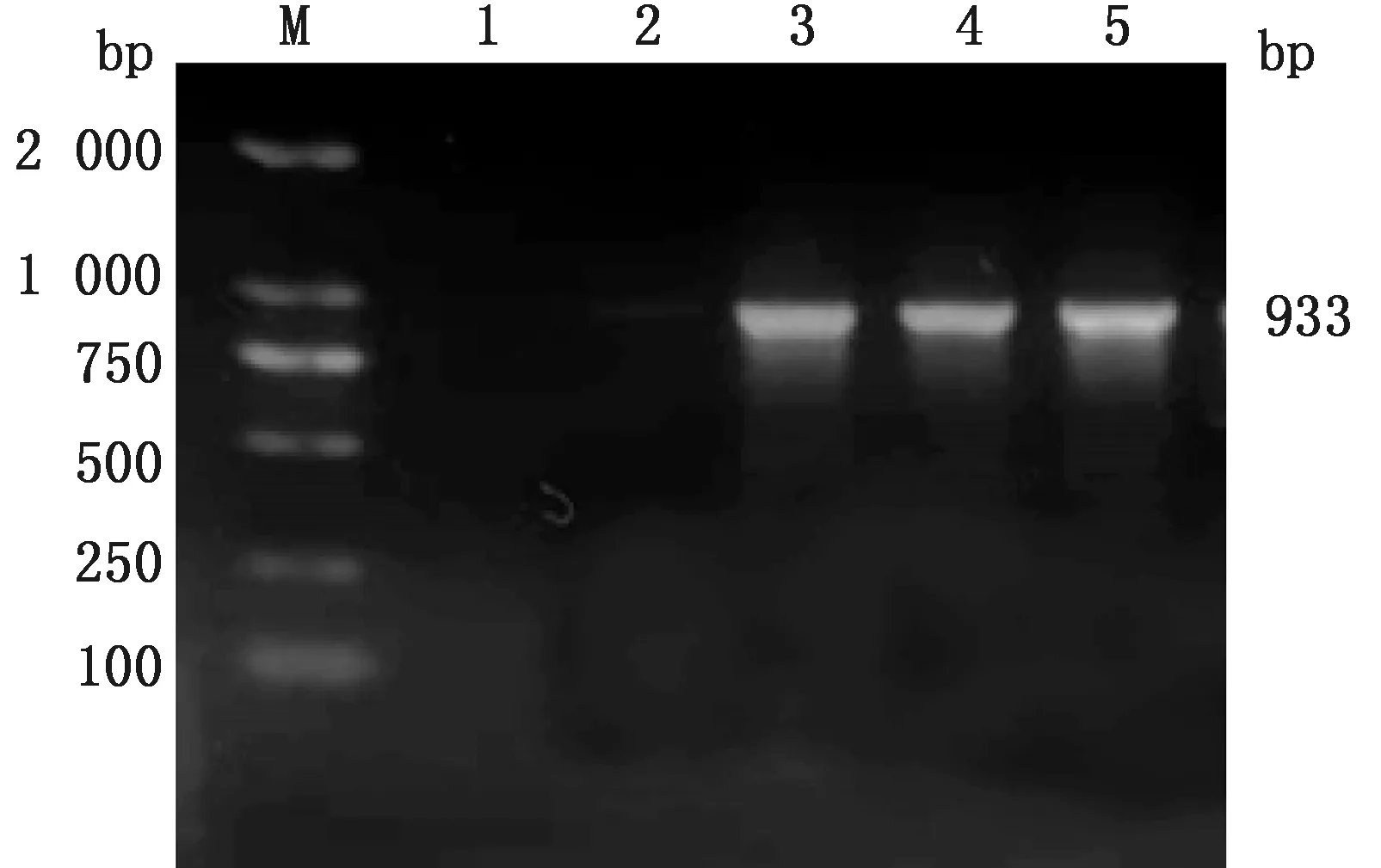
M. DL2000 DNA Marker;1.阴性对照;2~5.被检菌株
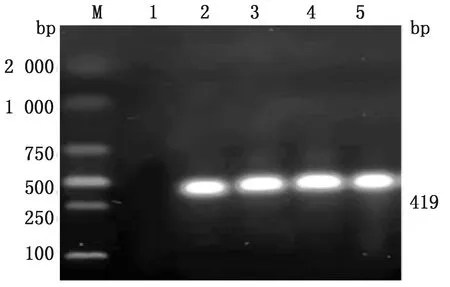
M.DL2000 DNA Marker;1.阴性对照;2~5.被检菌株

M.DL2000 DNA Marker;1.阴性对照;2~5.被检菌株

M. DL2000 DNA Marker;1.阴性对照;2~5.被检菌株

表4 粪肠球菌毒力基因的检测
2.7 耐药基因共检出5种耐药基因(表5,图16~18),大环内酯类ermB基因(图18)检出率最高,为100%,β-内酰胺类的耐药基因未检出。

表5 粪肠球菌耐药基因的检测
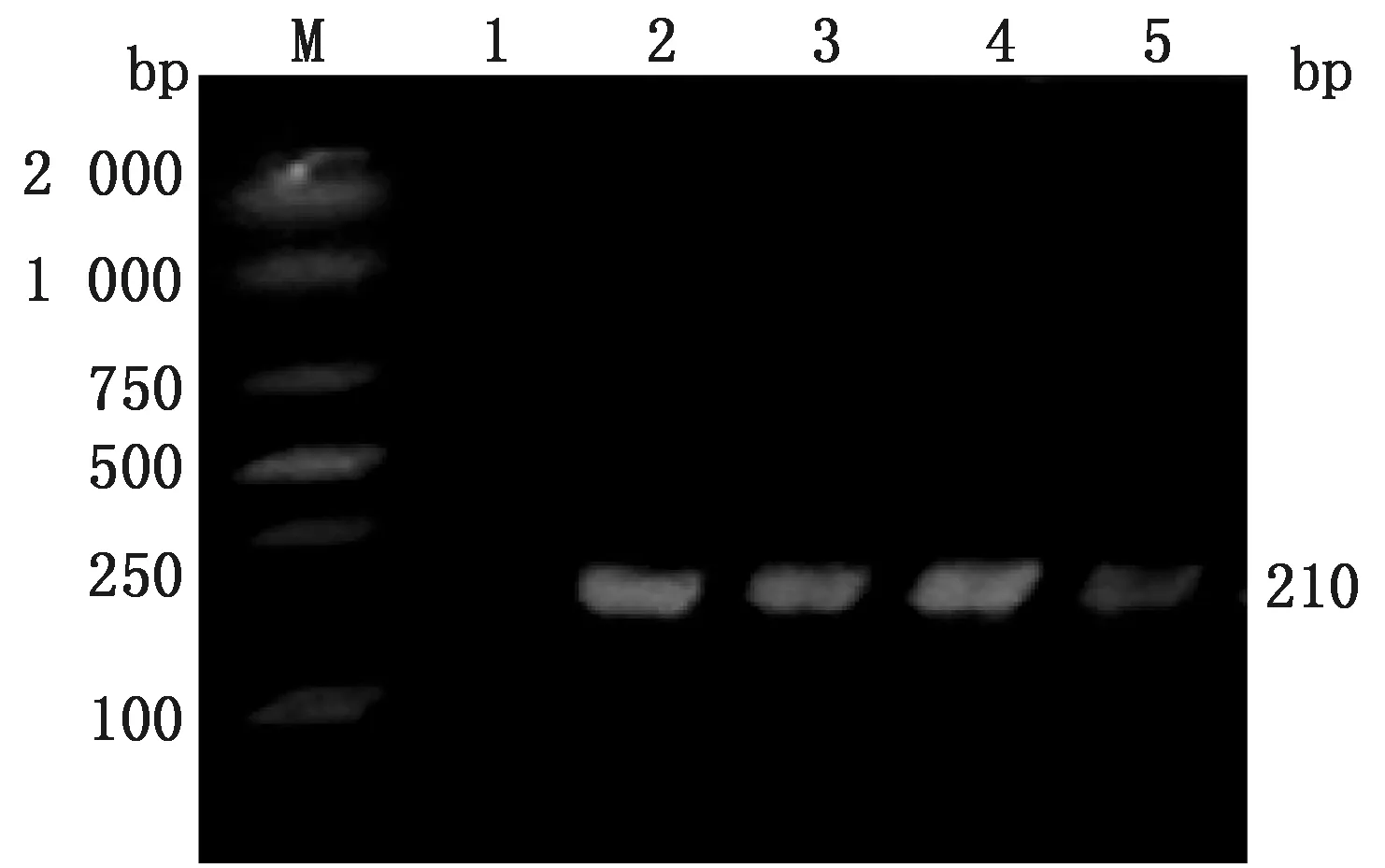
M.DL2000 DNA Marker;1.阴性对照;2~5.被检菌株

M.DL2000 DNA Marker;1.阴性对照;2~5.被检菌株
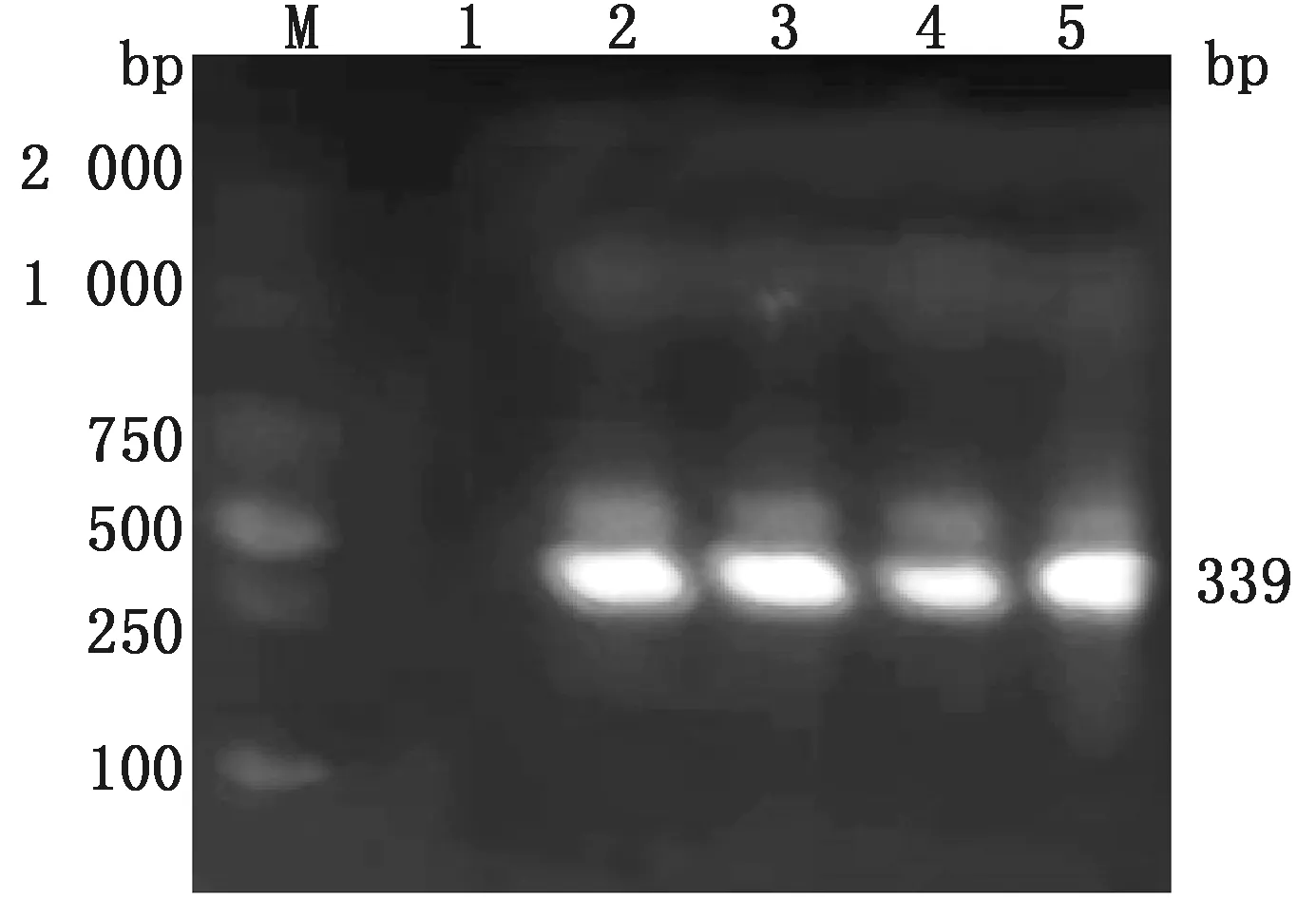
M.DL2000 DNA Marker ;1.阴性对照;2~5.被检菌株

M.DL2000 DNA Marker;1.阴性对照;2~5.被检菌株
3 讨论
粪肠球菌作为人和动物体内的正常菌群发挥着重要的作用。近年来,粪肠球菌作为一种条件致病菌感染的病例越来越多,对人体健康和畜牧养殖都造成了严重的危害。研究表明,粪肠球菌与尿路感染、乳腺炎、子宫内膜炎、脑膜炎、感染性心内膜炎等多重疾病的发生相关[9-10],而粪肠球菌与呼吸系统疾病的关系报道较少。探究羊源致病性粪肠球菌的毒力性与耐药性,对于指导对羊肺炎和腹泻等疾病的用药,控制该病的传播具有重要意义。
本研究对河北保定地区发生肺炎和腹泻的30只病羊进行剖检,并对病变组织进行细菌的分离鉴定,共分离出17株粪肠球菌。将分离到的菌株接种到绵羊血琼脂平板上,呈β溶血,证明分离到的粪肠球菌具有致病性,可以引起羊的败血症与菌血症[11]。将分离到的菌株接种到小鼠体内,小鼠24 h内出现临床症状,72 h后全部死亡,说明分离到的粪肠球菌具有致病性。剖检死亡小鼠可以发现,肺部淤血,盲肠出血等症状,与病羊剖检症状相吻合,表明粪肠球菌感染可能是引起病羊发生肺炎、腹泻的原因。
本研究采用分子生物学的方法,对17株致病性粪肠球菌进行了7种常见的粪肠球菌毒力基因的检测,均检出了ace基因;此外,esp基因、gelE基因和efaA基因检出率较高,与CRETI等[12]的检测结果相似。ace基因为胶原蛋白黏附素,在粪肠球菌感染宿主细胞的过程中有辅助粪肠球菌黏附在宿主细胞表面并完成定殖的作用;efaA基因也是粪肠球菌的一种表面黏附蛋白;esp基因可以参与细胞壁的合成,有促进细菌黏附的作用;gelE基因与粪肠球菌生物膜的形成有关,可编码产生活性肽和自溶素,加速细菌的繁殖与扩散[13]。本试验中粪肠球菌编码黏附力的基因较多,细菌可能是由于较强的黏附性对机体造成的损伤;且具有能够介导产生自溶素的基因,能使宿主细胞加速裂解,促进病原菌在宿主体内扩散,这可能与粪肠球菌的致病性相关,这与黄奕雯等[14]的观点相似。本试验检出较多菌株同时含有多个毒力基因,因此粪肠球菌的致病过程可能与多种毒力基因共同作用有关,这与王亚宾等[15]的研究结果相似。在致病性试验中,试验组小鼠被致病性粪肠球菌感染死亡,但存活时间均有差异,可能与不同致病性粪肠球菌菌株携带的毒力基因种类不同相关。
为探究分离株的耐药性,本研究对其进行了药敏试验和耐药基因的检测。在13种常见药物中,氨苄西林、阿莫西林、青霉素G等3种β-内酰胺类药物的耐药率较低;在耐药基因检测中,β-内酰胺类的耐药基因未检出。因此,在致病性粪肠球菌感染的病例治疗过程中,可以优先使用氨苄西林、阿莫西林、青霉素G等β-内酰胺类药物进行治疗。在本试验中,大多数药物的耐药率与其对应种类药物的耐药基因检出率相似或一致,如万古霉素的耐药率与万古霉素类vanM基因的检出率相同,均为82.35%;但也有个别药物耐药率与其对应耐药基因的检出率的差异较明显,如四环素的耐药率和tetM基因的检出率差异较大,分别为64.71%和35.29%。说明耐药基因可以反映粪肠球菌的耐药程度,但也可能会存在耐药表型与耐药基因不匹配的问题,造成差异的原因可能是耐药基因未表达或存在其他耐药机制,与钟锐等[7]的试验结果相似。通过药敏试验和耐药基因检测发现,粪肠球菌对阿奇霉素和红霉素的耐药性较强,且大环内酯类耐药基因ermB的检出率较高,可能由于大环内酯类药物的滥用和养殖人员盲目用药有关,及时对疑似感染致病性粪肠球菌的病例进行病原菌分离鉴定与药敏试验对阻断粪肠球菌的进一步感染具有重要意义。
本试验通过对肺炎与腹泻的病羊进行了粪肠球菌分离鉴定试验,分析了保定地区羊源致病性粪肠球菌的毒力性与耐药情况,为羊源致病性粪肠球菌的诊断和治疗提供了依据。

