基于铜死亡相关长链非编码RNA构建膀胱癌患者预后风险评估模型
许铖铖,陈阿琴,毛朝明,崔兵
1.江苏大学附属医院核医学科,江苏 镇江 212001
2.江苏大学附属医院输血科,江苏 镇江 212001
膀胱癌是起源于尿路上皮的恶性肿瘤,是我国泌尿系统肿瘤所致死亡的最常见原因[1]。膀胱癌的治疗方案包括手术切除、放化疗和免疫治疗等,尽管这些治疗方法近年来取得了显著进展,但患者治疗后复发或进展的可能性仍较高,其中约40%的患者会多次复发[2]。目前临床上膀胱癌患者的预后主要通过组织病理学诊断和肿瘤分期系统进行预测,但准确度不高。虽已有多个研究通过TCGA和GEO等公共数据库构建膀胱癌预后模型,但仍无法同时满足方便快捷和高准确率的要求[3-5]。因此,建立膀胱癌患者预后的高效预测模型,对于指导临床个性化治疗十分必要。
多项研究发现,多种癌症中存在铜代谢障碍,且患者血清和肿瘤组织中铜水平显著升高[6-7]。铜可以通过增强癌细胞的转移、激活细胞增殖代谢促进肿瘤的发生和发展[8]。因此,调节恶性肿瘤中铜离子浓度有望成为抗癌治疗新的突破点[9]。2022年,Tsvetkov等[10]发现一种新的细胞死亡方式——铜死亡(cuproptosis),即铜离子载体携带的铜与三羧酸循环的脂酰化成分结合,引发蛋白质毒性应激,最终导致细胞死亡。研究发现,铜离子载体和铜螯合剂都有抑癌和诱导癌细胞凋亡的作用[11-13]。但是,膀胱癌中铜死亡的潜在调控作用和机制目前尚不明了。
lncRNA是长度超过200个核苷酸且为非蛋白编码的转录本的RNA,在细胞生长、凋亡、迁移和侵袭等多种生物过程中发挥重要功能,同时也在肿瘤的诊断、治疗以及预后等方面发挥不可或缺的作用[14-15]。因此,与铜死亡相关的lncRNA极有可能在膀胱癌的发生和发展中发挥重要作用。本研究利用TCGA数据库构建并验证基于铜死亡相关lncRNA的膀胱癌患者预后风险评估模型,验证模型后再构建膀胱癌患者预后预测的列线图,旨在为膀胱癌患者的预后预测提供新的工具。
1 资料与方法
1.1 数据来源
从TCGA数据库(https://portal.gdc.cancer.gov/)下载膀胱癌患者的RNA测序数据。纳入标准:①年龄34~90岁,发病部位为膀胱者;②有完整的lncRNA数据和临床数据者。纳入患者不限种族,不区分病理分级及临床分期。通过Perl软件对转录组数据进行数据整理、ID转换、分离lncRNA和信使RNA。
1.2 生物信息学方法筛选与铜死亡相关的基因和lncRNA
从文献[10]获取铜死亡相关基因,经TCGA数据库验证后筛选出在膀胱癌中表达的基因。采用R软件对lncRNA与筛选出的铜死亡相关基因进行Pearson相关性分析,筛选出膀胱癌中铜死亡相关lncRNA,过滤标准为r2>0.4、P<0.001。
1.3 数理方法筛选膀胱癌预后相关lncRNA并构建模型
首先,将1.2筛选出来的lncRNA纳入单因素Cox回归分析模型(过滤标准:P<0.05),初步筛选与膀胱癌患者预后相关的lncRNA;然后,通过Lasso回归模型的交叉验证进一步筛选以减少数据过度拟合;最后,进行多因素Cox回归分析,随机模拟1000次,选取最小平均交叉验证误差的λ值,建立基于lncRNA的膀胱癌患者预后风险评分方程如下:
1.4 免疫功能分析评估膀胱癌预后风险评分模型反映患者免疫状态的准确性
根据建立的lncRNA膀胱癌预后风险评分方程计算的中位数,将患者分为高风险组和低风险组,使用Cibersort算法评估高风险组和低风险组中22种免疫细胞的丰度,使用scale=“row”命令对免疫细胞丰度进行标准化处理,并使用“pheatmap”包绘制组间差异热图。
1.5 构建膀胱癌预后风险评估模型
采用Kaplan-Meier生存曲线评估高风险组与低风险组的总生存期和无进展生存期;单因素和多因素Cox回归分析评估风险评分是否与患者预后独立相关;采用ROC曲线评估风险评分方程对膀胱癌患者1、3、5年存活率的预测价值。在此基础上,构建基于风险评分方程及临床影响因素的膀胱癌患者预后风险评估列线图,并通过校准曲线评估列线图预测的准确性。
1.6 统计学方法
采用R软件(4.1.2版)进行统计分析。Pearson相关性分析检验两个变量之间的相关性;采用Wilcoxon检验分析不同组间免疫细胞丰度的差异;采用Kaplan-Meier法(Log-rank检验)进行生存分析;采用单因素和多因素Cox回归法分析膀胱癌患者预后的影响因素;采用“survivalROC”包构建ROC曲线并计算AUC,“rms”包绘制列线图。P<0.05为差异具有统计学意义。
2 结 果
2.1 lncRNA和临床数据整理
从TCGA数据库中共下载431个膀胱癌相关RNA测序数据和409个临床数据,其中癌旁正常组织标本19个,肿瘤组织标本404个,通过数据整理共得到16 876个lncRNA。
2.2 膀胱癌中铜死亡相关lncRNA筛选结果
从文献[10]中共获取19个铜死亡相关基因(NFE2L2、NLRP3、ATP7B、ATP7A、SLC31A1、FDX1、LIAS、LIPT1、LIPT2、DLD、DLAT、PDHA1、PDHB、MTF1、GLS、CDKN2A、DBT、GCSH、DLST),经TCGA数据库比对,这些基因均在膀胱癌中表达。Pearson相关性分析结果显示,16 876个lncRNA中,与膀胱癌中铜死亡相关lncRNA 924个。
2.3 基于lncRNA的膀胱癌患者预后风险评分方程
单因素Cox回归分析筛选出83个与膀胱癌患者预后相关的lncRNA;Lasso回归分析进一步筛选出19个与膀胱癌患者预后相关的lncRNA;最后通过多因素Cox回归分析筛选出9个与膀胱癌患者预后相关的lncRNA,其中AC108516.2、AC007993.3、LINC01648、AC006160.1和SCAMP1-AS1为膀胱癌患者预后的保护因素,AC105001.1、AC103746.1、AL031651.2和LINC02159为膀胱癌患者预后的危险因素。基于这9个lncRNA建立的膀胱癌患者预后风险评分方程为:风险评分=1.371 68×AC105001.1-1.055 38×AC108516.2-0.345 62×AC007993.3+0.8962×AC103746.1-1.382 87×LINC01648-0.9356×AC006160.1+0.387 84×AL031651.2+0.368 92×LINC02159-0.7607×SCAMP1-AS1。
2.4 基于铜死亡相关lncRNA膀胱癌预后风险评分的患者免疫状态分析
根据建立的风险评分方程,404个肿瘤组织标本风险评分中位数为1.728,根据中位数将患者分为高风险组和低风险组。免疫浸润分析结果显示,高风险组M0巨噬细胞、M1巨噬细胞、M2巨噬细胞、静息肥大细胞及中性粒细胞丰度明显高于低风险组,而低风险组CD8+T细胞、辅助性T细胞、调节性T细胞及浆细胞丰度明显高于高风险组(均P<0.05),见图1。结果提示,基于铜死亡相关lncRNA构建的膀胱癌预后风险评分可以较好地反映膀胱癌患者的免疫状态,为患者的免疫治疗及预后预测提供参考。

图1 基于铜死亡相关长链非编码RNA膀胱癌预后风险评分的高风险组和低风险组免疫浸润分析结果Figure 1 Analysis of immune infiltration in high-risk and lowrisk groups defined by prognosis risk model of bladder cancer based on cuproptosis-related long non-coding RNAs
2.5 预后风险评分模型的临床应用价值
Kaplan-Meier生存曲线分析结果显示,与高风险组比较,低风险组的总生存期和无进展生存期更长(均P<0.01),见图2。对风险评分和患者的年龄、性别、肿瘤分级及分期与患者预后进行单因素和多因素Cox回归分析结果显示,患者年龄、肿瘤分期及风险评分是患者预后的独立影响因素,见表1。ROC曲线分析结果显示,风险评分预测患者1、3、5年生存的AUC分别为0.716、0.697、0.717;患者年龄、肿瘤分期预测患者1年生存的AUC分别为0.670和0.657;风险评分联合患者年龄、肿瘤分期预测患者1年生存的AUC可提高至0.725,见图3。

表1 膀胱癌患者预后影响因素的单因素和多因素Cox回归分析结果Table 1 Univariate and multivariate Cox regression analysis of influencing factors for prognosis of patients with bladder cancer

图2 基于铜死亡相关长链非编码RNA膀胱癌预后风险评分的高风险组和低风险组Kaplan-Meier生存曲线Figure 2 Kaplan-Meier survival curves in high-risk and low-risk groups defined by prognosis risk model of bladder cancer based on cuproptosis-related long non-coding RNAs

图3 基于铜死亡相关长链非编码RNA的预后风险评分预测膀胱癌患者预后的ROC曲线Figure 3 ROC curve for predicting prognosis of bladder cancer patients based on cuproptosis-related long non-coding RNAs prognostic risk model
基于风险评分、患者年龄和肿瘤分期构建的膀胱癌患者预后风险评估列线图中,第20名患者的相应得分为78.5分,对应1、3、5年存活率为0.961、0.868、0.838,图4A所示;基于404个肿瘤组织标本的校准曲线中,预测值与实际值基本一致,见图4B。
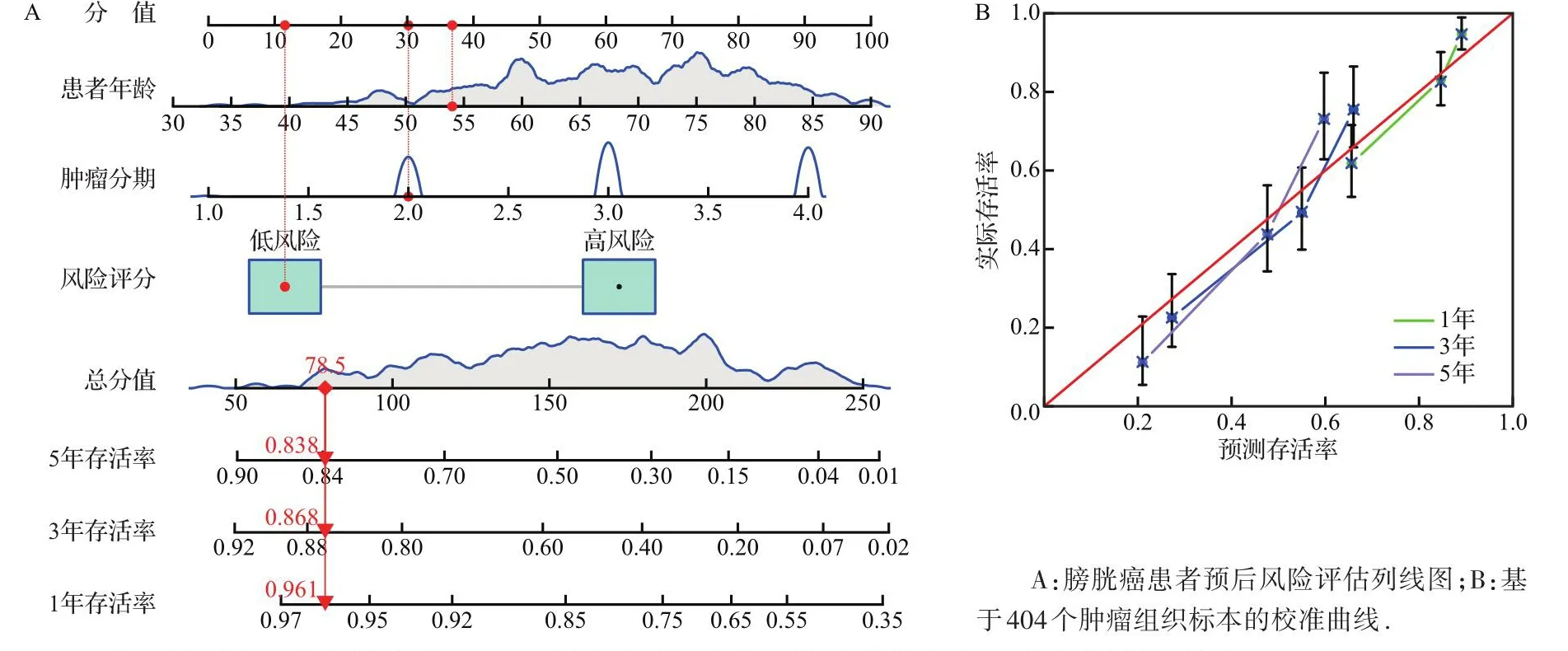
图4 基于铜死亡相关长链非编码RNA预后风险评分构建的膀胱癌患者预后风险评估列线图Figure 4 Prognostic risk assessment nomogram of bladder cancer patients based on cuproptosis-related long non-coding RNAs prognostic risk model
上述结果提示,基于铜死亡相关lncRNA构建的膀胱癌患者预后风险评分模型可以作为患者预后风险评估的有效工具。
3 讨 论
铜死亡是一种铜依赖性的新型细胞程序性死亡,由脂酰化蛋白介导且与细胞线粒体代谢高度相关[10]。目前,已有铜死亡相关lncRNA用于建立肾透明细胞癌、肝细胞癌及胃癌预后模型的报道[6,16-17]。可见铜死亡相关lncRNA与肿瘤的预后有非常紧密的联系,但铜死亡相关lncRNA在膀胱癌预后预测中的应用至今少有探讨。Cai等[18]基于铜死亡相关lncRNA构建了膀胱癌患者预后评估模型,但模型预测患者预后的AUC均不理想;Li等[19]选用15个铜死亡相关lncRNA构建了膀胱癌患者预后评估模型,虽然AUC较高,但由于选用的lncRNA数过多,临床应用中检验难度较大。本研究基于TCGA数据库建立铜死亡相关lncRNA模型来预测膀胱癌患者的预后,旨在为膀胱癌患者的预后风险评估提供新的工具。
本研究通过对TCGA数据库样本的整理和铜死亡相关lncRNA的筛选,利用多因素Cox回归分析共获得9个与膀胱癌患者预后相关的铜死亡相关lncRNA,其中AC105001.1、AC103746.1、AL031651.2和LINC02159为膀胱癌患者预后的危险因素,AC108516.2、AC007993.3、LINC01648、AC006160.1和SCAMP1-AS1为保护因素。有研究显示,在发生心肌梗死的患者中,AC103746.1在血管生成中具有重要的促进作用[20]。膀胱癌是公认的具有高度血管化的肿瘤,血管密度作为膀胱癌患者预后的独立指标,同时高血管密度也是癌症复发的危险因素[21-22]。本文资料提示AC103746.1是膀胱癌患者预后的不良因素,推测可能是通过影响血管形成从而促进膀胱癌的进展。LINC02159,又名LOC285629,为食管鳞癌的低风险基因之一[23],可能通过降低PGRN、PDGF-AA、烯醇化酶2和p70核糖体蛋白S6激酶等表达从而阻碍结直肠癌进展,并且可能降低癌症的耐药性,其表达水平与结直肠癌预后显著相关[24]。但膀胱癌中PGRN/EphA2轴可能会促进血管形成,有助于膀胱癌的进展[25]。因此,LINC02159可能通过靶向PGRN促进膀胱癌的发生和发展。在保护因素方面,有研究显示AC006160.1过表达可显著抑制膀胱癌细胞株的增殖和侵袭能力,可作为膀胱癌发展的保护因素[26],本研究结果与之相符。在肺腺癌患者中,SCAMP1-AS1在N2期中的表达低于N0分期和N1分期[27],表明SCAMP1-AS1可能在肺腺癌中抑制肿瘤进展,本文资料显示SCAMP1-AS1在膀胱癌中同样扮演阻碍其发生和进展的角色。除上述4个lncRNA外,有文献报道LINC01648与糖化血红蛋白相关[28],其余4个lncRNA的功能则尚未见文献报道,需要进一步研究。
膀胱癌患者的风险水平可能受免疫细胞浸润的潜在影响。研究发现,CD8+T细胞能够识别主要组织相容性复合体Ⅰ类分子提呈的肿瘤抗原发挥抗肿瘤作用,CD8+T细胞低水平浸润是膀胱癌患者预后的不良因素[29-30]。Wahlin等[31]发现膀胱癌中存在Foxp3阳性调节性T细胞的浸润,而且高调节性T细胞浸润是复发时间延长的独立预测因子。M2巨噬细胞是一种肿瘤微环境免疫抑制细胞,可以调节或抑制全身免疫反应,从而抑制抗肿瘤免疫[32-33]。本研究中低风险组CD8+T和调节性T细胞的细胞浸润程度明显高于高风险组,高风险组M2浸润程度明显高于低风险组,提示构建的风险评分模型能够较为准确地反映患者的免疫状态,并且可以为膀胱癌患者的免疫治疗提供一定的参考。
生存分析和ROC曲线分析结果显示,本研究构建的风险评分模型在膀胱癌患者预后预测方面具有较高的价值,其联合患者年龄、肿瘤分期预测患者1、3、5年的存活率与实际值基本相符。与传统的膀胱癌预后评估模型[34-35]比较,本模型需要收集的临床资料较为简单,仅需要检测组织中9个lncRNA,方便快捷。同时,本模型中的患者风险等级可以为患者后续是否选择免疫治疗提供一定的参考,有助于患者个性化治疗方案的制订。
综上所述,本研究构建的基于铜死亡相关lncRNA的预后风险评估模型不仅对预测膀胱癌患者的预后具有较高的准确性,还可以评估患者的免疫浸润状态,为后续患者肿瘤免疫治疗提供参考。但是,由于本研究是基于TCGA数据集进行的回顾性分析,结果可能存在偏倚,需要进一步在临床病例中进行验证。
志谢研究得到镇江市169工程项目(YLJ202114)、镇江市社会发展指导性科技计划项目(FZ2022084)支持
AcknowledgmentsThis work was supported by Zhenjiang City 169 Project (YLJ202114), Zhenjiang City Guiding Science and Technology Development Program (FZ2022084)
利益冲突所有作者均声明不存在利益冲突
Conflict of InterestsThe authors declare that there is no conflict of interests
©The author(s) 2023.This is an open access article under the CC BY-NC-ND 4.0 License (https://creativecommons.org/licenses/by-nc-nd/4.0/)

