基于网络药理学和分子对接研究复方抗感颗粒防治流感的作用机制及验证
宋端慧, 郑瑞芳, 胡 旭, 苏文灵, 王雪萌, 王 玥, 邢建国
(1石河子大学药学院, 新疆 石河子 832002; 2新疆维吾尔自治区药物研究所, 乌鲁木齐 830004;3新疆维吾尔药重点实验室, 乌鲁木齐 830002)
流行性感冒(流感)是由流感病毒感染引发的急性呼吸系统疾病,患者临床症状表现为发烧、流鼻涕、喉咙痛,严重可能继发细菌感染进而导致肺炎[1]。目前,治疗和预防流感的药物主要有神经氨酸酶抑制剂如奥司他韦和扎那米韦,M2蛋白离子通道抑制剂如金刚烷胺和金刚乙胺,但这些药物多存在不良反应,高耐药性和经济负担高等问题[2-3],寻找和开发其他药物治疗和防治流感成为研究的热点。复方抗感颗粒(CAG)由神香草、金莲花、欧李等共9味药材组成,主要功效为消退热毒、消瘟除疫、提高机体免疫力,临床主要用于流感的预防和治疗。本研究采用网络药理学[4]和分子对接技术探究复方抗感颗粒抗流感的活性成分,预测关键作用靶点及抗病毒的作用机制,通过细胞实验进行初步验证,现报道如下。
1 材料与方法
1.1 试药复方抗感颗粒(新疆维吾尔自治区药物研究所提供,20220628),p-AKT1抗体 (武汉爱博泰克生物科技有限公司,AP0140),AKT1抗体 (武汉爱博泰克生物科技有限公司,A11016),p-PI3K抗体(武汉爱博泰克生物科技有限公司,AP0854),PI3K抗体(武汉爱博泰克生物科技有限公司,A0982),RIPA(强)裂解液(北京索莱宝科技有限公司,R0010),PMSF(北京索莱宝科技有限公司,P0100),0.25%胰酶-EDTA溶液(美国HyClone公司,SH30042.01),HRP标记的山羊抗兔IgG(中杉金桥公司,ZB-2301),胎牛血清(简称FBS,美国HyClone公司,SH30084.02),BCA蛋白定量试剂盒(美国Thermo Fisher Scientific公司,23227),CCK-8试剂盒(武汉博士德生物工程有限公司,AR1199),DMEM培养基(美国HyClone公司,SH30262.01)。
1.2 仪器HERA cell-150i型细胞培养箱(美国Thermo Fisher Scientific公司),A2型生物安全柜(美国Thermo Fisher Scientific公司),Evos FLoid细胞成像工作站(美国Thermo Fisher Scientific公司),PowerPacTM通用电泳仪(美国Bio-Rad公司),Mini-PROTEAN®Tetra电泳槽(美国Bio-Rad公司),TGL-16K型高速离心机(湖南湘仪实验室仪器开发有限公司),SPARK 20M多功能微孔板检测仪(瑞士TECAN公司),HVS-1000型超净台(苏州安泰空气技术有限公司)。
1.3 流感病毒及细胞株甲型流感病毒(A/Puerto Rico/8/34)鼠适应株(H1N1),犬肾(MDCK)细胞购自中国疾病预防与控制中心病毒病预防与控制研究所;其中甲型H1N1流感病毒在中国医学科学院生物技术研究所培育,保存在-80℃冰箱中,备用。
1.4 复方抗感颗粒的活性成分筛选及靶点预测基于中药系统药理学数据库与分析平台(TCMSP数据库,https://tcmspw.com/),中药分子机制生物信息学分析工具(BATMAN-TCM数据库,http://bionet.ncpsb.org.cn/batman-tcm/),中药综合数据库(TCMID数据库,https://www.megabionet.org/tcmid/)收集复方抗感颗粒9味药材的成分,将收集的单味药材成分经PubChem网站(https://pubchem.ncbi.nlm.nih.gov/)检索3D结构,将3D结构文件导入Swiss ADME (https://www.swissadme.ch/),进行ADME筛选,将满足胃肠吸收度为高(High)、生物利用度≥0.5的药材成分作为CAG的潜在活性成分,运用SwissTargetPrediction平台(https://www.swisstargetprediction.ch/)进行潜在活性成分靶点预测,限定研究物种为“homosapiens”, 筛选可能性≥0.1的潜在活性成分靶点蛋白,形成靶点集。
1.5 流感靶点获取通过DrugBank数据库(https://go.drugbank.com/)、在线人类孟德尔遗传数据库(OMIM数据库,https://omim.org/)和GeneCards数据库(https://www.genecards.org/),检索关键词“流感”,汇总得到流感相关的靶点集。
1.6 CAG活性成分-流感靶点筛选运用Venny 2.0.1平台将收集得到的CAG潜在活性成分和收集得到的流感靶点取交集,绘制韦恩图,共有的交集是CAG潜在活性成分和流感的潜在共同靶点。
1.7 构建蛋白质-蛋白质相互作用(Protein-Protein Interaction, PPI)网络图将获取的潜在共同靶点导入STRING数据库(https://cn.string-db.org/),限定研究物种为“homosapiens”,将最低相互作用得分设置为0.9,筛选潜在靶点,得到PPI网络图。根据结果筛选的含有潜在靶点的化学成分,为CAG的活性成分。将PPI网络图导入Cytoscape 3.9.0软件,运用网络分析工具进行拓扑分析,计算出平均度值,根据其筛选得到成分-流感共同靶点,并将平均度值排名前10的靶点作为核心靶蛋白。
1.8 构建“药物-成分-靶点”网络将CAG活性成分、复方成分-流感共同靶点及其相互关系导入Cytoscape 3.9.0软件进行可视化处理,构建药物-成分-靶点网络,并依据度值排名筛选出核心成分。
1.9 KEGG通路和GO功能富集分析利用DAVID数据库(https://david. ncifcrf. gov/)对“1.6”项下的潜在共同靶点进行京都基因与基因组百科全书(Kyoto encyclopedia of gene and genomes, KEGG) 通路富集分析和基因本体(gene ontology, GO)功能富集分析,GO分析包括生物过程(Biological Process,BP)、细胞组成(Cellular Component,CC)和分子功能(Molecular Function, MF),富集分析条件为错误发现率(False discovery rate, FDR)<0.05,将富集分析结果的前30项分别进行可视化。
1.10 分子对接验证从蛋白质结构数据库(PDB数据库,https://www.rcsb.org/)获取“1.6”项下获得的核心靶点3D结构,结合UniPort数据库(https://www.uniprot.org/)下载前“1.4”的关键成分3D结构,筛选出分辨率高、结构完整的蛋白结构;将核心成分输入TCMSP数据库,获得其3D结构式。采用Autodock 4.2.6软件对下载的3D结构进行半柔性对接,根据对接结果,将结合能最低的5项在Pymol软件进行可视化。
1.11 体外细胞验证实验
1.11.1 细胞及病毒培养 本研究所用细胞维持液为含10%FBS的DMEM培养基,在37℃CO2(5%)的细胞培养箱中培养。流感病毒株采用9日龄SPF级鸡胚传代,采用Reed-Muench法测定病毒在MDCK细胞中的半数组织培养感染剂量(TCID50)为1×105TCID50/mL。
1.11.2 药物细胞毒性实验 为确定CAG对MDCK细胞的安全浓度范围,取对数生长期的MDCK细胞,以2.5×104个/孔接种至96孔板,按“1.11.1”项下条件培养,用二甲基亚砜(DMSO)溶液将复方抗感颗粒配置成浓度为80 mg/mL的储备液,待细胞生长成单层后,吸出培养液,PBS洗涤2次,采用细胞维持液配置倍比稀释的药物稀释液(40~607.5 μg/mL),并设空白对照组(仅含100 μL细胞维持液)、正常细胞对照组(加入100 μL细胞维持液培养)和实验组(加入100 μL CAG药物稀释液培养),培养2 d后,每孔加入5 mg/mL的CCK-8的细胞维持液20 μL,在37℃CO2(5%)培养箱中孵育4 h,弃去细胞上清液,每孔加入100 μL的DMSO溶液,在酶标仪450 nm波长下测定吸光度(OD)值,计算细胞存活率,细胞存活率=[(OD实验组-OD空白组)/(OD对照组-OD空白组)]×100%。
1.11.3 药物抗流感病毒实验 取对数生长期的MDCK细胞,以2.5×104个/孔接种至96孔板,按“1.11.1”项下条件培养,待细胞生长成单层后,吸出培养液,PBS洗涤2次,加入采用细胞维持液倍比稀释的药物稀释液(40~180 μg/mL),并设对照组(100 μL细胞维持液培养)、模型组(仅加入流感病毒悬液)、CAG给药组(分别加入100 μL的40、80、120、180 μg/mL的CAG药物稀释液培养),培养24 h后,每孔加入100 μL含80 TICD50的流感病毒悬液,感染2 h后,弃去病毒悬液,继续孵育24 h,按照“1.11.2”项下的方法进行CCK-8测定,计算流感病毒抑制率,病毒抑制率=[(OD给药组-OD模型组)/(OD对照组-OD模型组)]×100%。
1.11.4 蛋白免疫印记法(Western blot)检测PI3K、AKT1、p-PI3K、p-AKT1蛋白表达水平 取对数生长期的MDCK细胞,以4×105个/孔接种于6孔板,按“1.11.1”项下条件培养,待细胞生长成单层后,吸出培养液,PBS洗涤2次,随机分为对照组(100 μL细胞维持液培养)、模型组(仅加入流感病毒悬液)、CAG给药组(分别加入100 μL的80、120、180 μg/mL的CAG药物稀释液),培养24 h,弃去培养液,除对照组外每孔加入100 μL含80 TICD50的流感病毒悬液,感染2 h后,弃去病毒悬液,继续孵育24 h,弃去培养液,用PBS洗涤2次,每孔加入150 μL的裂解液(1%PMSF和1%蛋白磷酸酶抑制剂的RIPA裂解液),冰浴30 min,离心(12 000 r/min, 20 min, 4℃),离心结束后取上清液,采用BCA蛋白定量试剂盒测定样品蛋白含量,然后分别加入上样缓冲液,金属浴(100℃,5 min),结束后将样品于-20℃环境下保存。配制SDS-PAGE凝胶,进行蛋白样品电泳,然后电转至PVDF膜,用封闭液(5%脱脂奶粉)封闭2 h,封闭结束后,用1×TBST洗涤3次,孵育一抗(PI3K、AKT1、p-PI3K、p-AKT1抗体),4℃孵育过夜,用1×TBST洗涤3次,加入相应的HRP标记的IgG二抗室温孵育2 h,孵育结束后,经ECL显影曝光,采用化学发光成像系统拍照,并采用ImageJ软件分析条带灰度值。
2 结果
2.1 复方抗感颗粒活性成分及靶点信息满足胃肠吸收度为High、生物利用度≥0.5、类药性至少2个Yes条件的活性成分共有613个,probability≥0.1的活性成分靶点共有1 204个。收集得到流感基因共946个。运用Venny平台,将复方抗感颗粒活性靶点与流感靶点取交集,得到205个潜在靶点,并绘制韦恩图,见图1。

图1 复方抗感颗粒活性靶点与流感靶点韦恩图
2.2 复方抗感颗粒防治流感的PPI网络分析PPI网络共有202个节点和5 954条边,见图2。相互作用的蛋白有202个,平均度值为29.475,大于平均度值的有69个共同靶点,按照度值的大小列出前30个靶点,见表1。将PPI网络导入Cytoscape 3.9.0,绘制核心靶基因图,见图3。度值越大,颜色越红,表示与其他蛋白的关系越密切,将度值排名前10的靶点作为复方抗感颗粒治疗流感的核心靶点基因,包括AKT1、ALB、GAPDH、TNF、IL6、VEGFA、IL1B、SRC、STAT3、EGFR。
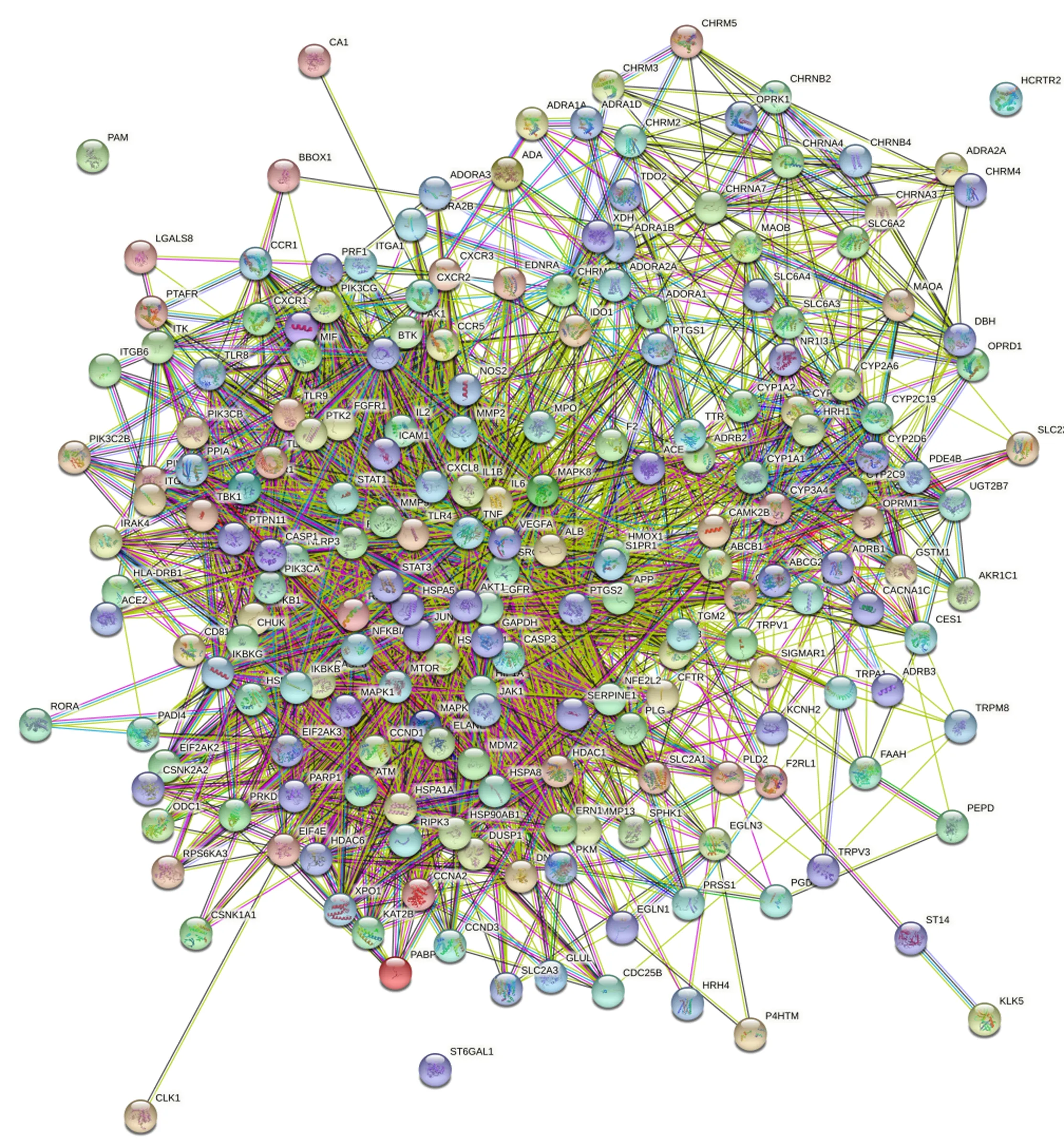
图2 复方抗感颗粒防治流感的PPI网络

图3 PPI网络的核心靶基因

表1 PPI网络的靶基因(排名前30)
2.3 “CAG药物-成分-潜在靶点”网络构建CAG药物活性成分与流感潜在靶点网络,共有371个节点,3 174条边。根据拓扑学分析,其平均度值为17.097,度值越大,说明连接度越大,在网络中的位置越重要。将度值排名前15的药物成分作为CAG核心成分,包括山柰酚、槲皮素、木犀草素、芹菜素、鼠尾草素等,见表2。

表2 复方抗感颗粒核心成分对照表(排名前15)
2.4 复方抗感颗粒的KEGG分析利用DAVID数据库进行KEGG富集分析,得到167条通路(P<0.05)去除具体疾病通路如脂质和动脉粥样硬化,麻疹, 弓形虫病和痢疾等,再筛选去除无关的通路后,将剩下30条通路按照显著性绘制气泡图,见图4。气泡的大小代表通路中涉及的药物-流感共同靶点,可以看出涉及靶点的通路有PI3K-AKT信号通路、甲型流感通路、冠状病毒-新冠肺炎通路等,颜色由绿到红,说明FDR从大到小,FDR越小,颜色越红,显著性越高,其中,甲型流感、冠状病毒-新冠肺炎的通路显著。横坐标基因比例(gene ratio)代表药物-流感共同靶点的数量占该通路总靶点的数量,其中,复方抗感颗粒的活性成分抗流感的主要通路为PI3K-AKT信号通路、甲型流感通路、冠状病毒-新冠肺炎通路。

图4 复方抗感颗粒KEGG 通路分析图
2.5 “CAG成分-靶点-通路”网络结构及分析将KEGG富集分析的前30条通路、通路相关靶点以及对应的复方抗感颗粒的药物成分导入Cytoscape 3.9.0软件,绘制“成分-靶点-通路”网络图,其中共有310个节点,2 504条边。红色方框代表作用靶标,蓝色圆形节点表示药物成分,绿色箭头代表流感治疗相关通路,直观地体现出CAG抗流感的多靶点、多通路的特点,见图5。

图5 CAG成分-靶点-通路图
2.6 GO富集分析利用DAVID数据库对核心靶点基因进行GO功能条目富集分析,共得到939个条目。其中,生物过程有690个条目,涉及炎症反应、白细胞介素-8产生的正调节、缺氧反应等方面;细胞组成有92个条目,主要涉及细胞质、质膜、细胞质等方面;分子功能有157个条目,主要涉及酶结合、相同蛋白结合、血红素结合等方面。根据生物过程、细胞组成、分子功能富集分析结果,分别选择FDR高的10条GO条目绘制柱形图,见图6。

图6 复方抗感颗粒核心靶基因的GO功能分析
2.7 分子对接结果选取度值前5的活性成分山柰酚、槲皮素、木犀草素、芹菜素、鼠尾草素和PPI网络筛选的度值前3的靶点蛋白AKT1、ALB、GAPDH进行分子对接。结合能越小,表示亲和力越好,结合能小于-5 kcal/mol认为对接结果良好。本研究对接结果均小于-5 kcal/mol,说明复方抗感颗粒核心活性成分与核心靶点具有良好的亲和力,分子对接结合能见表3。根据结合能的大小,排名前4位的活性成分与靶蛋白的对接模式,见图7。其中,结合能最小的是芹菜素和靶蛋白ALB (PDB ID: 7QFE),结合能是-7.72 kcal/mol,芹菜素与ALB形成2个氢键,连接的氨基酸残基为LEU-135和ARG-117,氢键用黄色表示,其长度分别为2.3和1.8。

表3 核心活性成分和关键作用靶点的结合能


A 芹菜素-ALB对接图


B 鼠尾草素-ALB对接图
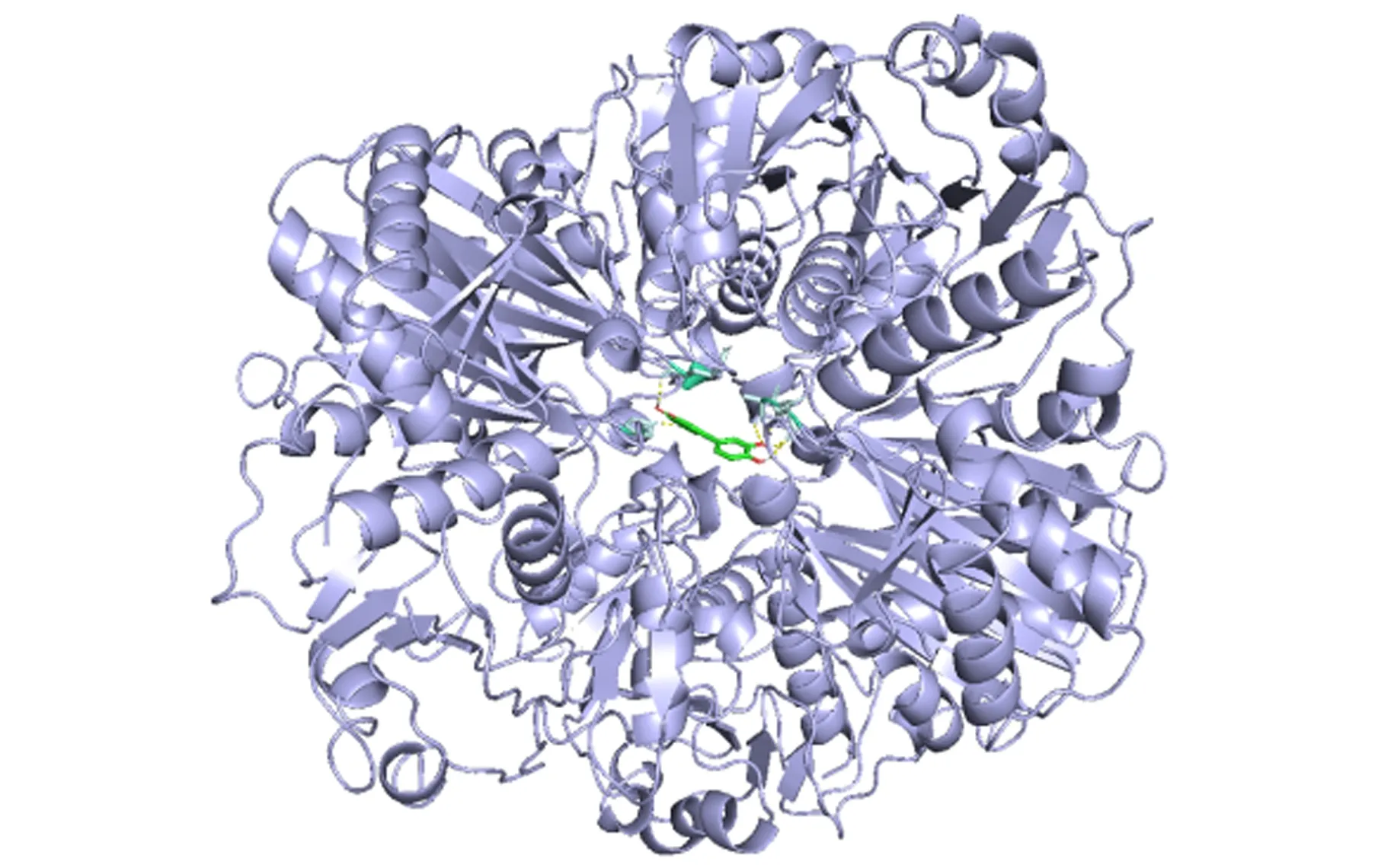

C 木犀草素-GAPDH对接图


D 鼠尾草素-AKT1对接图图7 靶点与成分分子对接图
2.8 细胞验证实验结果
2.8.1 不同浓度CAG对MDCK细胞活力影响 与对照组比较,复方抗感颗粒提取物组浓度在40~180 μg/mL时,细胞存活率在90%以上,表明该浓度范围内药物对MDCK细胞的存活率无明显影响;药物浓度在270~607.5 μg/mL时细胞存活率显著下降(P<0.01),见表4。因此选择给药浓度为80~180 μg/mL进行后续实验。

表4 不同浓度CAG对细胞活力的影响
2.8.2 不同浓度CAG对流感感染MDCK细胞活力的影响 与对照组比较,模型组的细胞存活率显著降低(P<0.01);与模型组比较,80、120、180 μg/mL CAG剂量组存活率均有明显升高(P<0.05) ,见表5。因此后续实验采用的给药剂量为80、120、180 μg/mL。

表5 复方抗感颗粒对流感感染细胞模型细胞活力的影响
2.8.3 CAG对流感病毒感染MDCK细胞对PI3K-AKT1相关蛋白水平的影响 与对照组比较,模型组PI3K表达量升高,差异有统计学意义(P<0.01),见图8。与模型组比较,给药组p-PI3K/PI3K的蛋白表达量比值降低,差异有统计学意义(P<0.01),见图9。与对照组比较,模型组AKT1表达量升高,差异有统计学意义(P<0.01);与模型组比较,给药组p-AKT1/AKT1的比值下降,差异有统计学意义(P<0.01),见图10。

图8 p-PI3K、p-AKT1、AKT1、PI3K的蛋白电泳图

(注:与对照组比较, ##P<0.01;与模型组比较, *P<0.05, **P<0.01)图9 p-PI3K与PI3K的蛋白表达量比值图
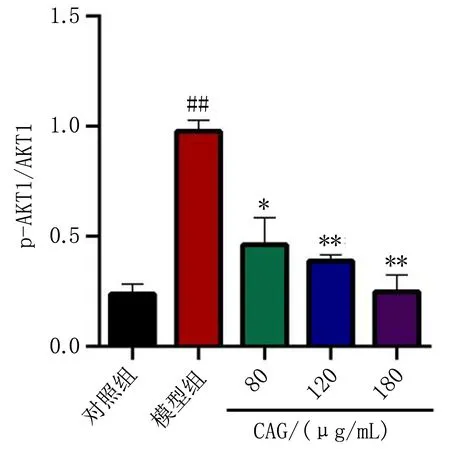
(注:与对照组比较, ##P<0.01;与模型组比较, *P<0.05, **P<0.01)图10 p-AKT1与AKT1的蛋白表达量比值图
3 讨论
本研究得到复方抗感颗粒治疗流感的核心成分包括山柰酚、槲皮素、木犀草素、芹菜素、鼠尾草素等,AKT1、ALB、GAPDH、IL-6、SRC、EGFR是复方抗感颗粒抗流感的重要靶点。AKT1、EGFR、SRC在细胞信号转导中有关键作用,靶向治疗能增强细胞抗病毒宿主防御[5],ALB是维持血液渗透压的重要物质,对炎症反应具有调节作用[6]。GAPDH是细胞调节因子,参与DNA修复以及细胞凋亡等生物过程[7]。IL-6可介导炎症反应,对宿主免疫应答血细胞生成和癌症进行调节[8]。由此可推测复方抗感颗粒治疗和预防流感的主要作用靶点与细胞信号转导、炎症反应、细胞凋亡等密切相关。
KEGG富集分析显示,复方抗感颗粒主要参与PI3K-AKT信号通路、甲型流感、冠状病毒-新冠肺炎。PI3K-AKT信号通路是参与免疫调节、信号转导、炎症反应的重要通路[9],在甲型流感病毒的增殖作用也有重要作用,在病毒复制的早期阶段,病毒利用PI3K-AKT信号通路抑制宿主细胞的凋亡速度,保证病毒的复制和蛋白质的合成,进而增强病毒的增殖能力[10]。根据分子对接结果分析,山柰酚、槲皮素、木犀草素、芹菜素、鼠尾草素等成分作用于AKT1、ALB等靶点防治流感。山柰酚、槲皮素、木犀草素、芹菜素、鼠尾草素是黄酮类化合物,黄酮类化合物在抗病毒和抗炎的分子机制不同。山柰酚可以抑制MyD88/TLR4介导的MAPKs和NF-κB通路,对病毒介导的炎症具有保护作用,可减轻急性肺损伤的炎症程度和氧化应激损伤[11-12]。槲皮素能清除自由基,保护宿主细胞免受活性氧诱导的损伤,通过抑制Caspase-3蛋白的表达,具有抗细胞凋亡的作用[13-14]。木犀草素可以降低甲型流感病毒的复制量,起到抗病毒的作用[15]。芹菜素可以减轻炎症反应,降低病毒的复制效率[16-17]。核心成分与关键靶点的分子对接的结合能均较小,说明亲和性好,核心成分和流感疾病相关的靶点有很好的结合活性。
根据Western blot细胞实验验证的结果,复方抗感颗粒可以下调PI3K和AKT1的蛋白水平,推测复方抗感颗粒通过作用于PI3K-AKT信号通路,调节下游炎症反应,影响酶活性,发挥免疫调节,抑制病毒的复制等来发挥预防和治疗流感的药效。
综上所述,复方抗感颗粒通过调节PI3K-AKT、甲型流感通路,作用于AKT1、PI3K、ALB等疾病靶点,干预炎症反应、转移酶活性、免疫调节等生物学过程,来防治流感。本研究利用网络药理学筛选出复方抗感颗粒的活性成分,预测治疗流感的作用靶点,利用分子对接技术验证复方抗感颗粒活性成分与作用靶点具有良好的结合活性,并对其作用机制进行细胞实验验证,对后续的实验设计和药物开发具有参考意义。

