四妙散改善高尿酸血症和肾损伤以及调节肾脏线粒体相关蛋白的作用研究
王 钐,张悦怡,刘田园,卢美希,戴 璇,刘亚鸽,张艳菲,王丽丽,张东伟[]
• 药理与临床•
四妙散改善高尿酸血症和肾损伤以及调节肾脏线粒体相关蛋白的作用研究
王 钐1,张悦怡1,刘田园1,卢美希1,戴 璇1,刘亚鸽1,张艳菲2,王丽丽3*,张东伟1*[1]
1. 北京中医药大学中医学院糖尿病研究中心,北京 102488 2. 北京中医药大学中医学院解剖教研室,北京 102488 3. 北京中医药大学中药学院中药药理系,北京 102488
探索四妙散改善高尿酸血症小鼠尿酸代谢和肾损伤的作用和可能的作用机制。采用氧嗪酸钾(300 mg/kg)联合次黄嘌呤(500 mg/kg)建立急性高尿酸血症小鼠模型,然后给予四妙散水提液(4.55、9.1、18.2 g/kg)干预7 d。利用生化法分别测定血清和尿液中尿酸(uric acid,UA)的含量,血清中超氧化物歧化酶(superoxide dismutase,SOD)活力及氧化型谷胱甘肽(oxidized glutathione,GSSG)、丙二醛(malondialdehyde,MDA)和肾脏中还原型谷胱甘肽(reduced glutathione,GSH)含量,以及肝脏中黄嘌呤氧化酶(xanthine oxidase,XOD)的活力。利用Western blotting法检测肾脏线粒体融合和分裂相关蛋白表达。苏木素-伊红(HE)染色法观察肾脏的病理变化。四妙散显著降低高尿酸血症小鼠血清中UA含量(<0.05、0.01),显著升高尿液中UA含量(<0.05、0.001),显著升高血清SOD活力和肾脏中GSH水平(<0.05、0.01、0.001),显著降低血清GSSG和MDA水平(<0.05、0.001),显著降低肝脏中XOD活性(<0.05)。同时,四妙散可显著升高肾脏线粒体融合蛋白1(mitofusin 1,MFN1)、MFN2、视神经萎缩相关蛋白1(optic atrophy 1,OPA1)、过氧化物酶体增殖物活化受体γ辅助活化因子-1α(peroxisome proliferator-activated receptor gamma coactivator-1α,PGC-1α)蛋白水平(<0.05),降低线粒体动力相关蛋白1(dynamin-related protein1,DRP1)蛋白表达水平(<0.05),进而抑制其肾脏的病理改变。四妙散能通过调节线粒体相关蛋白的表达,增强机体抗氧化应激的能力,进而改善尿酸代谢和抑制肾损伤。
四妙散;高尿酸血症;肾损伤;氧化应激;线粒体
尿酸是人体嘌呤代谢的产物,在体内过度积累会导致高尿酸血症。而尿酸盐晶体在关节、肾脏等组织中过度沉积能诱发痛风[1]和慢性肾脏疾病[2]等。流行病学研究显示饮酒、吸烟、肥胖、糖尿病、高血压和血脂异常等是诱发高尿酸血症的主要危险因素[3-4]。据统计,2018—2019年中国成年人的高尿酸血症患病率为14.0%,相比2015—2016年患病率显著升高。目前临床常用的降血尿酸药物,包括黄嘌呤氧化酶抑制剂、促尿酸排泄药物和重组尿酸酶制剂等,都存在着一定的局限性,如别嘌醇可能诱发超敏反应,非布司他具有潜在的心血管风险,苯溴马隆具有损伤肝功能、酸化尿液、减少尿酸代谢和排泄的不良反应[5],这促使研究者进一步研发高效低毒的抗高尿酸药物。
高尿酸血症的主要病因是嘌呤代谢紊乱而引起的尿酸产生过多或排泄失衡。研究发现,肝脏中的黄嘌呤氧化还原酶(xanthine oxidoreductase,XOR)是参与嘌呤分解代谢的关键酶,XOR由黄嘌呤脱氢酶(xanthine dehydrogenase,XDH)和黄嘌呤氧化酶(xanthine oxidase,XOD)组成,后者在尿酸的生成过程发挥着重要作用[6-7]。此外,XOD还可通过产生超氧化物和过氧化氢促进体内活性氧(reactive oxygen species,ROS)的产生。另有研究表明,尿酸一旦进入细胞,就会成为一种促氧化剂,增加ROS的过度生成[8-9]。
线粒体与机体的氧化还原稳态密切相关。受损的线粒体能导致机体ROS的过度积累[10-11]。反过来,ROS蓄积也可能导致线粒体功能损伤[12]。研究表明,线粒体融合与分裂活动由众多线粒体功能蛋白参与完成,其动态平衡是线粒体维持有效功能的关键[13]。过氧化物酶体增殖物活化受体γ辅助活化因子-1(peroxisome proliferator-activated receptor gamma coactivator-1,PGC-1)家族参与线粒体形成和能量代谢,且在调控其他细胞功能方面也发挥着核心作用[14]。PGC-1α在氧化应激中促进抗氧化酶的转录,并参与调控脂肪酸氧化、三羧酸循环、氧化应激反应、线粒体生物发生和动力学等相关基因的表达[15]。另有研究发现,高尿酸血症可导致大鼠肾脏线粒体功能障碍,其病理机制与肾皮质氧化应激损伤相关[16]。
四妙散首载于清代医家张秉承所著的《成方便读》,由黄柏、苍术、牛膝、薏苡仁4味中药组成,以黄柏为君药,其主要功效为清热祛湿,临床常应用于湿热下注所致筋骨疼痛、下肢痿软无力、足膝红肿疼痛等症。研究表明,四妙散具有治疗痛风和肾病综合征等的功效[17],这种作用可能与调节抗氧化酶的活性有关[18]。但是,四妙散能否通过调节肾脏组织线粒体的生物活性,增强机体抵抗氧化应激的能力,进而改善血尿酸的代谢和肾功能,尚未见相关报道。因此,本研究以氧嗪酸钾和次黄嘌呤联合诱发的高尿酸血症小鼠为模型,探讨四妙散降低血尿酸的作用以及对肾脏线粒体相关蛋白的影响,以期为防治高尿酸血症及其并发症的药物研究提供新的策略。
1 材料
1.1 动物
48只SPF级雄性昆明种小鼠,体质量(20±2)g,由斯贝福(北京)生物技术有限公司提供,许可证号SCXK(京)2019-0010。所有小鼠均以正常饲料适应性喂养1周。实验方案经北京中医药大学动物实验伦理委员会批准(批准号BUCM-4-2021042303-2017)。
1.2 药材
四妙散由黄柏、苍术、牛膝和薏苡仁组成,以上药材购自北京同仁堂股份有限公司,经北京中医药大学王学勇教授鉴定为芸香科植物黄皮树Schneid.的干燥树皮、菊科植物北苍术(DC.) Koidz.的干燥根茎、苋科植物牛膝Bl.的干燥根、禾本科植物薏苡-jobi L. var.(Roman.) Stapf的干燥成熟种仁。
1.3 药品与试剂
对照品盐酸小檗碱(批号633-65-8,质量分数>98%)、β-蜕皮激素(批号5289-74-7,质量分数>98%)购自成都瑞芬思生物科技有限公司;氧嗪酸钾(批号P831461)、次黄嘌呤(批号HB11076)购自上海麦克林生化科技有限公司;别嘌醇(批号05200502)购自上海信谊万象药业股份有限公司;尿酸测试盒(批号C12-2-1)、XOD测试盒(批号A002-1-1)、微量还原型谷胱甘肽(reduced glutathione,GSH)测定试剂盒(批号A006-2-1)、氧化型谷胱甘肽(oxidized glutathione,GSSG)测试盒(批号A061-1-2)、丙二醛(malondialdehyde,MDA)测试盒(批号A003-1)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(批号A001-3-2)购自南京建成生物工程研究所;线粒体融合蛋白1(mitofusin 1,MFN1)抗体(批号66776-1-Ig)、MFN2抗体(批号12186-1-AP)、视神经萎缩相关蛋白1(optic atrophy 1,OPA1)抗体(批号27733-1-AP)、线粒体动力相关蛋白1(dynamin-related protein1,DRP1)抗体(批号12957-1-AP)、PGC-1α抗体(批号66369-1-Ig)、β-actin抗体(批号66009-1-Ig)、HRP标记的山羊抗兔IgG二抗(批号SA00001-2)、HRP标记的山羊抗鼠IgG二抗(批号SA00001-1)购自Proteintech公司。
1.4 仪器
BSA224S型电子天平(德国Sartorius公司);FLUO star Omega多功能酶标仪(德国BMG Labtech公司);22331 Hamburg离心机(德国Eppendorf公司);电泳和转膜装置(美国Bio-Rad公司);5800Multi型全自动化学发光/荧光图像分析系统(上海天能公司);HPLC/Q-TOF-MS分析仪(美国Waters公司);BX53型倒置显微镜(日本Olympus公司)。
2 方法
2.1 四妙散水提液的制备及主要成分含量测定
将适量四妙散(黄柏15 g、苍术15 g、牛膝10 g、薏苡仁30 g,总生药量为70 g)先加入10倍体积的去离子水,煎煮2 h后倒出,再加入8倍体积的去离子水,煎煮2 h后倒出,合并水煎液,滤去药渣,浓缩至所需的浓度。根据临床成人生药量和体表面积法,四妙散中剂量组小鼠给药量为9.1 g/kg,低、高剂量组小鼠给药量分别为4.55、18.2 g/kg。
四妙散水提液稀释100倍得进样样品,对照品精准称定并溶于甲醇,配得30 μg/mL盐酸小檗碱和1 mg/mL β-蜕皮激素,然后将样本和对照品通过0.22 mm膜滤过,再进行HPLC/Q-TOF-MS分析。色谱条件:Waters C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相为乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱:0~50 min,95%~10% B;50~50.1 min,10%~95% B;50.1~55 min,95% B;柱温35 ℃;体积流量0.3 mL/min;进样量10 μL。质谱条件:正、负离子模式;质量范围/100~1500;离子源喷雾电压3.5 kV;碰撞能量35 eV;毛细管温度320 ℃;探头加热温度400 ℃。结果用Thermo Xcalibur quality Browser进行分析。
2.2 高尿酸血症小鼠分组、造模及给药
小鼠适应性喂养1周后,随机分成对照组、模型组、别嘌醇(5 mg/kg)组和四妙散低、中、高剂量(4.55、9.1、18.2 g/kg)组,每组8只。根据Zhang等[19]造模方法复制高尿酸小鼠模型,除对照组外,其余小鼠分别用氧嗪酸钾(300 mg/kg,0.9%生理盐水配制,ip)和次黄嘌呤(500 mg/kg,0.5%羧甲基纤维素钠配制,ig)造模。对照组小鼠分别ig等体积0.5%羧甲基纤维素钠和ip等体积生理盐水,1次/d。每次造模1 h后ig给药,对照组和模型组ig等体积去离子水,连续7 d。第6天给药后,将小鼠放置代谢笼中收集尿液。第7天给药1 h后分别取血、肝脏和肾脏,其中一部分肝脏和肾脏置于−80 ℃冻存,另一部分置于4%多聚甲醛固定。
2.3 血清生化指标测定
按照试剂盒说明书测定血清和尿液中尿酸含量,测定血清中GSH、GSSG、MDA含量及SOD活力,肝组织XOD活力以及肾组织GSH含量。
2.4 苏木素-伊红(HE)染色观察肾组织病理变化
将固定在4%多聚甲醛溶液中的肾脏组织按照常规HE染色法进行脱水、包埋、切片和染色,中性树胶封片后置于倒置显微镜下观察肾脏组织病理变化并拍照。
2.5 Western blotting检测肾组织MFN1、MFN2、OPA1、DRP1和PGC-1α蛋白表达的影响
将适量的肾脏组织用RIPA裂解液裂解,然后采用低温机械匀浆的方法提取组织蛋白,BCA法测定蛋白浓度。将变性蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后,分别加入MFN1(1∶4000)、MFN2(1∶4000)、OPA1(1∶2000)、DRP1(1∶1000)和PGC-1α(1∶4000)抗体,4 ℃孵育过夜。次日,加入二抗(1∶4000),室温孵育1 h后,用ECL超敏发光液显色,Azure凝胶成像仪拍照。以相应的β-actin作为内参,利用Image J图像分析软件对各目标条带的灰度值进行半定量分析。
2.6 统计学分析

3 结果
3.1 四妙散水提液的主要化学成分分析
利用UPLC/MS技术测定四妙散中的盐酸小檗碱和β-蜕皮激素的含量。通过面积归一化法[20]以对照品和样品中盐酸小檗碱与β-蜕皮激素的色谱图(图1)峰面积计算得,盐酸小檗碱在四妙散中的质量分数为7.6 mg/g,占黄柏生药含量的3.54%;β-蜕皮激素在四妙散中的质量分数为1.9 mg/g,占牛膝生药含量的1.36%。《中国药典》2020年版规定[21],小檗碱在黄柏中质量分数不低于3%,β-蜕皮激素在牛膝中质量分数不低于0.03%,本研究四妙散中盐酸小檗碱与β-蜕皮激素的含量符合《中国药典》2020年版规定。
3.2 四妙散对高尿酸血症小鼠血清和尿液中尿酸含量的影响
如图2所示,与对照组比较,模型组小鼠血清中尿酸水平显著升高(<0.001),尿液中尿酸水平显著降低(<0.05);与模型组比较,各给药组血清中尿酸水平显著降低(<0.001),尿液中尿酸水平显著升高(<0.05、0.01、0.001)。由实验结果可知,各剂量的四妙散均明显减少血液中尿酸含量,促进尿酸随尿液排出体外。然而,不同剂量的四妙散降低血清尿酸的效果无明显差异,低、中剂量的四妙散促进尿酸随尿液的排泄的作用明显高于高剂量的四妙散(<0.05)。以上结果提示,四妙散能降低高尿酸血症小鼠血液中的尿酸水平,同时促进尿酸经肾脏的排泄。
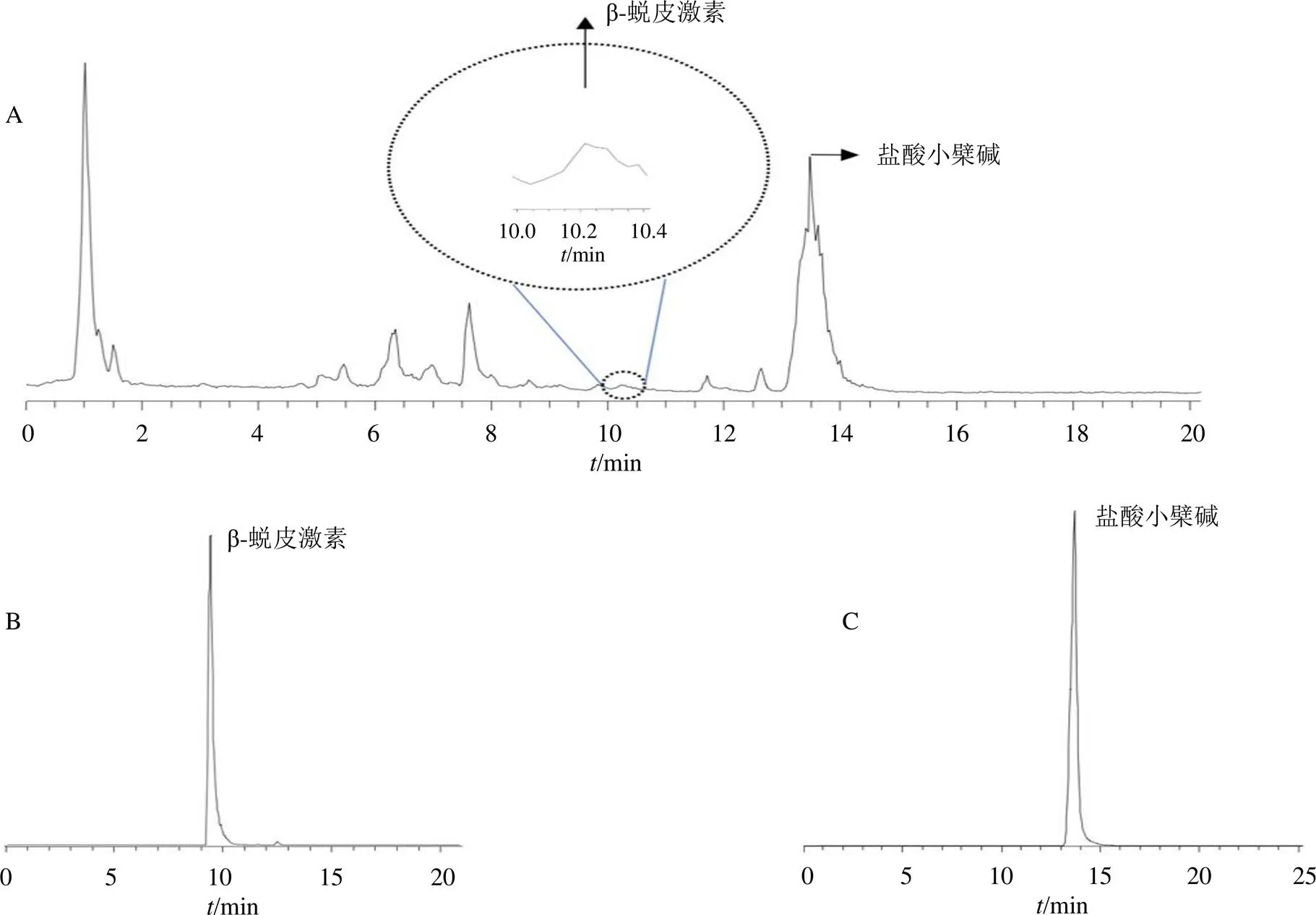
图1 四妙散 (A)、β-蜕皮激素(B) 和盐酸小檗碱(C) 的UPLC/MS色谱图
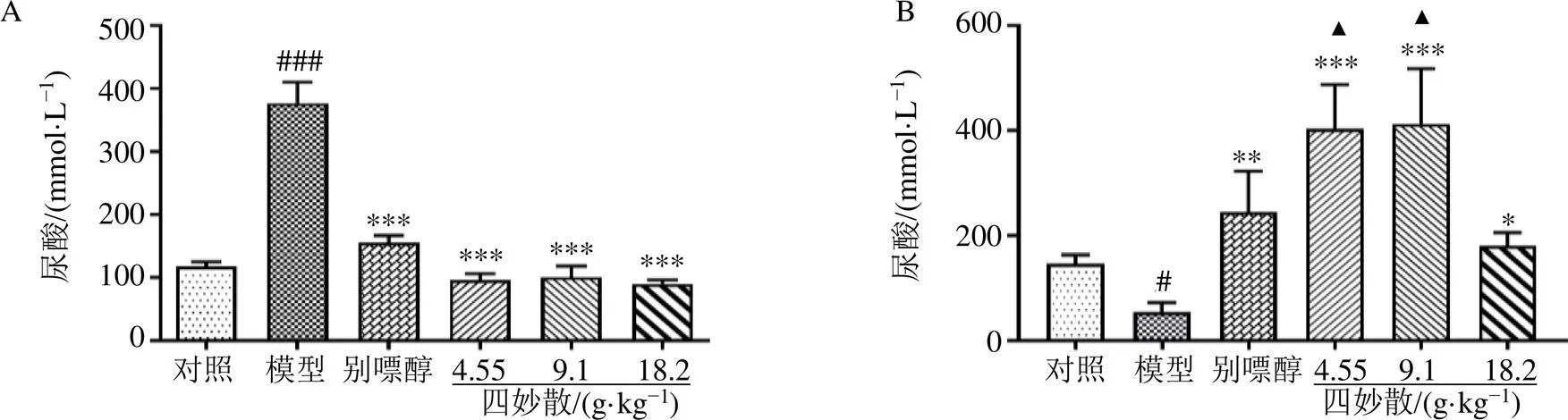
与对照组比较:#P<0.05 ##P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001;与四妙散高剂量组比较:▲P<0.05,下图同
3.3 四妙散对高尿酸血症小鼠血清中GSH、GSSG、SOD、MDA含量的影响
如图3所示,与对照组比较,模型组小鼠血清中GSH水平和SOD活力显著降低(<0.05),GSSG和MDA水平显著升高(<0.05、0.001);与模型组比较,各给药组血清中GSH水平和SOD活力显著升高(<0.05、0.01、0.001),GSSG和MDA水平显著升降低(<0.05、0.001)。以上结果表明,四妙散能够促进高尿酸血症小鼠的还原氧化平衡,从而改善小鼠机体的氧化应激状态。
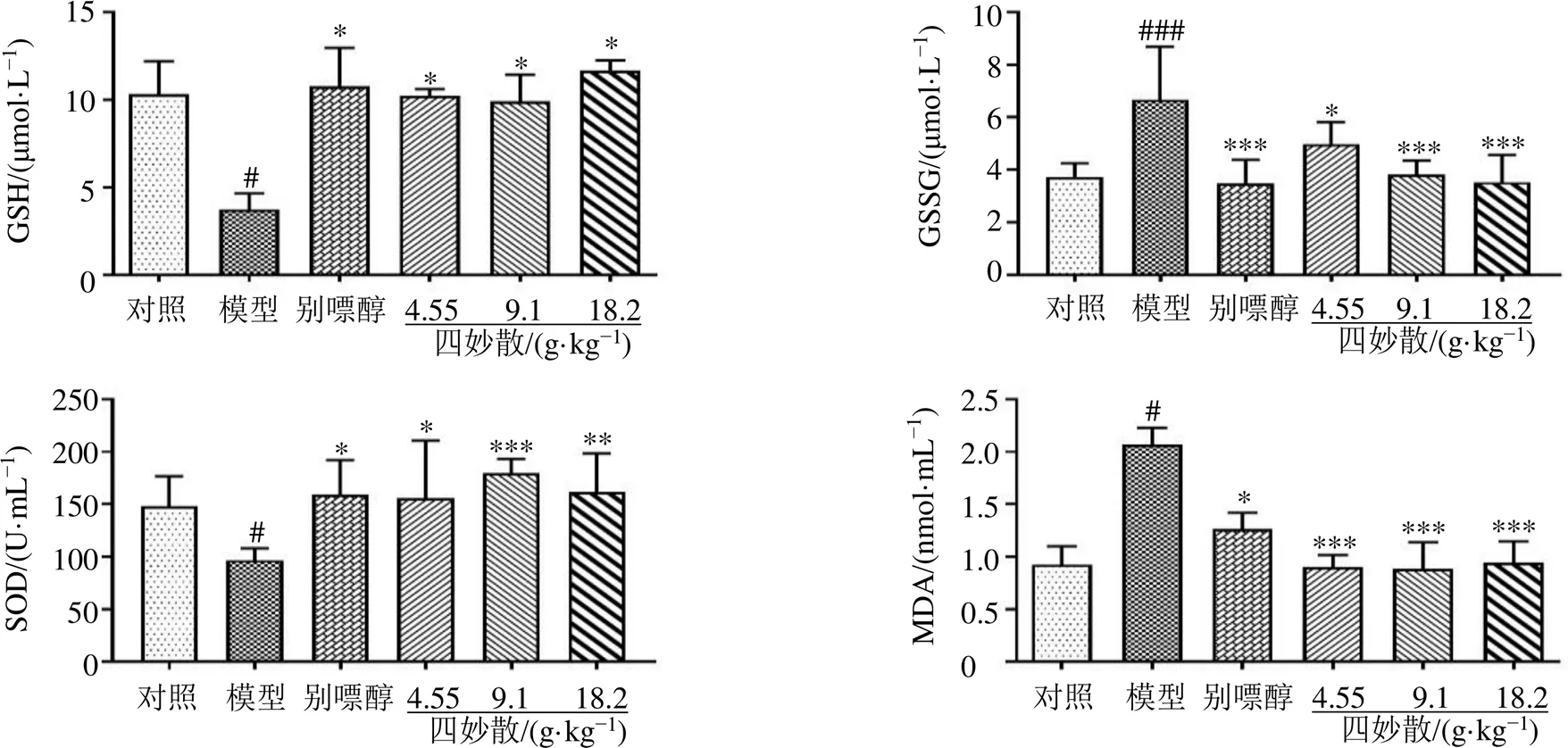
图3 四妙散对高尿酸小鼠血清中GSH、GSSG、MDA水平和SOD活力的影响(, n = 6)
3.4 四妙散对高尿酸血症小鼠肝脏XOD的影响
如图4所示,与对照组比较,模型组小鼠肝匀浆中XOD活力显著升高(<0.05);与模型组比较,各给药组肝匀浆中XOD活力显著降低(<0.05)。表明四妙散干预能降低高尿酸血症小鼠肝脏中XOD的活性,抑制尿酸的生成。
3.5 四妙散对高尿酸血症小鼠肾脏组织病理变化的影响
如图5所示,对照组小鼠的肾小球、间质和肾小管形态正常,细胞排列紧密。模型组小鼠肾组织内肾小球萎缩,肾小管扩张且扩张腔内可见肾小管上皮脱落,管型,肾小管空泡化,结构不清。与模型组比较,四妙散组小鼠肾组织损伤程度明显缓解,肾小管扩张和肾小球萎缩明显改善。以上结果表明四妙散对高尿酸诱发的肾脏损伤具有保护作用。

图4 四妙散对高尿酸血症小鼠肝匀浆中XOD活力的影响(, n = 6)
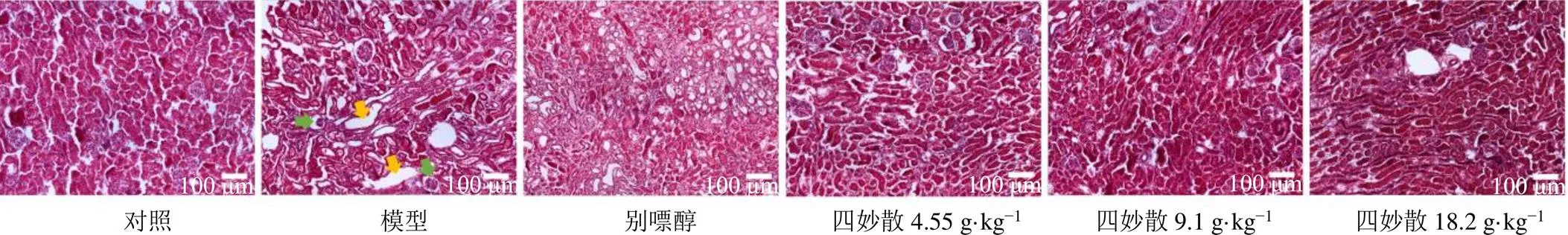
绿色箭头表示肾小球萎缩,黄色箭头表示肾小管扩张
3.6 四妙散对高尿酸血症小鼠肾脏中GSH含量的影响
如图6所示,与对照组比较,模型组小鼠肾脏中GSH水平显著降低(<0.01);与模型组比较,各给药组肾脏中GSH水平显著升高(<0.05、0.01),这表明四妙散能提高高尿酸血症小鼠肾组织的抗氧化能力。
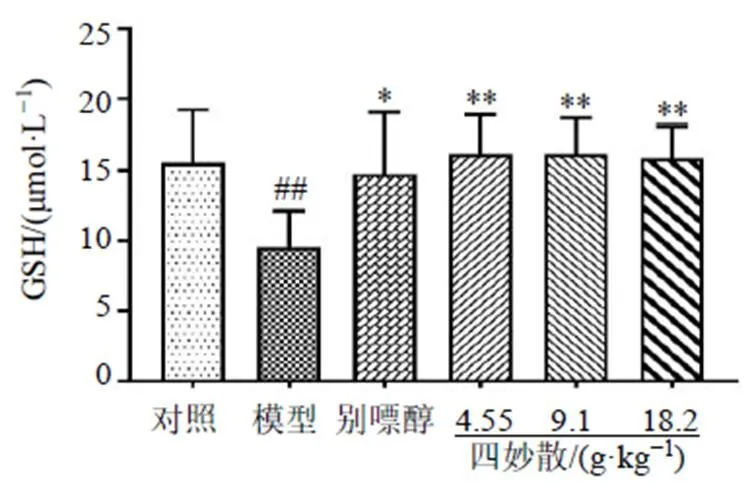
图6 四妙散对高尿酸血症小鼠肾脏中GSH含量的影响(, n = 6)
3.7 四妙散对高尿酸血症小鼠肾脏组织MFN1、MFN2、OPA1、DRP1和PGC-1α蛋白表达的影响
由于四妙散低剂量在改善尿酸代谢方面,与中、高剂量具有类似或者较好的效果,所以本实验仅研究四妙散低剂量改善肾损伤的可能作用机制。既往研究提示,MFN1、MFN2调控线粒体外膜的融合,OPA1调控线粒体内膜的融合,DRP1调控线粒体的分裂,PGC-1α调控线粒体的能量代谢、参与线粒体结构形成[22-23]。如图7所示,与对照组比较,模型组小鼠肾脏中MFN1、MFN2、OPA1、PGC-1α蛋白表达水平均显著降低(<0.05),DRP1蛋白表达水平显著升高(<0.05);与模型组比较,四妙散低剂量组肾脏中MFN1、MFN2、OPA1、PGC-1α蛋白表达水平明显升高(<0.05),DRP1蛋白表达水平显著降低(<0.05)。这表明四妙散可显著改善高尿酸血症小鼠肾脏的线粒体功能。

图7 四妙散对高尿酸血症小鼠肾脏组织中线粒体融合和分裂相关蛋白表达的影响(, n = 3)
4 讨论
本研究采用氧嗪酸钾和次黄嘌呤联合给药法建立急性高尿酸血症小鼠模型,结果发现高尿酸血症小鼠血清尿酸水平显著升高,尿液尿酸水平显著降低,肝脏XOD活性增强,血清GSH水平及SOD活力显著降低,GSSG、MDA水平显著升高;肾脏组织出现肾小管扩张、上皮脱落及肾小球萎缩等一系列病理变化,肾脏GSH含量显著降低,且线粒体MFN1、MFN2、OPA1、PGC-1α蛋白表达均显著降低,DRP1蛋白表达显著升高。而四妙散水提液能通过逆转上述指标的变化,改善高尿酸血症小鼠的尿酸代谢和肾组织损伤。
本研究发现,高尿酸血症小鼠血清尿酸水平较空白组显著升高,而四妙散干预后能明显降低高尿酸血症小鼠血清尿酸水平,这一结果与文献报道一致[24]。既往研究表明,机体内XOD可将次黄嘌呤氧化为黄嘌呤,并在将后者氧化为尿酸的过程中产生2个超氧自由基,而细胞外的超氧化物能够歧化为过氧化氢,细胞外超氧自由基和过氧化氢分别通过氯通道3和水通道穿透细胞膜,随后启动细胞内信号和氧化应激[25-26]。谷胱甘肽是细胞重要的抗氧化缓冲剂,主要以GSH和GSSG的形式存在,谷胱甘肽氧化与还原酶催化二者的互相转化,以维持细胞内谷胱甘肽的稳态和氧化还原平衡[27]。SOD和MDA也是检测氧化应激的标志物,前者清除对机体有害的超氧阴离子自由基,后者为自由基作用于脂质发生过氧化反应的终产物。本实验结果显示,四妙散能够升高高尿酸血症小鼠血清或肾组织中GSH水平及SOD活力,降低GSSG和MDA水平,这说明四妙散改善高尿酸血症小鼠体内尿酸代谢的作用可能与促进氧化还原平衡有关。此外,低、中、高剂量的四妙散降血尿酸、抗氧化及抑制尿酸形成作用无明显差异,低、中剂量的四妙散促尿酸排泄作用明显优于高剂量,缓解肝损伤作用与剂量呈相反趋势。
本研究和其他实验室研究均表明[28],四妙散能促进尿酸的排泄,从而改善尿酸代谢,且具有肾保护作用。肾脏线粒体动力学与其功能有着密切联系,线粒体动力学是指活细胞中的线粒体持续不断地相互融合连接形成网络状结构或分裂形成彼此分散存在的个体动态变化。线粒体融合是相邻线粒体先后融合外膜和内膜的过程,是修复受损线粒体的重要手段,参与该过程的膜蛋白主要是外膜MFN1/2和内膜OPA1[29]。线粒体分裂方式分为中区分裂和外周分裂,中区分裂主要与DRP1有关[30]。研究表明,MFN2缺乏会导致两个细胞器产生物理间隙,从而改变内质网形态并破坏这些细胞器之间的钙转移[31],进而影响线粒体结构与功能的完整性。另有研究表明,OPA1能维持紧密的嵴连接进而提高呼吸效率并支持呼吸链超复合物组装[32],且能降低器官对凋亡和氧化损伤的易感性[33],从而维持体内氧化还原平衡,减轻氧化应激对器官的损害。此外,尿酸能显著上调大鼠肾细胞中DRP1蛋白表达水平[34]。DRP1也参与过氧化物酶体分裂[29]。线粒体融合与分裂活动处于动态平衡中,当膜融合蛋白与分裂蛋白表达异常时,线粒体的自我修复能力减弱,其生物活性可能受到影响。本研究也发现高尿酸血症小鼠肾脏组织中线粒体MFN1、MFN2、OPA1、PGC-1α蛋白表达显著减少,DRP1蛋白表达显著增加,这说明线粒体的自我更新能力减弱和生物活性受损。四妙散可通过促进肾脏线粒体蛋白的表达,而发挥促进尿酸排泄和保护肾脏的作用。
本研究发现,四妙散能改善高尿酸症小鼠的氧化还原平衡。其他团队研究也发现,四妙散的主要药材黄柏的水提取物和醇提取物可清除次黄嘌呤-黄嘌呤氧化酶系统产生的超氧阴离子和Fenton反应生成的氧自由基[35],黄柏的主要成分小檗碱能减少过氧化氢诱导的巨噬细胞线粒体ROS的生成[36]。此外,小檗碱和黄柏酮能够调节线粒体的融合与分裂[37-38]。苍术内酯II能够提高骨关节炎大鼠血清中SOD活力和GSH水平,降低MDA水平,从而调节氧化应激[39]。牛膝的重要成分蜕皮甾酮可能通过减少氧化应激的产物,增强抗氧化酶的功能,调节线粒体的功能,从而保护H9c2细胞[40]。薏苡仁含有丰富的多酚类化合物,并被证明其总抗氧化能力与之有显著相关性[41]。这说明四妙散可能通过调节线粒体相关蛋白的表达以维持线粒体的功能,改善机体抗氧化应激的能力,从而改善高尿酸血症及其诱发的肾损伤。
综上,本研究表明四妙散能改善高尿酸血症小鼠的尿酸代谢,抑制肾脏损伤,其作用机制可能与抑制XOD活性,以及调节线粒体融合和分裂,进而增强机体抗氧化应激能力有关。本研究为四妙散治疗高尿酸血症的临床应用提供了一定的科学依据,同时也为其他降血尿酸药物的机制研究提供了策略。
利益冲突 所有作者均声明不存在利益冲突
[1] Su H Y, Yang C, Liang D,. Research advances in the mechanisms of hyperuricemia-induced renal injury [J]., 2020, 2020: 5817348.
[2] Zhang S S, Wang Y, Cheng J S,. Hyperuricemia and cardiovascular disease [J]., 2019, 25(6): 700-709.
[3] Song P G, Wang H, Xia W,. Prevalence and correlates of hyperuricemia in the middle-aged and older adults in China [J]., 2018, 8(1): 4314.
[4] Zhang M, Zhu X X, Wu J,. Prevalence of hyperuricemia among Chinese adults: Findings from two nationally representative cross-sectional surveys in 2015-16 and 2018-19 [J]., 2022, 12: 791983.
[5] 中华医学会内分泌学分会. 中国高尿酸血症与痛风诊疗指南 (2019) [J]. 中华内分泌代谢杂志, 2020, 36(1): 1-13.
[6] Furuhashi M. New insights into purine metabolism in metabolic diseases: Role of xanthine oxidoreductase activity [J]., 2020, 319(5): E827-E834.
[7] Bortolotti M, Polito L, Battelli M G,. Xanthine oxidoreductase: One enzyme for multiple physiological tasks [J]., 2021, 41: 101882.
[8] Zhang Y N, Yamamoto T, Hisatome I,. Uric acid induces oxidative stress and growth inhibition by activating adenosine monophosphate-activated protein kinase and extracellular signal-regulated kinase signal pathways in pancreatic β cells [J]., 2013, 375(1/2): 89-96.
[9] Roumeliotis S, Roumeliotis A, Dounousi E,. Dietary antioxidant supplements and uric acid in chronic kidney disease: A review [J]., 2019, 11(8): 1911.
[10] Stefanatos R, Sanz A. The role of mitochondrial ROS in the aging brain [J]., 2018, 592(5): 743-758.
[11] Yang Y H, Karakhanova S, Hartwig W,. Mitochondria and mitochondrial ROS in cancer: Novel targets for anticancer therapy [J]., 2016, 231(12): 2570-2581.
[12] Ježek J, Cooper K F, Strich R. Reactive oxygen species and mitochondrial dynamics: Theandof mitochondrial dysfunction and cancer progression [J]., 2018, 7(1): 13.
[13] Meyer J N, Leuthner T C, Luz A L. Mitochondrial fusion, fission, and mitochondrial toxicity [J]., 2017, 391: 42-53.
[14] Scarpulla R C. Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network [J]., 2011, 1813(7): 1269-1278.
[15] Hong Y A, Lim J H, Kim M Y,. Fenofibrate improves renal lipotoxicity through activation of AMPK-PGC-1α in db/db mice [J]., 2014, 9(5): e96147.
[16] Cristóbal-García M, García-Arroyo F E, Tapia E,. Renal oxidative stress induced by long-term hyperuricemia alters mitochondrial function and maintains systemic hypertension [J]., 2015, 2015: 535686.
[17] 林彤, 李丽, 梁彩君, 等. 四妙散治疗肾病综合征、痛风及湿疹的系统生物学研究 [J]. 中医药导报, 2020, 26(13): 124-128.
[18] Hua J, Huang P, Zhu C M,. Anti-hyperuricemic and nephroprotective effects of Modified Simiao Decoction in hyperuricemic mice [J]., 2012, 142(1): 248-252.
[19] Zhang D, Zhao M J, Li Y M,. Natural xanthine oxidase inhibitor 5--caffeoylshikimic acid ameliorates kidney injury caused by hyperuricemia in mice [J]., 2021, 26(23): 7307.
[20] 李雪芳, 次多. 青蒿素类药物的HPLC法测定研究 [J]. 西藏大学学报: 自然科学版, 2009, 24(1): 91-94.
[21] 中国药典 [S]. 一部. 2020: 1088.
[22] Pernas L, Scorrano L. Mito-morphosis: Mitochondrial fusion, fission, and cristae remodeling as key mediators of cellular function [J]., 2016, 78: 505-531.
[23] Audzeyenka I, Rachubik P, Typiak M,. Hyperglycemia alters mitochondrial respiration efficiency and mitophagy in human podocytes [J]., 2021, 407(1): 112758.
[24] 张志明, 高碧珍, 齐张, 等. 基于肠道上皮细胞相关转运子探讨四妙散对高尿酸血症小鼠的祛湿机制 [J]. 风湿病与关节炎, 2020, 9(1): 1-4.
[25] Sharaf El Din U A A, Salem M M, Abdulazim D O. Uric acid in the pathogenesis of metabolic, renal, and cardiovascular diseases: A review [J]., 2017, 8(5): 537-548.
[26] Fisher A B. Redox signaling across cell membranes [J]., 2009, 11(6): 1349-1356.
[27] Lv H H, Zhen C X, Liu J Y,. Unraveling the potential role of glutathione in multiple forms of cell death in cancer therapy [J]., 2019, 2019: 3150145.
[28] Hu Q H, Jiao R Q, Wang X,. Simiao pill ameliorates urate underexcretion and renal dysfunction in hyperuricemic mice [J]., 2010, 128(3): 685-692.
[29] Yapa N M B, Lisnyak V, Reljic B,. Mitochondrial dynamics in health and disease [J]., 2021, 595(8): 1184-1204.
[30] Kleele T, Rey T, Winter J,. Distinct fission signatures predict mitochondrial degradation or biogenesis [J]., 2021, 593(7859): 435-439.
[31] Naon D, Zaninello M, Giacomello M,. Critical reappraisal confirms that Mitofusin 2 is an endoplasmic reticulum-mitochondria tether [J]., 2016, 113(40): 11249-11254.
[32] Cogliati S, Frezza C, Soriano M E,. Mitochondrial cristae shape determines respiratory chain super complexes assembly and respiratory efficiency [J]., 2013, 155(1): 160-171.
[33] Varanita T, Soriano M E, Romanello V,. The OPA1-dependent mitochondrial cristae remodeling pathway controls atrophic, apoptotic, and ischemic tissue damage [J]., 2015, 21(6): 834-844.
[34] 封宝红, 伍军, 张艳霞, 等. 尿酸对大鼠肾细胞线粒体损伤及Pgam5/Drp1表达的影响 [J]. 中国病理生理杂志, 2020, 36(6): 1110-1114.
[35] 孔令东, 杨澄, 仇熙, 等. 黄柏炮制品清除氧自由基和抗脂质过氧化作用 [J]. 中国中药杂志, 2001, 26(4): 245-248.
[36] 苏日娜, 刘天怡, 马璐瑶, 等. 小檗碱通过mtROS- NLRP3通路抑制H2O2诱导的巨噬细胞焦亡 [J]. 中国免疫学杂志, 2022, 38(9): 1064-1068.
[37] 谢海纳, 潘志强. 黄柏酮通过影响线粒体功能抑制肾上腺皮质瘤细胞皮质酮合成的研究 [J]. 南京中医药大学学报, 2021, 37(2): 251-257.
[38] 黄泽禹, 陈娟, 陈清杰. 小檗碱调控线粒体功能改善2型糖尿病引起的肝脏脂质代谢紊乱 [J]. 华中科技大学学报: 医学版, 2019, 48(1): 53-57.
[39] 杨光, 惠越, 陈奎, 等. 苍术内酯II对骨关节炎大鼠软骨损伤、血清炎症因子和氧化应激的调节作用及机制研究 [J]. 中医学报, 2021, 36(3): 601-607.
[40] 苏华, 谢睿彬, 罗高湖, 等. 蜕皮甾酮减轻心肌细胞氧化应激损伤 [J]. 中国病理生理杂志, 2016, 32(12): 2222-2227.
[41] Wang L, Chen J, Xie H,. Phytochemical profiles and antioxidant activity of adlay varieties [J]., 2013, 61(21): 5103-5113.
Effects of Simiao San on alleviation of hyperuricemia and renal injury and regulation of renal mitochondria related proteins
WANG Shan1, ZHANG Yue-yi1, LIU Tian-yuan1, LU Mei-xi1, DAI Xuan1, LIU Ya-ge1, ZHANG Yan-fei2, WANG Li-li3, ZHANG Dong-wei1
1. Diabetes Research Center, School of Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 102488, China 2. Department of Anatomy, School of Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 102488, China 3. Department of Pharmacology of Traditional Chinese Medicine, School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China
To explore the effect and possible mechanism of Simiao San (四妙散) on improving uric acid metabolism and kidney damage in hyperuricemia mice.The acute hyperuricemia mouse model was established with oteracil potassium (300 mg/kg) and hypoxanthine (500 mg/kg), and then the water extract of Simiao San (4.55, 9.1, 18.2 g/kg) was given for 7 d. The content of uric acid (UA) in serum and urine, the activities of superoxide dismutase (SOD) and contents of oxidized glutathione (GSSG), malondialdehyde (MDA) in serum, and reduced glutathione (GSH) level in kidney, and activity of xanthine oxidase (XOD) in liver were measured by biochemical method. Western blotting was used to detect the expressions of fusion and division related proteins in kidney mitochondria. The pathological changes of kidney was observed by HE staining.Simiao San significantly reduced UA content in serum of hyperuricemia mice (< 0.05, 0.01), significantly increased UA content in urine (< 0.05, 0.001), significantly increased SOD activity in serum and GSH level in kidney (< 0.05, 0.01, 0.001), significantly reduced GSSG and MDA levels in serum (< 0.05, 0.001), and significantly reduced XOD activity in liver (< 0.05). At the same time, Simiao San significantly increased renal mitofusin protein 1 (MFN1), MFN2, optic atrophy 1 (OPA1) and peroxisome proliferator-activated receptor gamma coactivator-1α (PGC-1α) protein expressions (< 0.05), reduced dynamin-related protein 1 (DRP1) protein expression (< 0.05), thereby inhibiting the pathological changes of the kidney.Simiao San can enhance ability of body to resist oxidative stress by regulating the expression of mitochondrial related proteins, thereby improving uric acid metabolism and inhibiting kidney damage.
Simiao San; hyperuricemia; renal injury; oxidative stress; mitochondrion
R285.5
A
0253 - 2670(2023)13 - 4177 - 09
10.7501/j.issn.0253-2670.2023.13.011
2022-12-15
国家自然科学基金资助项目(81874373);国家自然科学基金资助项目(82074235)
王 钐,女,硕士研究生,研究方向为中药改善慢性代谢性疾病的作用机制。E-mail: ws1225751257@163.com
通信作者:王丽丽,讲师,研究方向为中药抗心血管和代谢性疾病。E-mail: liliw0108@163.com
张东伟,博士生导师,研究方向为内分泌代谢性疾病的发病机制和中药防治作用。E-mail: zhdw1006@163.com
[责任编辑 李亚楠]

