2例孕晚期胎儿重度胸腔积液临床分析
倪萍,黄利辉,蔡敏,黄乐,李寒梅
作者单位:410007 湖南 长沙,湖南师范大学附属长沙市妇幼保健院产科
胎儿胸腔积液(fetal hydrothorax,FHT) 是一种先天性疾病,指在胎儿胸膜腔隙内非特异性液体的异常聚集,其发病率为1 /10 000~1/15 000[1],可发生于单侧或双侧胸腔,根据其病因分为原发性和继发性[2],继发性胸腔积液又包括免疫性及非免疫性[3]。本文回顾性分析了在湖南师范大学附属长沙市妇幼保健院住院治疗的2例孕晚期胎儿重度胸腔积液,以期提高产科医生对该疾病的认识及诊疗水平。
1 临床资料
2021年7~8月,我院产科收治了2例孕晚期胎儿重度胸腔积液的孕妇,孕期均规律产检,孕早期产前筛查均未见异常,父母双方非近亲婚配,表型无异常。
1.1 病例1
孕妇24岁,G2P1,因孕37+4周,彩超提示胎儿胸腔积液1 d入院,末次月经:2020-11-6,孕早期彩超提示胎儿大小符合相应孕周。预产期:2021-8-13,中期产前筛查低风险,系统彩超、糖耐量检查及地中海贫血筛查均正常。7-26,当地县妇幼保健院彩超提示,胎儿大量胸腔积液。为求进一步治疗,次日转入我院,复查B超:胎儿右侧胸腔内探及大片液暗区,范围约86 mm×45 mm×67 mm,纵隔、心脏明显向左侧移位,肺脏受压(下页图1)。行多学科会诊后,拟行B超引导下胎儿胸腔穿刺抽吸积液,同时行产前诊断。但孕妇自觉胎动减少,复查胎心监护提示胎心减速,考虑胎儿窘迫,遂于7-28急诊行剖宫产术。术中羊水800 mL,娩出新生儿外观无畸形,重3 600 g,阿氏评分1~8分(肤色扣2分),5~9分(肤色扣1分)。
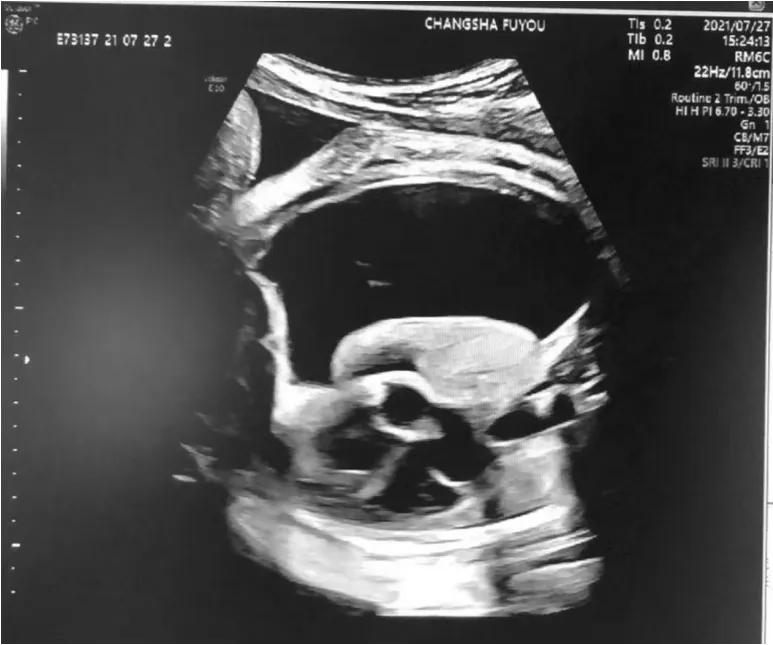
图1 病例1右侧胸腔积液
1.2 病例2
孕妇23岁,G1P0,因孕34+周,发现胎儿大量胸腔积液4 d入院。末次月经:2020-12-1,预产期:2021-9-7。2021-1-13因TSH 4.52 mIU/L,诊断“妊娠合并亚临床甲减”,口服左旋甲状腺素片25 ug/d治疗。2021-3-14孕14周5天B超检查提示NF 5.3 mm,4-2孕17周复查B超提示NF 6.0 mm,行羊水穿刺产前诊断未见明显异常。系统彩超未见明显异常,糖耐量正常。轻型α 地中海贫血患者(丈夫地中海贫血筛查正常)。7-29孕34周复查彩超提示,胎儿双侧胸腔探及大范围游离暗区,右侧范围约69 mm×30 mm,左侧范围约49 mm×32 mm;双肺受压,左肺大小约38 mm×19 mm,右肺大小约42 mm×15 mm;心脏稍向左侧移位,颈后皮肤较厚处约21 mm,羊水最大暗区:81 mm;羊水指数:244 mm,建议终止妊娠,孕妇及家属拒绝。8月2日自觉胎动减少,再次就诊我院。收入院后行多学科会诊,告知孕妇及家属胎儿大量胸腔积液(下页图2),胎心监护异常,建议终止妊娠,考虑到不能排除胎儿畸形可能,给予引产的方案选择。孕妇及家属强烈要求抢救胎儿,要求剖宫产,在医院律师见证下行高风险谈话后于8月3日行剖宫产术。术中见羊水清亮,量约2 300 mL,新生儿水肿,体重3 250g,1 min Apgar评分4分(心率、呼吸、肌张力、反射各1分),5 min 6分(心率2分,呼吸、肌张力、反射、肤色各1分),10 min 8分:肌张力、反射各扣1分),15 min评9分(反射扣1分)。

图2 病例2双侧胸腔积液
1.3 新生儿治疗过程
患儿均转入新生儿科,入院后告病危、重症监护,予气管插管呼吸机辅助通气,间断行胸腔穿刺引流胸水。胸水常规(禁食下):色黄、透明、比重:1.015、不凝固、李凡他试验阴性,乳糜定性实验阳性,诊断明确:乳糜胸。完善细小病毒B19 IgG抗体,胸水解脲脲原体及痰解脲脲原体DNA定量,抗结核抗体IgG:阴性(-),TORCH-IgM定量检测均阴性。患儿胸水反复生成,予禁食,同时给予奥曲肽治疗(最大剂量至10 ug/kg·h),患儿胸腹水生成逐渐减少,予MCT(中链甘油三酯)配方奶粉喂养,逐渐加量,根据患儿情况停气管插管改无创呼吸机辅助通气,再改空氧给氧,逐渐停吸氧,停奥曲肽治疗。间断输注人血白蛋白以纠正其低蛋白血症,补充人免疫球蛋白,予输注红细胞纠正贫血,先后予头孢噻肟联合氨苄西林,哌拉西林他唑巴坦抗感染;余予静脉营养、镇痛镇静等对症支持处理。复查胸廓对称,气管居中;两肺野未见明显新发病灶,心影未见明显异常,双膈面光滑。患儿住院期间行染色体检查均无明显异常。新生儿胸腔穿刺抽出液见图3,病例情况详见表1。
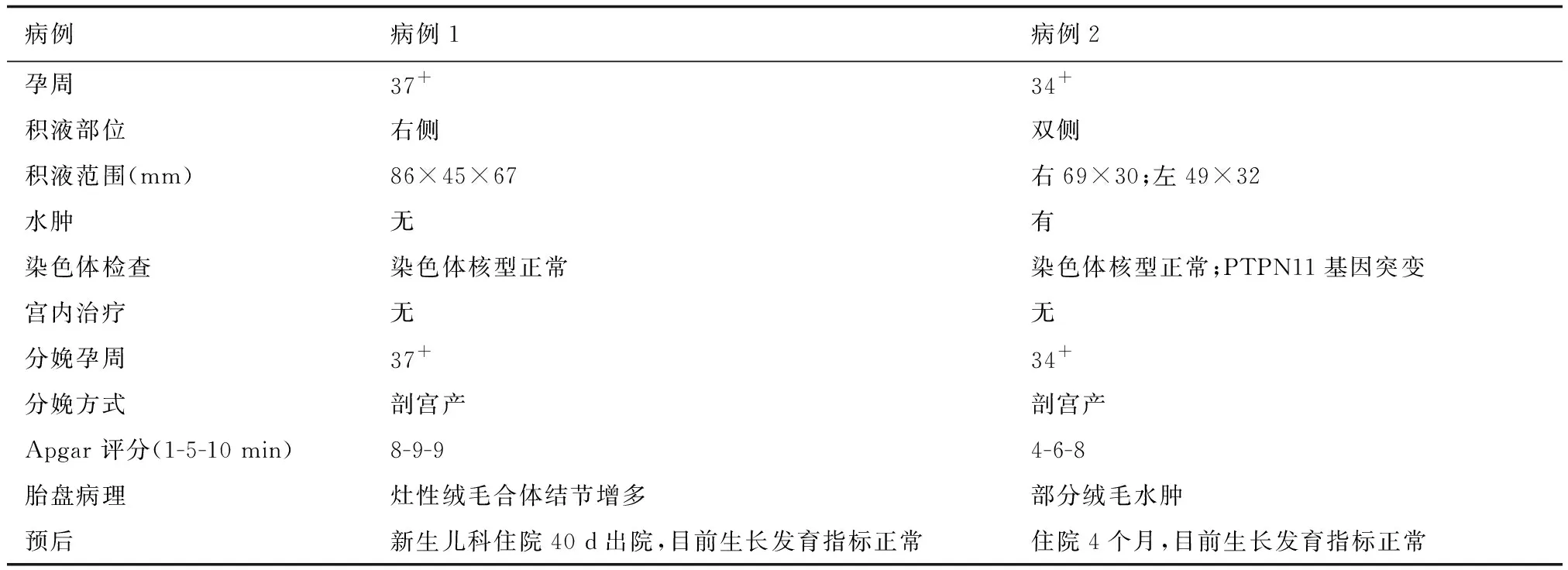
表1 病例一般情况

图3 胸腔穿刺抽出积液

图4 病例2基因二代测序报告
1.4 产后随访1年
病例1患儿于新生儿科住院40 d出院,出院时体重4.03 kg,各项指标均基本正常,奶量正常。病例2在新生儿科住院4个月出院,住院期间给予每顿40 mL MCT配方奶,一日约12顿,因患儿吸吮能力稍差,治疗3个月后患儿家属要求行外显子基因检测,二代测序发现PTPN11基因突变,为努南综合征1型患者,与先证者表型相符(图5,见彩插1),目前两个患儿定期儿童保健科检查,各项生长发育指标均基本正常。

2 讨论
2.1 胸腔积液病因
2例病例均在孕晚期出现大量胎儿胸腔积液,其病因复杂,包括原发性及继发性。原发性胸腔积液因胎儿淋巴管形成障碍或者管壁完整性受到破损使得淋巴管液渗入胸膜腔所致,可能原因如下:① 先天的胸导管发育不良,淋巴管道形成以及再吸收的过程发生异常,因此胎儿出现乳糜胸[4];② 先天所致胸淋巴管的发育异常以及淋巴管瘘[5];③ 先天所致肺部淋巴管异常扩张引起淋巴液潴留而导致胎儿胸腔积液[6];④ 隔离肺[7]。
继发的胎儿胸腔积液原因如下[5]:① 免疫性病因。由于母儿Rh血型或者ABO血型不合;② 胎儿染色体发育异常以及遗传代谢性疾病和综合征,包括21-三体、18-三体、13-三体、Turner 综合征等;③ 胎儿心血管结构异常;④ 胎儿血液系统疾病包括胎-母输血综合征、重型α-地中海贫血、遗传性球红细胞增多等;⑤ 胎儿宫内感染TORCH病毒、人细小病毒B19以及孕妇感染寨卡病毒等。
2.2 诊断
① 首选超声多普勒检查。依胸腔积液量的多少分成轻、中、重度。轻度仅是胸腔内少量液体包绕肺叶;中度积液小于50%胸腔内体积;重度积液大于50%胸腔体积[8]。
② 排查母体因素:原发性胸腔积液为排除性诊断,当超声多普勒发现胎儿胸腔积液时,需尽快查明病因。首先对母体的感染性及免疫性指标进行检测,如人细小病毒B19、TORCH、甲状腺功能、夫妻双方的地中海贫血筛查及血型的检查等。也可通过母体的外周血进行无创性胎儿染色体非整倍体检测,排查胎儿染色体疾病。
③ 有创性产前诊断:包括羊水穿刺或脐血穿刺进行胎儿遗传学检测分析。常用的是染色体核型分析局限于染色体数目异常的检测,以及大于5~10 Mb的染色体结构异常的检测。近年来,染色体微阵列分析(chromosomal microarray analysis,CMA)技术、基因组拷贝数变异测序(copy number variation sequencing,CNV-seq)及外显子测序均可运用于胎儿胸腔积液病因学检查[9-10]。
本文2例均是重度胸腔积液患儿,出生后完善一系列检查,排除了心血管、肺部的器质性病变,母儿血型不合,各项病毒感染的检测及细菌培养均阴性。甲状腺功能正常。诊断为原发性乳糜胸,可能由于淋巴管的异常导致淋巴液潴留所致。孤立乳糜胸患儿出生后需要立即进行复苏,给予呼吸支持,持续进行胸腔积液引流,同时进行营养支持治疗,一般预后较好。病例1出生后行染色体检查核型为46,XYqh+,已经康复出院,仍需定期随访患儿各个系统发育情况;病例2孕期行羊水穿刺产前诊断未见明显异常,出生后住院治疗3个月,呼吸情况明显好转,因吮吸欠佳,吞咽困难,行外显子基因检测,二代测序发现PTPN11基因突变,考虑为努南综合征1型患者。
2.3 治疗
2.3.1 期待治疗 原发性胎儿胸腔积液部分可自行消退,因此对于仅有轻度及中度的胸腔积液而不伴有水肿的胎儿可采取观察措施,通过超声严密监测胎儿胸腔积液及血流动力学变化。有学者报道,约有73%的原发性胎儿胸腔积液能自行吸收、消退[11]。
2.3.2 胎儿胸腔穿刺抽液术 重度胎儿胸腔积液孕妇如未合并胎儿水肿,可考虑在超声引导下行胎儿胸腔穿刺术,抽出积液,并同时行产前诊断,缓解胸腔压力,促进胎肺成熟。但对穿刺后积液又迅速增加的患者,需要反复多次抽液,会增加感染、早产、低蛋白血症等风险,反而加重病情。因此,对分娩前实施胎儿胸腔穿刺放液意见不统一,有研究者认为如果短期内终止妊娠,采取胸腔穿刺抽液可起到缓解胎儿心肺受压的作用[12]。
2.3.3 胎儿胸腔-羊膜腔分流术(treated with thoracoam- niotic shunting,TAS) 胎儿胸腔积液将通过分流管引流至羊膜腔,使胎儿胸腔积液量减少,减轻心肺压迫,有利于胎儿肺复张。该技术国外经验较丰富,Matsui M等[13]对胎儿胸腔积液患者实施TAS后,患儿的存活率有所提高。但该项操作复杂,同样也存在出血、感染、胎膜早破、分流管异位或阻塞等情况。本文2例均于孕晚期突然出现大量胸腔积液,均因胎心异常而未行宫内治疗。
2.4 终止妊娠时机及方式
如轻度胸腔积液患者病情稳定,或者经宫内治疗后积液消退,可在严密监护下延长孕周至足月;如经宫内治疗后积液迅速再次增多,出现胎儿窘迫等,则需终止妊娠。终止妊娠方式取决于胎儿宫内情况及其家庭对胎儿的期待值。考虑到重度胸腔积液胎儿经阴道分娩过程中可能出现由于产道产力的挤压对胎儿心肺压迫加重,导致胎儿窘迫,同时由于胎儿胸腔积液胸廓径线明显增大,肩难产及软产道裂伤风险增加,可予放宽剖宫产手术指征。如不能排除胎儿基因病及遗传代谢性疾病等,与孕妇及家属充分交代胎儿娩出后治疗效果差、后遗症多等风险,可将引产这一优生选择提给孕妇及家属。
本文病例1孕足月,系经产妇,拟行胸腔穿刺引流后催引产,但是突发胎心减速而行急诊剖宫产;病例2由于孕早期开始一直存在NF增厚,孕晚期彩超提示胎儿水肿,不排除胎儿发育异常可能,考虑孕妇系年轻女性,从优生优育角度出发可考虑引产,但孕妇及家属坚持要求生育并积极救治胎儿,遂在医院律师见证下进行高风险谈话,充分告知胎儿风险及预后不良可能,行急诊剖宫产娩出一活女婴,于新生儿科住院4个月,住院期间行外显子测序发现PTPN11基因突变,结合胎儿宫内早期发育即提示存在NF增厚,孕晚期出现胸腔积液以及产后吸吮吞咽困难为主要症状,证实患儿为努南综合征1型患者。努南综合征特点有多种表型特征,包括生长迟缓等[14],有报道脑畸形,包括出生后外部脑积水患儿携带 PTPN11突变基因[15]。由于发育迟缓,Noonan 综合征患者需要接受重组人生长激素(rhGH)治疗,对家庭带来负担,对患儿造成较大影响。该患儿一直追踪随访至出生后1年,定期在我院儿童保健科体检及进行康复训练,目前生长发育指标尚可,体重偏轻,暂未出现心脏及神经系统等发育异常情况,目前仍在持续随访中,并将一直随访,为胎儿胸腔积液病例提供相关数据及资料。
胎儿胸腔积液为一类发病率低但较严重的疾病,病因复杂,预后不良。超声检查是最主要的诊断依据。当发现胎儿胸腔积液时,要积极寻找病因,完善检查,排查胎儿染色体病、基因病及遗传代谢性疾病。采取合适的宫内干预措施改善母胎预后,整个过程都需要与孕妇及家属充分沟通病情及风险,依据家属的意愿及胎儿情况选择最合适的终止妊娠时机及方式。强调多学科合作,产前会诊,最大程度地降低母儿风险,达到优生优育的目的。

