matK序列在绞股蓝及其混伪品中的应用
徐林 赵芳 杨贵清 尹鑫 徐其碧 赵月梅


摘要 用matK序列作为DNA条形码来区分绞股蓝及其混伪品雪胆、锥形果、棒槌瓜、乌蔹梅和崖爬藤。通过PCR扩增测序和在GenBank中下载的方式共获得16条matK序列,经比对后,用MEGA 6.0计算种间的K2P距离并基于该距离建立了系统发育邻接树(NJ),并计算了“barcode gap”。结果显示,绞股蓝与其混伪品雪胆、锥形果、棒槌瓜、乌蔹梅、崖爬藤种内种间遗传距离区分明显,可形成一个“gap”,系统发育树中6个物种中分成了两大支,葫芦科物种绞股蓝、雪胆、锥形果和棒槌瓜聚成了一支,葡萄科物种乌蔹梅和崖爬藤聚成了另一支,绞股蓝样品聚为单系并能够与其混淆品明显区分开。表明matK序列可作为区分绞股蓝和其常见混伪品的参考DNA条形码。
关键词 matK;绞股蓝;伪品;DNA条形码
中图分类号 R282.5 文献标识码 A
文章编号 1007-7731(2023)07-0022-04
绞股蓝,又名五叶参、七叶胆、公罗锅底、遍地生根等,为葫芦科绞股蓝属的多年生草质藤本植物[1]。全草入药,具有补气养阴、清肺化痰、养心安神之功效,又名“南方人参”。
绞股蓝疗效显著,市场前景广阔,引发了科研和开发热潮[2]。由于多种植物在形态上与绞股蓝极为相似,不容易分辨,导致绞股蓝临床药材来源复杂,严重影响了临床用药的安全性和加工产品的质量。如同科植物雪胆,不仅与绞股蓝形态相似,分布区域与生长环境也非常相近,野外采集时尤其在营养生长期,易将其与绞股蓝混淆[3-4];棒槌瓜、锥形果是绞股蓝药材在葫芦科中常见的混淆品[5];此外,葡萄科植物乌蔹莓、崖爬藤营养器官的形态也与绞股蓝也极其相似,将乌蔹莓误作绞股蓝采集的现象时有发生[6]。
DNA条形码技术由Hebert等[7]于2003年正式提出,是指利用一个或少数几个标准的DNA片段快速、准确识别和鉴定植物物种的技术[8]。该技术以其通用性强,稳定性和重复性高,操作流程标准等特点而备受关注。matK序列是植物叶绿体trnK基因的内含子中的一个开放阅读框,功能与RNA转录体中Ⅱ型内含子的剪切有关,进化速率较快,PCR扩增和测序的成功率均较高,在科、属级水平能提供较多的进化和系统发育信息[9]。该序列被认为是植物DNA条形码的有效候选片段之一,广泛应用于中药的真伪鉴别、系统发育的探讨和亲缘关系的研究[10-13]。
绞股蓝与其混伪品的鉴定研究多见于植物原形态及其粉末鉴别等传统中药鉴定方法[14-19],分子生物学水平上的鉴定研究较少[5],而基于matK序列的研究尚未见报道。为此,本研究拟应用matK序列对绞股蓝及其混淆品进行鉴定,为准确、简便地鉴定绞股蓝及其常见混淆品提供重要的分子依据。
1 材料与方法
1.1 材料来源
绞股蓝原植物分别采自贵阳、广西,其余部分植物的matK序列从GenBank下载。经比对剪切后共16条序列。具体信息见表1。
1.2 DNA提取、PCR扩增及序列测定
绞股蓝叶片样品采自贵州贵阳和广西崇左,在野外采集后,将叶片放入变色硅胶中快速干燥。总DNA提取采用天根公司植物DNA提取试剂盒(Tiangen Biotech Co.,China)。PCR扩增引物参考[10]研究中引物序列信息。扩增反应采用25 μL的反应体系:包括15~40 ng的模板DNA,2.5 μL 10×buffer,0.5单位的Taq DNA聚合酶(5U·μL-1),2 μL的MgCl2(25 mol·L-1),2 μL的dNTPs(10 mmol·L-1),正反向引物各2.5 μL(5 μmol·L-1),再添加蒸馏水至25 μL。PCR扩增程序为96 ℃预变性3 min,95 ℃变性1 min,52 ℃退火1 min,72 ℃延伸1 min,32个循环后,72 ℃延伸10 min。取5 μL PCR扩增产物,以0.5×TBE为电泳缓冲液进行凝胶电泳检测,检测合格的PCR扩增产物经纯化后,送至广州华大生物科技有限公司进行测序。
1.3 数据分析
将所有DNA序列(实验所得+下载)用BioEdit[20]软件进行序列查看并对比,比对后删除前后两端多余的序列。用MEGA 6.0[21]计算种间和种内的遗传距离,并基于KIMURA 2-PARAMETER双参数模型用邻接法(neighbor-joining method,NJ)构建系统发育树以便直观鉴定各物种,同时以KIMURA 2-PARAMETER模型做1 000次可信度分析。合格的DNA条形码还有一个衡量标准是“barcode gap”,即序列的种间变异要足够大,而种内变异要足够小,从而在中间形成一个明显的间隔区。
2 结果与分析
2.1 种间序列比对分析
将16条绞股蓝及其伪品的matK序列经过比对后总长度为735 bp。碱基T、C、A、G的平均含量分别为37.80%、16.60%、28.80%、16.90%。绞股蓝与其他伪品之间的变异较大,存在变异位点有173个,占总位点的23.5%。而绞股蓝和其他伪品的种内变异较少:绞股蓝的3条序列中分别在147、153、242、313、461、664、675和678 bp位置存在8个位点的变异;乌蔹梅的2条序列中在402、520、596和663 bp共4个位点存在变异,其余序列均无种内变异存在。
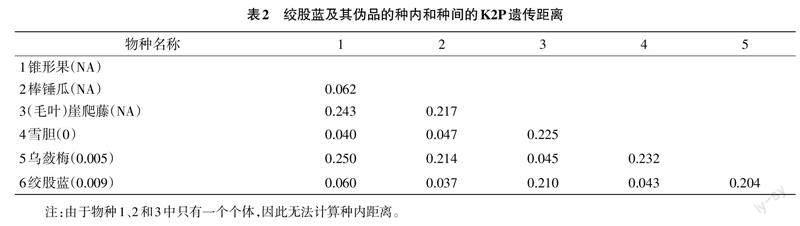
2.2 绞股蓝及其伪品的K2P遗传距离分析
matK序列在絞股蓝及其伪品中的遗传距离分布见表2,其中括号内表示的是种内距离。种内距离中:锥形果、棒槌瓜和崖爬藤只有1条序列,无法计算种内距离;雪胆的8条序列中相似度高,种内距离为0;乌蔹梅的种内距离为0.005;绞股蓝为0.009。种间距离最大的是锥形果和乌蔹梅之间,为0.250;最小的是棒槌瓜和绞股蓝之间,为0.037。
由种内种间分布的距离柱形图(图1)可以看出:二者在分布频率上无重叠,种内距离集中在1%以内,种间距离多集中在3%之后,表明matK序列在这几个物种中的距离分布合适,种内距离和种间距离区分明显。
2.3 聚类分析
以邻接法构建的绞股蓝及其伪品的共16条matK序列的系统发育树表明(图2):这16个样品分为2大支,其中来自葡萄科的乌蔹梅和崖爬藤聚成了一支,来自葫芦科的绞股蓝、锥形果、棒槌瓜、雪胆4个样品聚成了一支,其中后3个物种(锥形果、棒槌瓜和雪胆)亲缘关系较近,聚在了一起后又与绞股蓝的3个样品形成一个分支。每個物种均能鉴定到种且支持率较高,能直观地反映出绞股蓝与伪品的matK基因序列差异。表明matK基因能有效地将绞股蓝及其常见伪品鉴别开来。
3 讨论
本文分析了绞股蓝及其常见伪品锥形果、棒槌瓜、乌蔹梅、崖爬藤、雪胆共6种植物的matK序列,包括序列特征、K2P距离及系统进化树。结果表明,就试验方法而言,该序列在绞股蓝中的PCR扩增表现良好,反应条件的筛选及通用引物的使用均很顺利,扩增效率和测序效率均很高。其余样品的matK序列为下载数据,在此不做评价。就变异位点而言,笔者在735 bp序列中共发现173个差异位点,变异位点较多,这主要是由以下2个部分造成的,一是由于matK序列本身进化较快,能够提供丰富的变异信息;二是由于绞股蓝的伪品乌蔹梅、崖爬藤在亲缘关系上与绞股蓝的距离较远,绞股蓝分类上属于葫芦科,而乌蔹梅和崖爬藤属于葡萄科。这些遗传差异在种间距离和系统进化树方面表现均很明显,同为葡萄科的乌蔹梅和崖爬藤之间的遗传距离最小,亲缘关系最近,同理,绞股蓝、锥形果、雪胆和棒槌瓜之间的遗传距离亲缘关系也较近。综上所述,matK序列可以有效地鉴别绞股蓝及其伪品锥形果、棒槌瓜、乌蔹梅、崖爬藤和雪胆,具有一定的应用价值。
4 参考文献
[1] 中国植物志编辑委员会.《中国植物志》(73卷第一分册)[M].北京:科学出版社,1986.
[2] 刘世彪,胡正海.绞股蓝生物学的研究进展[J].中草药,2005,36(1):144-146.
[3] 饶军.绞股蓝与混淆种雪胆的鉴别研究[J].中草药,1993,24(2):109.
[4] 刘世彪,张代贵,胡正海.绞股蓝与易混淆品雪胆的鉴别[J].中国民族民间医药杂志,2007,84:46-49.
[5] 刘镛,唐银琳,吴铁,等.基于DNA条形码(ITS2)的绞股蓝与其混伪品的分子鉴定方法分析[J].中外医疗,2012,31(29):105-106.
[6] 王太霞,李金亭,李景原,等.绞股蓝与乌蔹莓药用部分的显微鉴别[J].中草药,2003,34(5):465-467.
[7] HEBERT PDN,CYWINSKA A,BALL S L,et al. Biological identifications through DNA barcodes[J].Proceedings of the Royal Society of London Series B:Biological Sciences,2003,270:313-321.
[8] KRESS W J,WURDACK K J,ZIMMER E A,et al. Use of DNA barcodes to identify flowering plants[J].Proceedings of the National Academy of Sciences,2005,102(23):8369-8374.
[9] 郑红建,张安世.苔藓植物matK基因PCR反应体系的建立和优化[J].安徽农业科学,2012,40(4):1961-1962,2069.
[10] 赵月梅,陈硕.基于matK序列对白头翁及其伪品的鉴别[J].陕西农业科学,2017,63(1):51-54.
[11] 张晓芹,刘春生,闫兴丽,等.多基原药材大黄叶绿体matK基因序列分析及鉴定研究[J].药学学报,2013,48(11):1722-1728.
[12] 黄琼林,梁凌玲,何瑞,等.应用matK基因鉴别青天葵及其常见混伪品[J].广西植物,2014,34(3):299-303.
[13] 黄琼林,马新业,詹若挺,等.鸡血藤及其混伪品matK基因分析和分子鉴定[J].北方园艺,2015(17):94-98.
[14] 李雄英,罗育,吴耀生,等.RAPD技术在药用植物绞股蓝鉴别中的初步研究[J].植物科学学报,2008,26(3):251-254.
[15] 黄明远,余明志,吴光第.峨眉山三种绞股蓝及其混杂品的比较鉴别[J].乐山师范学院学报,1999(3):32-34.
[16] 杨静,赵建邦.绞股蓝混淆品的生药学鉴别[J].中兽医医药杂志,1996(6):41-42.
[17] 程存归,李冰岚.绞股蓝及其伪品乌蔹莓的FTIR法直接鉴定研究[J].四川中医,2003,21(1):25-26.
[18] 王翀,张媛媛,杨娟,等.绞股蓝属植物及其混淆品乌蔹莓的PCR-RFLP鉴别研究[J].中国中药杂志,2008,33(19):2167-2170.
[19] 王晓鹏.绞股蓝与乌蔹莓植物鉴别[J].安徽科技学院学报,2001,15(2):29-30.
[20] HALL T A. Bioedit:A user-friendly biological sequence alignment editor and analysis program for Windows 95/98 NT[J].Nucl Acids Sympo Series,1999(41):95-98.
[21] TAMURA K,STECHER G,PETERSOn D,et al. MEGA6:molecular evolutionary genetics analysis version 6.0[J].Mol Biol Evol.,2013,30(12):2725-2729.
(责编:张宏民)

