舌鳞状细胞癌中DKK1的表达及分子机制
孙 玥,王宏浩,李听雨,杨敏根,黄汉潇,后 军
头颈部肿瘤占常见恶性肿瘤的第6位,其中大多数为口腔鳞状细胞癌[1]。舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)起源于舌复层鳞状上皮细胞,约占口腔鳞状细胞癌的1/3 ~ 1/2,具有恶性程度高、早期易转移和预后差等特点。目前临床治疗主要以手术切除为主,以放疗和化疗为辅[2],然而由于舌周围的淋巴管和血管丰富,TSCC生长速度快、早期易发生淋巴结和远处转移,且缺乏有效的分子标志物,患者的5年生存率仅33% ~ 40%[3]。因此,探寻新的分子标志物对TSCC患者的早期诊断和治疗具有重要意义。Dickkopf相关蛋白1(DKK1)是一种Wnt/β-cateinin信号通路的抑制分子[4],其在多种肿瘤中表达异常,并在肿瘤的进展和转移进程中发挥重要作用。关于DKK1在肿瘤如结肠癌[5]、肺癌[6]等方面的功能研究已有报道,但DKK1在口腔鳞状细胞癌中的作用还不清楚。因此,该研究通过分析DKK1在TSCC组织和细胞中的表达水平以及可能的分子机制,为DKK1靶向治疗TSCC提供依据。
1 材料与方法
1.1 数据来源从TCGA数据库(https://portal.gdc.cancer.gov)中下载TSCC患者转录组核糖核酸测序(RNA-seq)数据和临床预后信息[7]。收集到162例TSCC患者数据,包含147例TSCC组织(15例原发肿瘤,132例病理类型不明)和15例癌旁组织。UALCAN数据库分析520例头颈部鳞状细胞癌组织和44例正常组织中DKK1的mRNA表达状况。
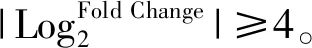
1.3 差异表达基因的生存分析应用Kaplan-Meier分析方法筛选上述差异表达基因中与TSCC患者生存率相关的基因,筛选的条件是P<0.05。采用Lasson回归法筛选TSCC患者中表达量与生存率呈负相关的代表性基因。应用Ualcan TCGA analysis网址(https://ualcan.path.uab.edu/)分析与TSCC患者生存相关的差异表达基因在TSCC组织与正常口腔组织中的表达状况。
1.4 GO功能和KEGG通路富集分析GO功能富集分析包括细胞组分(cellular component,CC)、分子功能(molecular function,MP)、生物过程 (biological process,BP),而KEGG数据库用于分析差异表达基因的信号通路。通过可视化数据分析网站(the database for annotationvisualization and integrated discovery, DAVID)对1.2中筛选出的基因进行GO功能和KEGG通路富集分析(https://david. ncifcrf.gov/)[9]。
1.5 病例资料收集2020年12月—2022年2月经手术切除的TSCC组织50例标本,样本均经病理检查确诊。其中,男性30例,女性20例;年龄<60岁者23例,年龄≥60岁者27例;肿瘤直径<3.0 cm者39例,肿瘤直径≥3.0 cm者11例;分化程度:高分化20例,中分化26例,低分化4例;无淋巴结转移者35例,有淋巴结转移者15例。
1.6 免疫组化实验
1.6.1采用免疫组化SP法检测DKK1抗体在TSCC中的表达状况 免疫组化SP(北京中杉金桥公司,SP-9000),DKK1抗体(英国Abcam公司,1 ∶800稀释,ab109416),石蜡组织切4 μm厚度,65 ℃烤片2 h,二甲苯脱蜡,梯度乙醇水化,微波炉EDTA抗原修复液处理2 min。之后步骤按照试剂盒说明书操作,滴加一抗,4 ℃过夜,滴加二抗,DAB显色,中性树胶封片。选用一抗阳性染色切片作为阳性对照,以 PBS 代替一抗的染色结果作为阴性对照。
1.6.2免疫组化结果判读 DKK1阳性染色评分标准以着色强度及着色细胞数综合判断。随机选择5个未出现重复视野的组织进行观察,同时计数视野内的细胞。以半定量积分法作为判断结果,同时采用双盲阅片法进行评分。按阳性细胞着色强度计分:无阳性着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;按细胞阳性细胞数计分:阳性细胞数<25%为0分,25% ~ 50%为1分,51% ~ 75%为2分,阳性细胞数>75%为3分。将上述2项得分相乘作为最终评分:0分为阴性组,评分≥1分为阳性组。
1.7 细胞培养HOEC和Cal27细胞均购自American Tissue Culture Collection公司。细胞用含10%胎牛血清、1%双抗的DMEM培养基,置于37 ℃、5% CO2的培养箱中培养,待细胞密度约70%~80%时,收集细胞。
1.8 Western blot实验收集上述细胞沉淀,加入高效RIPA裂解液提细胞蛋白,采用12%聚丙烯酰胺凝胶电泳分离蛋白,转移蛋白至PVDF膜上。加入DKK1(1 ∶1 000)、β-catenin(1 ∶1 000)、p-p65(1 ∶1 000)、p65(1 ∶1 000)和β-actin(1 ∶5 000)低温过夜孵育,再加入HRP标记的的二抗(1 ∶10 000)常温孵育1.5 h,最后用凝胶成像仪曝光。
1.9 细胞转染实验选取生长状态良好、细胞密度处于50%左右时进行实验。采用Mate转染试剂,具体操作步骤参考试剂盒说明书,转染48~72 h后提取细胞蛋白进行下游蛋白检测。DKK1-siRNA序列:5′-GAGGAAACCAUCACUGAAATT-3′,3′ -UUUCAGUGAUGGUUUCCUCTT-5′。
1.10 统计学处理采用SPSS 22.0软件进行统计分析,DKK1蛋白表达与TSCC临床病理特征的相关性分析用采用χ2检验法,以P<0.05为差异有统计学意义。
2 结果
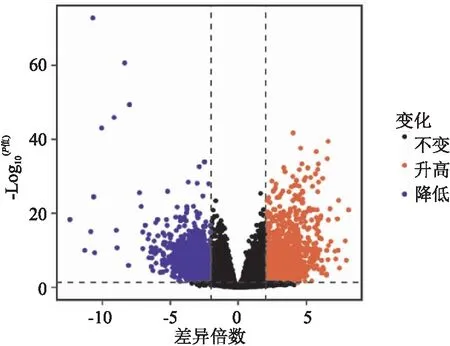
图1 TSCC患者中的差异表达基因
2.2 生存分析实验应用Kaplan-Meier分析方法筛选上述7 150个差异表达基因与TSCC患者生存率的关系(以P<0.05为筛选条件),共获得1 802个基因与患者生存率相关。进一步分析显示,在上述基因中,有761个基因在TSCC组织中高表达,并与患者的生存率密切相关。通过采用Lasso回归法在这716个基因中筛选关键基因,实验获得3个在TSCC组织中表达量与生存率呈负相关的基因(表达量越高,患者生存率越低),如图2所示。
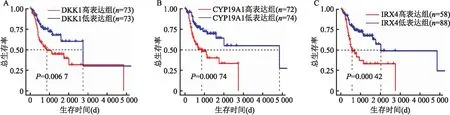
图2 关键基因的生存曲线
2.3 差异表达基因的GO功能和KEGG通路富集分析为更深入了解上述761个差异表达基因(在TSCC组织中高表达,并与患者生存率相关)的功能,实验利用 David网站对其进行GO功能和 KEGG 通路富集分析。如图3A所示,BP结果显示差异基因主要富集于细胞外基质、细胞器裂变、细胞核分裂和核染色体分离等生物过程;CC结果显示,差异基因在质膜外侧面、黏着斑、细胞底物连接胶原蛋白和细胞外基质内质网腔等部分成分较为丰富。同时,KEGG 通路富集分析表明,差异表达基因在细胞因子与受体间相互作用、中性粒细胞聚集、胶质瘤、细胞周期和细胞黏附分子等功能中较为活跃(图3B)。

图3 差异表达基因的GO功能和KEGG功能富集分析
2.4 DKK1在TSCC及正常口腔组织中的mRNA表达通过UALCAN数据库分析520例HNSC组织和44例正常组织中DKK1的mRNA表达状况。结果显示,与正常组织相比,HNSC组织中DKK1的mRNA表达水平增加(P<0.001,图4A)。进一步分析DKK1的mRNA表达与HNSC临床病理特征的相关性,结果显示其与HNSC临床分期、组织学分级和淋巴结转移密切相关(P<0.001,图4B-D)。与正常组织组相比,DKK1的mRNA在不同临床分期(P<0.001,图4B)、组织学分级(P<0.001,图4C)和淋巴结转移状态(P<0.001,图4D)HNSC组织中的表达水平均增强。
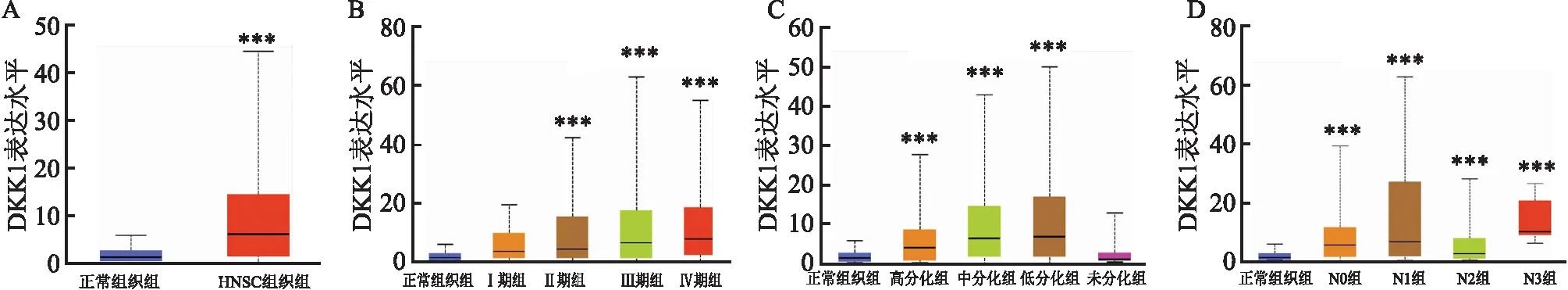
图4 UALCAN数据库分析DKK1 mRNA在HNSC中的表达水平
2.5 DKK1在TSCC及癌旁组织中的蛋白表达免疫组化结果显示,DKK1蛋白主要定位于胞质,其在癌旁组织中呈阴性或低表达,在TSCC组织中呈高表达(图5)。在50例TSCC组织中,DKK1蛋白的阳性率(84%,42/50)高于癌旁正常口腔组织(18%,9/50)(P<0.001)。见表1。

表1 正常舌组织和TSCC组织中DKK1蛋白的表达[n(%),n=50]

图5 TSCC组织中DKK1 蛋白的表达 ×100
2.6 DKK1与TSCC临床病理特征的关系通过分析DKK1表达与TSCC临床病理特征的相关性研究表明,DKK1表达与TSCC临床分期相关(P<0.05),而与TSCC患者性别、年龄、肿瘤直径、组织学分级、淋巴结转移无相关性(P>0.05)(表2),与UALCAN数据库分析结果相一致。其中DKK1蛋白在临床分期Ⅲ+Ⅳ期TSCC组织中的阳性率(92.5%,37/40)高于Ⅰ+Ⅱ期TSCC组织(50%,5/10)(P<0.05)(表2)。上述结果提示DKK1蛋白可能参与TSCC的恶性演进。
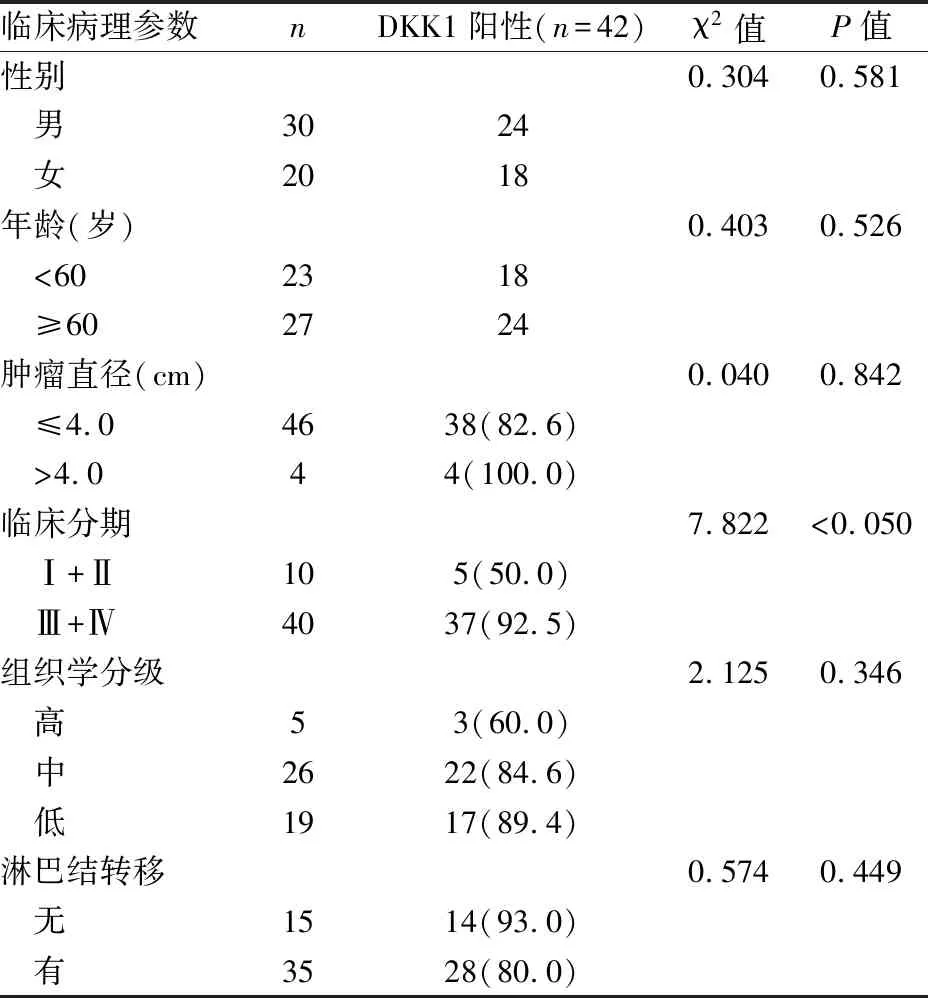
表2 DKK1蛋白表达与舌癌临床病理特征的关系[n(%)]
2.7 敲低DKK1对β-catenin、p-p65和p65表达的影响Western blot实验显示,与正常人口腔上皮细胞HOEC相比,DKK1在TSCC细胞Cal27中的蛋白表达水平升高。为探索DKK1在TSCC肿瘤中潜在的作用机制,实验利用siRNA敲低TSCC细胞中的DKK1的表达。Western blot实验结果显示,与对照组相比,DKK1敲低组Cal27细胞中β-catenin、p-p65和p65蛋白表达水平下降。见图6。
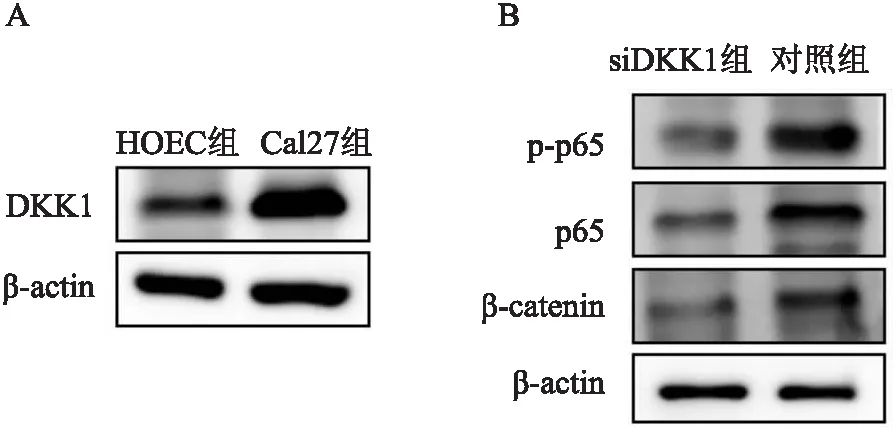
图6 DKK1在TSCC细胞中的表达及其下游靶点
3 讨论
DKK1基因全称是“dickkopf WNT signaling pathway inhibitor 1”,其编码的DKK1蛋白是具有2个富含半胱氨酸结构域的分泌蛋白,属于Dickkopf家族[10]。DKK1蛋白通过与LRP6共受体结合,抑制Wnt/β-catenin信号通路并参与胚胎发育、骨骼形成和多种癌症的发生发展过程[11]。由于肿瘤微环境的不同和癌症复杂的调控机制,DKK1蛋白对不同肿瘤中的不同发展阶段具有不同的影响[12]。目前,DKK1作为一个肿瘤相关性抗原,能激发特异性的CD4+辅助T细胞、CD8+CTL的细胞免疫应答以及靶向DKK1的体液免疫应答。此外,DKN-01是一种抑制DKK1蛋白的人源化单克隆抗体,与免疫治疗药物替雷利珠单抗和化疗联合使用,治疗多发性骨髓瘤、胃癌和胃食管交界癌患者[13]。DKK1蛋白与甲胎蛋白的联合应用,可将肝细胞癌的总体诊断率提高到87.5%[14]。DKK1在多种肿瘤组织中高表达,可通过下调NK细胞功能和促进骨髓瘤源性抑制细胞MDSCs在癌组织中的聚集来抑制抗肿瘤免疫反应,促进肿瘤的生长与转移[15]。
该研究采用生物信息学方法,通过TCGA数据库筛选到162例TSCC患者,通过癌组织和癌旁组织的NetworkAnalysed分析,共获得7 150个差异基因。通过Kaplan-Meier分析和Lasson回归法,实验筛选到3个表达量与生存率呈负相关的关键基因DKK1、CYP19A1和IRX4。其中,UALCAN数据库和免疫组化实验显示DKK1的mRNA和蛋白水平在TSCC组织中呈高表达,并且该蛋白与TSCC患者的临床分期相关,这提示DKK1可能促进TSCC肿瘤的发生和恶性演变等生物过程。此外,Western blot实验显示DKK1蛋白在TSCC细胞Cal27中的表达高于正常口腔上皮细胞HOEC。 在TSCC细胞Cal27中敲低DKK1的表达后,β-catenin、p-p65和p65的表达水平也发生相应下降,这提示DKK1可能通过下调β-catenin、p-p65和p65表达来调控TSCC肿瘤的恶性生物学进展过程。

