维生素D通过影响PBMC炎症相关基因对IBD的机制研究
徐艳秋,陈卫刚
炎症性肠病(inflammatory bowel diseases, IBD)是一种与克罗恩病(Crohn′s disease, CD)和溃疡性结肠炎(ulcerative colitis, UC)相关,发生在人体胃肠道的一种慢性炎症性溃疡性疾病[1]。IBD的主要临床表现是腹泻、夜间排便、腹痛、体质量减轻和疲劳等。UC通常只影响结肠,而CD则影响从口腔到肛门的整个胃肠道。IBD的发病率在欧美国家大约在0.3%[2],其发病机制尚不清楚,但关键因素包括遗传、环境、免疫、肠道微生物等。
随着研究的进展,人们逐渐认识到维生素D在调节肠道黏膜免疫方面发挥了重要的作用;研究表明维生素D可能影响肠道上皮完整性、天然免疫屏障功能以及T细胞的发育和功能。在遗传易感人群中,维生素D缺乏可能是导致IBD发病的一个因素,其含量的变化可能会影响疾病活跃度[3]。在IBD患者经过抗炎治疗后,与未治疗患者具有较低比例的外周血单个核细胞(peripheral blood mononuclear cells,PBMC),且PBMC中炎症因子显著下降[4]。但目前对于维生素D是如何通过影响炎症反应及免疫系统对IBD的作用机制尚未表明,因此,该课题通过研究维生素D对PBMC的影响,探讨其在IBD中的作用机制。
1 材料与方法
1.1 病例资料及分组收集石河子大学医学院第一附属医院2018年10月—2021年10月消化内科门诊确诊但未进行系统治疗的成年IBD活动期患者共190例,以活动期症状及肠镜结果为准,其中UC患者128例,CD患者62例。对UC患者和CD患者平均随机各分为2组,一组为常规治疗组(美沙拉嗪1 g,每6 h服用1次),一组为常规治疗+维生素D组(美沙拉嗪1 g,每6 h服用1次+维生素D 400 U 每日1次),共计4组。该研究通过伦理委员会批准,入组患者均签署相关知情同意书,临床资料从门诊和住院病历资料中获取。
1.2 差异性表达基因的筛选通过检索GEO数据库中下载关于维生素D对单个核细胞中mRNA的表达矩阵,确定数据库为GSE50012,其中mRNA平台为GPL10558,包括24个病例,12个对照组病例(GSM8321138-GSM832184)和12个服用维生素D病例(GSM1212354-GSM1212376)。使用R语言(3.6.3版本)中Limma包[5]用于分析差异性表达的mRNA,确定不同表达的mRNA和差异表达的基因(differentially expressed genes, DEGs)。使用“ggplot2”包绘制火山图。
1.3 基因本体论(gene ontology, GO)和KEGG富集分析通过使用在线数据库DAVID(https://david.ncifcrf.gov/)将上述DEGs进行筛选,筛选条件为|log2FC|>1, adjP<0.05,作为候选基因进行GO和KEGG分析,GO分析按照分子功能、细胞定位、生物途径对候选基因进行注释。使用“ggplot2”包绘制气泡图。
1.4 蛋白质互作网络(protein-protein interaction, PPI)的构建以及Hub基因的筛选对上述筛选后的DEGs进行PPI网络构建,使用在线软件STRING(https://string-db.org/)进行分析,通过该网站进一步寻找DEGs之间潜在的联系。对于输出后数据使用Cytoscape软件中cytoHubba插件寻找互作网络中关键基因,用于后续实验分析。
1.5 血液样本中单个核细胞的获取对所有纳入人群分为4组,住院后获取患者血液样本,出院后对患者进行随访规律用药2个月后前往门诊再次抽血获取血液样本,使用EDTA抗凝管保存。收集后的血液样本进行梯度离心法获取到单个核细胞,对获取到的细胞使用细胞裂解液Takara RNAiso plus裂解细胞,后将沉淀静置5 min后于-80 ℃冰箱中保存。
1.6 总RNA的提取按照总RNA 提取试剂盒的方法提取血液中单个核细胞中总RNA,利用Taqman mRNA Reverse Transcription Kit试剂盒和普通反转录试剂盒反转录得到cDNA,按照Taqman mRNA kit试剂盒和SYBR Green PCR Master Mix试剂盒进行qRT-PCR反应,得到数据用2-ΔΔCt法进行处理,计算表达量。引物序列见表1。

表1 7个关键基因引物序列
1.7 研究流程对收治患者填写量表,采用改良Truelove和Witts疾病严重程度分型及蒙特利尔分类表对患者进行病情判断,对于活动期,进行规范化治疗3个月后再次评估患者的活动期及缓解期。活动期肠镜判断标准:可见病变黏膜弥漫性充血、水肿,质脆,脓性分泌物附着,并发糜烂、浅小溃疡。静止期:黏膜炎症减轻,苍白,出血少,正常结构消失,黏膜干燥粗糙。

2 结果
2.1 mRNA的差异性表达情况通过R语言分析可以得到两组不同表达的基因,在GSE50012中共计获得差异性表达基因128个,其中与对照组比较,高表达基因数为53个,低表达基因数为75个(Log2FC>1,P<0.05),见图1A、B;进一步分析数据获得火山图和PCA图,其中低表达为蓝色,高表达为红色,见图1C、D。

图1 服用与未服用维生素D外周血单个核细胞中差异性基因表达
2.2 DEGs富集分析为了进一步分析差异性表达基因所参与的通路及可能发挥的功能,采用DAVID数据库对筛选出的所有基因进行富集分析,通过KEGG分析主要参与细胞因子-细胞因子受体相互作用、IBD、用于 IgA 的肠道免疫网络、肿瘤坏死因子(tumor necrosis factor, TNF)信号通路等,见图2A。通过GO分析所得,筛选与该研究高度相关的通路及功能,细胞成分(cellular component, CC)分析显示含胶原细胞外基质、质膜外侧、富含ficolin-1颗粒、液泡膜、囊泡腔、溶酶体膜等,见图2B;分子功能(molecular function, MF)结果显示DEGs参与趋化因子受体结合、细胞因子活性、趋化因子活性、细胞因子结合、CXCR 趋化因子受体结合等,见图2C;在生物学过程(biological process, BP)中,主要参与调节炎症反应、调节免疫效应过程、对细菌来源分子的反应、中性粒细胞活化、中性粒细胞介导的免疫、参与免疫反应的中性粒细胞活化、淋巴细胞介导的免疫、T细胞活化、淋巴细胞活化的调节、细胞因子产生的正向调节等,见图2D。
2.3 差异性表达mRNA的GSEA分析情况对所有差异性表达的基因进行筛选,取Log2FC>1.5,P<0.05后,再次对所筛选后分子进行GSEA分析,结果表明差异性表达的分子主要参与了Vitamin D受体途径[P<0.01,校正后的富集分数(NES)=2.479]、反应肽配体结合受体(P<0.01,NES=-2.132),KEGG趋化因子信号通路(P<0.01,NES=-2.020)。见图3。

图3 差异性表达基因的GSEA分析结果
2.4 差异性表达基因PPI网络构建对所有差异性表达的基因进行筛选,设置条件为Log2FC>1.5,P<0.05,筛选后分子通过在线网站String得到35个节点蛋白分子的互作网络关系(P<0.001),下载相关数据后导入Cytoscape软件,根据Dgree和Log2FC值得到差异性基因的互作网络图,见图4A。再次通过Cytoscape软件中CytoHubba插件筛选出关键位置的7个基因,分别为IL-6、MMP9、CXCL9、CXCL10、TREM1、IL1R2、C1QB这7个关键基因,见图4B。

图4 PPI网络分析结果
2.5 纳入患者的一般资料在该院门诊就诊的患者进行一般资料的比较,其中UC患者共128例,CD患者62例,两种疾病患者在性别上无显著差异(P=0.718),在年龄分布上UC患者要高于CD患者(P=0.016),两组在发病中位时间上无显著差异(P=0.632)。见表2。

表2 纳入患者的一般资料
2.6 维生素D对IBD的病情影响将处于活动期的UC患者及CD患者随机分为常规治疗组、常规治疗+维生素D组,按疗程规范治疗3个月后再次对所有纳入患者进行评分,结果显示在UC患者中加服用维生素D缓解率为93.75%,进行常规治疗患者缓解率为81.25%,且两者差异有统计学意义(P<0.05);CD患者加服用维生素D后缓解率为90.32%,行规范化治疗患者缓解率为67.74%,且两组差异有统计学意义(P<0.05)。见表3。

表3 UC和CD患者临床缓解情况
2.7 候选mRNA在患者中的表达情况为了进一步分析差异性表达基因在常规治疗组、常规治疗+维生素D组中的表达,结合Hub基因和参与维生素D通路的基因成功筛选出7个,分别为HLA-DMA、HLA-DMB、IL-6、NOD2、MMP9、CXCL9、CXCL10。通过qRT-PCR的方法测定在UC和CD患者中常规治疗组、常规治疗+维生素D组的表达情况,结果表明:与常规治疗组比较,常规治疗+维生素D组中HLA-DMA、HLA-DMB、IL-6、MMP9、CXCL9、CXCL10呈低表达,而NOD2呈高表达,且差异有统计学意义(P<0.01);与常规治疗组比较,常规治疗+维生素D组中HLA-DMA、HLA-DMB、IL-6、MMP9、CXCL9、CXCL10呈低表达,而NOD2呈高表达,且差异有统计学意义(P<0.01),与UC患者的表达结果一致。见图5。
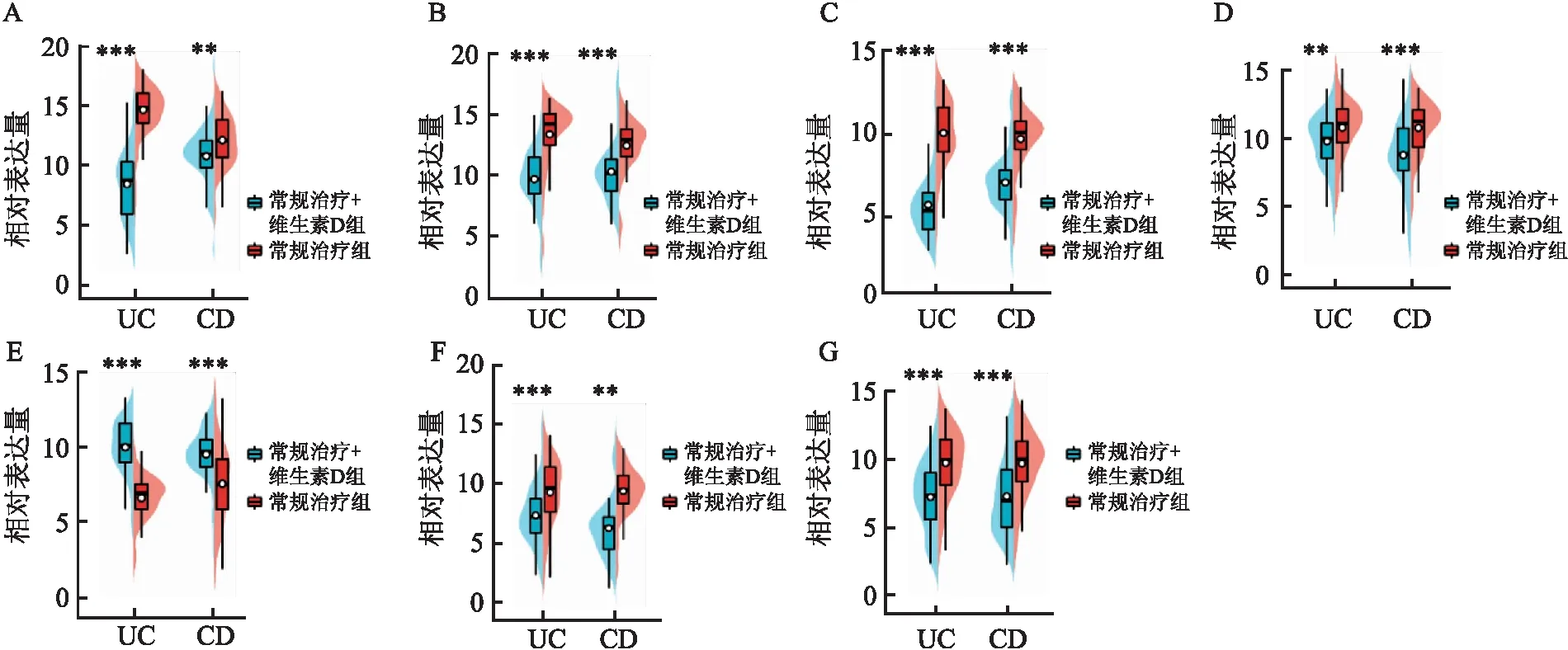
图5 临床患者中关键基因的差异性表达
3 讨论
IBD主要是由炎症和免疫系统紊乱介导的疾病,而维生素D在维持胃肠道屏障完整、监测肠道微生物群和炎症免疫反应等方面发挥着重要作用。前期研究[6]显示,维生素D缺乏在IBD患者中很常见,其患病率高于一般人群,且CD略高于UC。造成这种情况的原因主要包括免疫抑制、饮食限制和营养吸收障碍等。但既往研究无法确定两者之间的因果关系,该研究通过了解两者的作用机制,寻找新证据,探究维生素D缺乏、补充与疾病严重程度的关系,对于IBD的治疗提供更有利的方案。
由淋巴细胞组成的外周血单个核细胞在介导免疫调节和长期的慢性炎症过程中发挥了重要的作用[7]。该研究通过是否服用维生素D为变量,结果显示单个核细胞中差异性表达的基因共计128个,其中高表达基因数为53个,低表达基因数为75个,表明维生素D可以与单个核细胞表面的维生素D受体结合,影响下游基因的表达。Burczynski et al[8]研究显示,在IBD患者的单个核细胞寻找差异性表达的基因,在UC和CD之间基因表达存在差异;在此基础上Tom et al[9]又通过检测IBD患者中外周血单个核细胞中的Treg细胞和Th17细胞的比例,较正常人均升高,侧面印证了外周血单个核细胞确实在IBD中介导了免疫调节。Mohammadi et al[10]高通量测序检测了CD患者外周血单个核细胞中miRNA的变化,同样验证了下游靶分子参与了BD的免疫反应。
通过GO和KEGG富集分析显示差异性表达的大部分基因参与炎症反应、免疫效应、介导免疫等过程,从而参与了IBD的发生和发展。维生素D可能通过与外周血单个核细胞上VDR结合引起下游分子的变化,引起外周血中基因改变,参与IBD患者的炎症反应和免疫调节。KEGG显示主要存在IBD和IgA的肠道免疫网络,可能是维生素D可以调节肠道中IgA的表达进而影响IBD的预后。Palm et al[11]同样表明在IBD中IgA呈强阳性。Lucafò et al[12]同样表明在IBD患者血清中IL10和IgA水平升高,IgA水平的变化与肠道菌群失调有着密切关系,IgA通过调节肠道黏膜发挥抑制炎症的作用。GSEA结果表明差异性表达的分子主要参与VDR途径、KEGG趋化因子信号通路等,大量的研究集中于趋化因子与IBD之间的关系,通过参与IBD细胞内信号转导、炎症细胞的激活和趋化,增加单核细胞黏附分子的表达和游走能力。本文猜测维生素D可能也会影响外周血单个核细胞中趋化因子的变化影响疾病的进展,通过蛋白互作网络分析筛选出IL-6、MMP9、CXCL9、CXCL10、TREM1、IL1R2、C1QB这7个关键基因。
为进一步验证差异性表达基因在IBD中的作用,在UC中加用维生素D后缓解率明显升高,说明维生素D可加速UC进入缓解期。Battistini et al[13]的研究表明30 ng/ml的维生素D可以有效降低IBD的活动性,处于缓解期的IBD患者血清中存在高水平的维生素D。该研究在对CD患者的研究中得到同样的结果。进一步检测4组患者7个基因的表达量,与未加用维生素D患者相比较,加用维生素D后HLA-DMA、HLA-DMB、IL-6、MMP9、CXCL9、CXCL10呈现低表达,而NOD2呈现高表达。HLA-DMA和HLA-DMB均属于HLA II类旁系同源物,主要在抗原呈递细胞(APC、B淋巴细胞、树突细胞、巨噬细胞)中表达,参与炎症因子的趋化。IL-6是一种多效性细胞因子,能趋化白细胞定向移动的小分子分泌蛋白[12],而IBD发病是由于促炎因子连续释放。MMP9在IBD中的研究较少,但该研究表明MMP9作为趋化因子之一,在IBD患者的血清中呈现高表达,但具体机制并未阐明,需要进一步验证。CXCL家族同样是趋化因子中重要的组成部分,其中CXCL9、CXCL10是CXCR3的配体,具有促进炎症的作用,既往Carey et al[14]研究表明与健康对照组相比较,IBD患者结肠黏膜中上皮细胞CXCL10明显升高,其升高与IL-17的分泌增加有关。研究表明维生素D可以抑制病变部位的炎症反应,进而抑制趋化因子CXCL9、CXCL10的表达。

