AMD3100下调CA9与CXCR4表达逆转索拉菲尼耐药
秦骥伟,郑 浩,徐治军,栗雪峰,孙 成
肝细胞癌(hepatocellular carcinoma,HCC)是全球致死率第4的恶性肿瘤,也是全球第6大常见癌症[1]。手术切除是早期HCC的标准治疗方法,但超过80%的HCC患者被诊断时已无法进行根治性手术。索拉菲尼作为晚期HCC的一线药物作用于多个靶点,可显著延长晚期HCC患者的生存时间[2-3]。然而,索拉菲尼的获得性耐药限制了其临床疗效。
碳酸酐酶IX(carbonic anhydrase IX,CA9)是一种膜相关锌金属酶,可使肿瘤细胞在低氧酸性微环境中存活[4-6],并在多种恶性肿瘤中表达上升。低氧微环境使肿瘤细胞生存能力和侵袭性增强,更易远处转移及产生耐药性[5,7]。趋化因子受体4(CXC chemokine receptor Type 4,CXCR4)是一种参与血管生成和肿瘤侵袭的趋化因子受体,研究表明其在HCC、乳腺癌等多种肿瘤类型中表达,并在其转移扩散中发挥重要作用[8-12]。AMD3100是CXCR4的特异性拮抗剂,既往研究[10,13]表明AMD3100可抑制多种肿瘤的转移和增殖,增加肿瘤对化疗和放疗的敏感性。因此,该研究通过分析CA9和CXCR4在HCC中的表达,以AMD3100作为研究对象,研究其对索拉菲尼耐药HCC细胞的增殖、侵袭和耐药性影响,对探讨HCC恶性倾向以及HCC的索拉菲尼耐药机制具有重要的科研和临床价值。
1 材料与方法
1.1 材料
1.1.1细胞株 人源HCC Huh7、HepG2 细胞购自中国科学院上海细胞库。
1.1.2药物与试剂 AMD3100购自美国Selleck Chemicals公司;索拉菲尼购自美国Selleck Chemicals公司;CCK-8购自日本Dojindo公司;β- actin购自德国Sigma公司;胎牛血清、青-链霉素双抗、2.5%胰酶购自美国Gibco公司;PBS购自生工生物工程(上海)股份有限公司;SDS-PAGE上样缓冲液购自上海碧云天生物技术有限公司;CXCR4购自美国Santa Cruz公司;CA9购自美国Gene Tex公司;transwell小室购自美国Corning公司;Mitrogel购自美国BD公司。
1.2 方法
1.2.1细胞培养 将Huh7和HepG2细胞培养在含有10%胎牛血清以及1%青-链霉素双抗的培养液中,置于37 ℃ 5% CO2培养箱中培养。
1.2.2HCC索拉菲尼耐药细胞的建立 采用浓度梯度递增法构建 Huh7/Sor和HepG2/Sor耐药细胞株,以浓度为5 μmol/L的索拉菲尼作为起始浓度进行诱导,逐步进行浓度爬坡,每次爬坡浓度约提高1.5倍,每14 d爬坡1次,最终得到稳定耐受浓度为15 μmol/L的索拉菲尼的 Huh7/Sor和HepG2/Sor耐药细胞株。Huh7/Sor和HepG2/Sor细胞株培养在含有10 μmol/L 索拉菲尼的培养液以维持其耐药性。实验前5~6 d,将Huh7/Sor和HepG2/Sor细胞恢复至正常培养液中培养。
1.2.3CCK-8法检测AMD3100和索拉菲尼对HCC细胞及HCC索拉菲尼耐药细胞增殖毒性作用的影响 课题组预实验表明不同浓度AMD3100处理后降低Huh7/Sor细胞对索拉菲尼的耐药性,50 μmol/L组和100 μmol/L 组效果最明显且两组间差异无统计学意义,本研究后续实验均采用50 μmol/L AMD3100,见表1。取对数生长期Huh7、HepG2、Huh7/Sor、HepG2/Sor细胞以及以50 μmol/L的AMD3100预处理90 min的Huh7/Sor和HepG2/Sor细胞接种于96孔板内,每孔加100 μl培养基,细胞密度为5×104个/ml。待细胞融合到80%,以梯度稀释的方法分别加入由完全培养基配制的2.5、5.0、10.0、20.0、30.0 μmol/L的索拉菲尼。Control组加等量培养液,各组均设3个复孔,另设调零孔(培养液)。将96孔板置入37 ℃、5% CO2细胞培养箱48 h,弃去各孔内液体,每孔加入100 μl含10% CCK-8的培养液,置于培养箱内孵育4 h。用酶标仪测定各孔在450 nm波长下的吸光值(A),细胞存活率=(A实验组-A平均Control组)/(A平均对照组-A平均Control组)×100%,计算出索拉菲尼对4种细胞生存率的影响及相应的半抑制浓度(half maximal inhibitory concentration,IC50)。
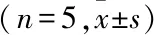
表1 不同浓度AMD3100对HCC索拉菲尼耐药细胞的增殖毒性作用的影响
1.2.4Transwell小室法检测AMD3100对HCC细胞及HCC索拉菲尼耐药细胞的侵袭能力的影响 Matrigel 基质胶冰面上液体化后,与 DMEM 培养基按1 ∶3稀释后在膜下室侧涂抹。将铺基质胶的小室置于37 ℃孵育箱 30 min 使基质胶凝固。胰酶消化下处理过的Huh7、Huh7/Sor细胞制成单细胞悬液,细胞密度用无血清DMEM 培基调至约2.5×104个/ml,下室加 600 μl无血清DMEM 培基, 吸取 200 μl细胞悬液均匀加入上室。分为Huh7、Huh7/Sor和上室含有50 μmol/L的AMD3100的Huh7、Huh7/Sor共4组。12 h后,取出小室PBS洗涤,4%多聚甲醛溶液固定30 min。将小室置于0.1%结晶紫甲醇溶液中染色10 min,光学显微镜下计数每孔5个高倍视野下穿过基底膜的细胞数目并拍照。
1.2.5Western blot法检测AMD3100对HCC细胞及HCC索拉菲尼耐药细胞CA9及 CXCR4蛋白表达水平的影响 将Huh7、HepG2、Huh7/Sor、HepG2/Sor细胞分为0 μmol/L组和5 μmol/L 索拉菲尼处理组,以5×104个/ml密度接种至6孔板,每孔2 ml。细胞融合至70%时,分别换成无血清培养基和含5 μmol/L 索拉菲尼的无血清培养基,实验组加入AMD3100 (终质量浓度为50 μmol/L)处理90 min。用 RIPA 缓冲液分别溶解各组细胞,BCA法检测蛋白质浓度。每孔加样25 g相应总蛋白质进行蛋白SDS-PAGE电泳,转移至PVDF 膜上。50 g/L脱脂牛奶封闭1 h,加入一抗CXCR4(1 ∶1 000)、CA9(1 ∶1 000)置于4 ℃冰箱过夜。TPBS清洗膜后加入二抗,37 ℃ 摇床放置2 h。用 DNR 生物成像系统进行发光、测试、照相,使用Image J软件图像分析,计算出各组细胞中CA9和CXCR4蛋白的相对表达量。

2 结果
2.1 AMD3100和索拉菲尼对HCC细胞及HCC索拉菲尼耐药细胞的增殖毒性作用的影响结果显示,Huh7/Sor组在2.5、5.0、10.0、20.0和30.0 μmol/L的索拉菲尼浓度下的增殖效率高于Huh7/Sor+AMD3100组和Huh7组,差异有统计学意义(P<0.05)。HepG2/Sor组在2.5、5.0、10.0、20.0和30.0 μmol/L的索拉菲尼浓度下的增殖效率高于HepG2/Sor+AMD3100组和HepG2组,差异有统计学意义(P<0.05 )。应用Probit回归分析估算出索拉菲尼对 Huh7、HepG2、Huh7/Sor、HepG2/Sor的IC50值。 索拉菲尼对 Huh7、HepG2、Huh7/Sor、HepG2/Sor的IC50值分别为6.40、6.95、11.51、11.70 μmol/L,根据耐药指数(resistance index,RI)=IC50(耐药细胞)/IC50(亲本细胞)计算得出Huh7/Sor和HepG2/Sor细胞对索拉菲尼的RI分别为1.80和1.68。AMD3100可以增加 Huh7/Sor和HepG2/Sor细胞对索拉菲尼的敏感性,提高索拉菲尼对Huh7/Sor和HepG2/Sor细胞的抑制作用,降低IC50值。AMD3100处理后,Huh7/Sor和HepG2/Sor细胞对索拉菲尼的IC50值分别从11.51和11.70 μmol/L降至9.01和10.36 μmol/L,RI也分别从1.80和1.68降至1.41和1.49。见表2。
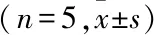
表2 AMD3100和索拉菲尼对HCC细胞及HCC索拉菲尼耐药细胞的增殖毒性作用的影响
2.2 Transwell小室法检测HCC细胞及HCC索拉菲尼耐药细胞的侵袭能力结果显示,12 h后Huh7/Sor+AMD3100组迁移细胞数(196.45±29.94)较Huh7/Sor组(292.15±60.80)减少,差异有统计学意义(t=-5.003,P<0.05)。Huh7+AMD3100组迁移细胞数[(183.24±65.81)个]较Huh7组[(238.83±50.36)个]减少,差异有统计学意义(t=-2.458,P<0.05)。Huh7组迁移细胞数[(238.83±50.36)个]少于Huh7/Sor组[(292.15±60.80)个],差异有统计学意义(t=-2.376,P<0.05)。这表明Huh7/Sor细胞拥有比Huh7细胞更强的侵袭能力,而AMD3100处理后可以降低Huh7细胞和Huh7/Sor细胞的侵袭能力。见图1。

图1 Transwell小室实验检测细胞侵袭能力
2.3 Western blot法检测AMD3100对HCC细胞及HCC索拉菲尼耐药细胞CA9及 CXCR4蛋白表达水平的影响① 在各细胞组中,AMD3100处理组细胞的CA9蛋白表达水平均低于Control组(P<0.05);0 μmol/L 索拉菲尼处理条件下,Huh7组细胞和HepG2组细胞的CA9蛋白表达水平均低于Huh7/Sor组细胞和HepG2/Sor组细胞(t=-8.086,P<0.01;t=-8.086,P<0.01);5 μmol/L 索拉菲尼处理条件下,Huh7组细胞和HepG2组细胞的CA9蛋白表达水平均低于Huh7/Sor组细胞和HepG2/Sor组细胞(t=-2.570,P<0.05;t=-3.679,P<0.05)。见图2。② 在各细胞组中,AMD3100处理组细胞的CXCR4蛋白表达水平均低于Control组(P<0.05);0 μmol/L 索拉菲尼处理条件下,Huh7组细胞的CXCR4蛋白表达水平低于Huh7/Sor组细胞(t=-8.855,P<0.01);5 μmol/L 索拉菲尼处理条件下,Huh7组细胞和HepG2组细胞的CXCR4蛋白表达水平均低于Huh7/Sor组细胞和HepG2/Sor组细胞(t=-2.570,P<0.05;t=-3.724,P<0.05)。见图3。结果提示:与Huh7和HepG2细胞比较,Huh7/Sor和HepG2/Sor细胞的CA9和CXCR4蛋白表达增加;AMD3100处理Huh7、HepG2、Huh7/Sor和HepG2/Sor细胞后,可降低其CA9及CXCR4的蛋白表达水平。
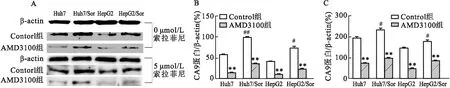
图2 Western blot法检测AMD3100对HCC细胞中CA9相对蛋白表达水平的影响

图3 Western blot法检测AMD3100对HCC细胞中CXCR4相对蛋白表达水平的影响
3 讨论
HCC是目前世界范围内发病率和病死率均居前列的人类恶性肿瘤之一,尤其是在以中国为代表的东亚地区[1]。由于早期HCC无明显临床症状,超过80%的HCC患者被诊断时已经处于晚期状态,无法进行根治性手术或肝移植。同时晚期HCC患者还面临化疗有效率低,放疗及肝动脉介入栓塞化疗不能解决肝外转移等问题。
索拉菲尼是晚期HCC的标准临床治疗药物之一。然而,由于索拉菲尼通常在6个月内发生原发性或获得性耐药,故仅有约30%的HCC患者因索拉菲尼的治疗而受益[14]。目前,索拉菲尼耐药的具体机制尚不明确。近年有研究[7,14]表明,索拉菲尼耐药性的产生可能与HCC的肿瘤低氧微环境的发生发展有关。目前已在多个实体恶性肿瘤的研究中发现肿瘤低氧微环境的形成,低氧是由不良的血管形成和旺盛的代谢活动引起的,并与化疗药物耐药性的产生、恶性肿瘤的侵袭性增加和预后不良有关[7,14-15]。因此,抑制低氧被认为是克服耐药性的可行方法。一般情况下,低氧可以通过转录因子低氧诱导因子1(hypoxiainducible factor-1,HIF-1)的α亚基的过度表达来检测。然而,HIF-1α的稳定性非常有限,CA9作为一个更稳定的分子参数通常作为低氧的替代标志物。CA9是HIF-1的特异性转录靶基因,但比HIF-1α更稳定,并且可通过与CO2的水合作用稳定细胞外pH值,从而影响实体肿瘤的进展。在低氧条件下,CA9启动子区的低氧反应元件与HIF-1α结合,从而导致CA9表达上调[4]。因此,CA9在本研究中被用作低氧标志来进行检测。
CXCR4是基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1)α的趋化因子受体。最近的研究[10-12]表明,CXCR4参与血管生成和细胞迁移,在低氧微环境和HIF-1a调节下表达上调。索拉菲尼可以通过增加肿瘤组织中的低氧、炎症和纤维化来触发HCC中的促癌微环境。SDF1α/CXCR4轴在索拉菲尼治疗后表达上调,并在增强癌细胞存活、募集肿瘤相关骨髓衍生细胞、增加结缔组织增生和促进HCC转移表型中发挥关键作用。鉴于CXCR4信号传导的致癌作用,因此,对于晚期HCC患者, 阻断CXCR4轴可能与目前的标准治疗——索拉菲尼和免疫检查点抑制剂(如抗PD-1)具有协同作用,同时具有对抗索拉菲尼的耐药作用[11]。AMD3100是第1个被FDA批准的可用于外周血干细胞移植的CXCR4拮抗剂[10],与CXCR4特异性结合并抑制CXCR4与趋化因子CXC配体12之间的相互作用,且与其他趋化因子受体无交叉反应。
基于目前索拉菲尼耐药现状,本研究建立了索拉菲尼耐药HCC细胞系Huh7/Sor和HepG2/Sor,结果显示Huh7/Sor和HepG2/Sor细胞有着更强的侵袭能力,并且索拉菲尼耐药HCC细胞系Huh7/Sor和HepG2/Sor细胞中CA9和CXCR4的蛋白表达水平相对于Huh7和HepG2细胞提高。在本研究中,经AMD3100处理后,Huh7、HepG2、Huh7/Sor和HepG2/Sor细胞的侵袭能力受到了抑制,同时降低了细胞中CA9和CXCR4的蛋白表达水平。以上研究表明CA9和CXCR4可能在HCC中的索拉菲尼的耐药性产生过程中扮演了重要的作用,并促进了HCC的侵袭。对CXCR4的拮抗可有效降低HCC的索拉菲尼耐药性,并降低HCC的侵袭能力。

