SS-31抑制O3介导的小鼠气道高反应和黏液高分泌
谢梅琴,李忱菲,刘 琪,翁佳丽,张 海,李 锋,范晓云
臭氧(O3)是一种典型的二级空气污染物,主要是由氮氧化物和挥发性有机化合物在光合作用下形成。中国是全球臭氧水平最高的国家之一,随着气候变暖,夏季O3在空气中的含量大幅增加。研究[1]表明,O3与人体健康相互关联,短期O3暴露与呼吸系统的病死率和发病率增加有关,而长期O3暴露会导致一些慢性呼吸系统疾病,如非嗜酸粒细胞性哮喘和慢性阻塞性肺疾病。O3暴露可引起气道上皮细胞急性损伤、炎症、气道高反应性和黏液高分泌,从而导致气道发生刺激性反应,包括咳嗽、支气管收缩和炎症细胞浸润并导致小气道功能异常[2]。
线粒体是负责能量代谢的细胞器,在维持细胞功能中起着重要作用[3]。最近的研究[4]表明,O3可引起线粒体功能障碍,并触发机体的炎症反应和氧化应激反应。炎症小体NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)可由多种危险情况触发,包括感染和代谢失调,活性氧 (reactive oxygen species,ROS)诱导的半胱氨酸残基氧化可能促进半胱氨酸蛋白酶-1(Caspase 1)介导的Gasdermin家族蛋白D (Gasdermin D,GSDMD)裂解和激活[5]。SS-31是一种新型的线粒体靶向抗氧化复合物,可以消除ROS,减轻线粒体功能障碍和氧化损伤。目前尚不清楚SS-31是否能抑制O3诱导的气道高反应和黏液高分泌。因此,该研究旨在探究 SS-31能否通过抑制NLRP3/Caspase 1/GSDMD信号通路在O3介导的气道高反应性和黏液高分泌模型中发挥保护作用。
1 材料与方法
1.1 实验动物所有相关实验均得到了实验动物伦理委员会的批准。6~8周龄SPF级雄性C57BL/6小鼠,购自上海西普尔-必凯实验动物有限公司,饲养于上海交通大学医学院附属胸科医院实验动物中心。实验前适应性喂养1周,给予适宜的环境及充足的食物和水。
1.2 仪器与试剂臭氧产生仪购自德国比森多夫公司;气道高反应仪购自英国EMMS公司;酶标仪购自美国Thermo Fisher公司;蛋白印迹自动成像仪购自美国 Bio-Rad公司;SS-31购自上海强耀生物科技有限公司;乙酰胆碱(acetylcholine,Ach)购自Sigma-Aldrich上海贸易有限公司;刘氏染液和PAS染液均购自珠海贝索生物技术有限公司;TRIzol试剂、Prime ScriptTMRT Master Mix Kit、Power Green qPCR mix均购自大连 TaKaRa 公司;丙二醛(malondialdehyde,MDA)检测试剂盒、谷胱甘肽(glutathione,GSH)/谷胱甘肽(oxidized glutathione,GSSG)检测试剂盒、BCA蛋白浓度测定试剂盒、SDS-PAGE蛋白上样缓冲液(5×)均购自上海碧云天生物科技有限公司;β-actin、白介素(interleukin,IL)-1β、IL-6、IL-18、单核细胞趋化因子-1(monocyte chemoattractant protein-1,MCP-1)和MUC5B均购自上海迈浦生物科技有限公司;GAPDH、β-actin、NLRP3、pro-Caspase 1、GSDMD、Cleaved GSDMD均购自美国Cell Signaling公司;Caspase 1(p20)购自上海远慕生物科技有限公司。
1.3 动物分组与处理将32只雄性C57BL/6小鼠随机分为磷酸盐缓冲液(PBS)+Air组、SS-31+Air组、PBS+O3组、SS-31+O3组,每组各8只。各组在空气或O3暴露前1 h腹腔注射PBS或SS-31(10 mg/kg,溶于PBS)。将PBS+O3组和SS-31+O3组放在一个由发电机产出5.01×10-6mol/m3浓度O3的全身暴露室(65 cm×45 cm×37 cm)中,暴露3 h。PBS+Air组和SS-31+Air组小鼠暴露在过滤后的空气中。
1.4 气道反应检测24 h后,将0.2 ml的1%戊巴比妥注射到小鼠腹腔,通过气管切开、气管插管,连接小鼠气道与气道高反应检测仪。首先暴露于雾化PBS(建立基线),逐渐增加雾化Ach浓度(0、8、16、32、64、128、256 mg/ml)。每一剂量Ach持续30 s,记录呼吸测量值并在雾化开始7 min内取平均值作为参考数据。记录肺阻力(lung resistance,RL)值计算比基线增加100%所需的乙酰胆碱浓度(PC100),并以-logPC100作为支气管反应性的衡量指标。
1.5 支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)气道高反应检测完后,用过量的戊巴比妥钠处死小鼠。经气管内管向小鼠气道内灌注2 ml PBS,回收BALF。然后将BALF放于4 ℃下以1 000 r/min离心10 min。上清液放于-80 ℃下保存,以供进一步测定。取0.2 ml PBS重悬细胞颗粒,进行总细胞计数,再用刘氏染色液染色,400倍镜下计数至少500个细胞。
1.6 组织病理学分析取小鼠左肺,用10%福尔马林灌注固定,用石蜡包埋。石蜡切片,制备约4 μm厚的肺组织切片进行PAS染色,评估支气管周围的黏液分泌情况,0级(无杯状细胞)、1级(<25%)、2级(25%~50%)、3级(51%~75%)和4级(>75%)。计算每只小鼠的平均杯状细胞增生评分。
1.7 氧化应激水平检测取适量新鲜的肺组织,加入细胞/组织裂解液匀浆后,4 ℃,9 000 r/min离心10 min,收集上清液。然后用BCA检测试剂盒测定蛋白质浓度,酶标仪测定532 nm处吸光度,计算MDA的含量。
用蛋白去除试剂将肺组织10 mg均质,取混合物8 000 r/min离心10 min,取上清液。总的水平测定了肺组织中的GSH和GSSG波长为412 nm,计算GSH/GSSG的值。
1.8 炎症因子检测采用qRT-PCR方法检测炎症因子(IL-1β、IL-6、IL-18和MCP-1)和黏液蛋白(MUC5B)的mRNA水平。根据产品说明,用TRIzol试剂从组织中提取总RNA,测定总RNA的浓度。利用HiScript II qRT SuperMix II合成了单链互补DNA(cDNA),将得到的cDNA作为后续qRT-PCR分析的模板。RT-PCR过程采用ChamQ通用SYBR qPCR主混合物和ABI ViiATM7系统进行。引物序列见表1。

表1 炎症因子和黏液蛋白分子的引物序列
1.9 Western blot分析采用Western blot检测NLRP3、pro-Caspase 1、Caspase 1(p20)、GSDMD和Cleaved GSDMD的表达。取适量小鼠肺组织,RIPA缓冲液匀浆提取总蛋白,使用BCA蛋白检测试剂盒测定蛋白浓度。总蛋白质样品分离使用10%SDS-PAGE电泳后,将蛋白转移到PVDF膜,5%脱脂牛奶封闭2 h,放入一抗稀释液(1 ∶1 000)中,4 ℃摇床过夜。使用HRP偶联的山羊抗兔和抗鼠二抗(1 ∶3 000),在室温下孵育2 h。TBST洗涤膜后,用ECL检测系统观察条带。

2 结果
2.1 SS-31对O3介导的气道高反应和BALF炎症细胞数量的影响与PBS+Air组相比,O3暴露诱导了明显的气道高反应;与PBS+Air组相比,SS-31+Air组的气道反应性没有明显变化。与PBS+O3组相比,SS-31预处理抑制O3引起气道高反应。O3降低了-logPC100(1.957±0.302,P<0.05),而SS-31预处理升高了-logPC100(2.421±0.136,P<0.01)。O3增加了小鼠BALF中的细胞总数(34.750±3.655,P<0.01)、巨噬细胞数(20.733±3.355,P<0.05)、中性粒细胞数(8.708±1.960,P<0.01)、嗜酸粒细胞数(0.929±0.405,P<0.05)及淋巴细胞数(4.381±0.887,P<0.05)均增高。SS-31 预处理增加了小鼠BALF中的细胞总数(28.875±4.299,P<0.01)、中性粒细胞数(6.345±1.336,P<0.01)、嗜酸粒细胞数(0.601±0.214,P<0.05)及淋巴细胞数(2.615±1.314,P<0.01)均降低。见图1。
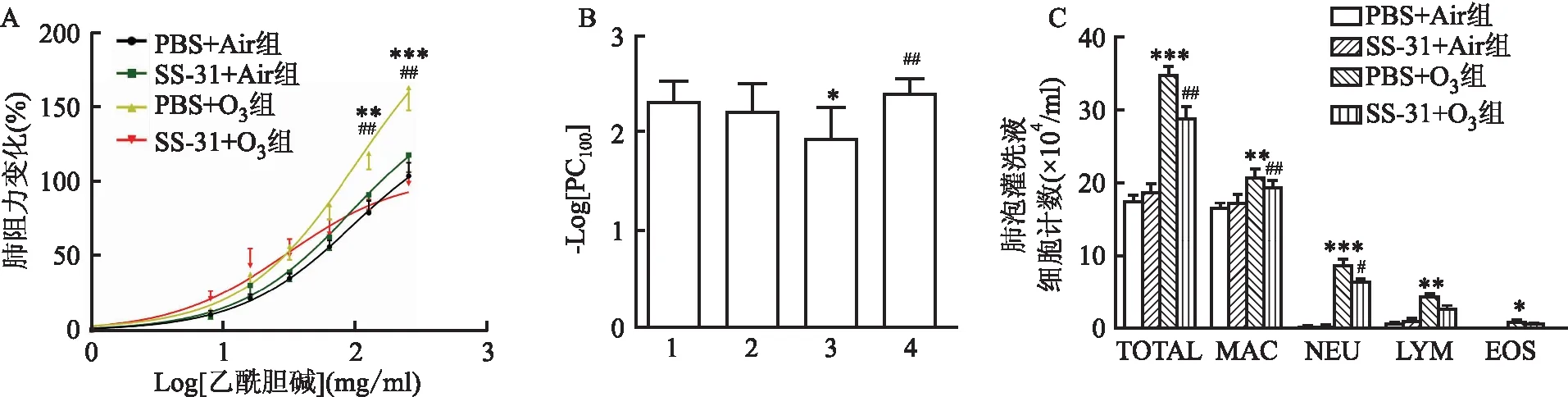
图1 SS-31抑制了O3诱导的气道高反应和BALF炎症细胞数
2.2 SS-31对O3介导的气道黏液产生的影响与PBS+Air组相比,O3暴露诱导明显的气道上皮黏液分泌,杯状细胞增生积分增加(0.611±0.251,P<0.001)。与PBS+Air组相比,SS-31+Air组的气道上皮黏液分泌没有明显变化。与PBS+O3组相比,SS-31预处理抑制O3引起的气道黏液高分泌,且气道上皮杯状细胞增生积分下降(0.167±0.183,P<0.001)。见图2。
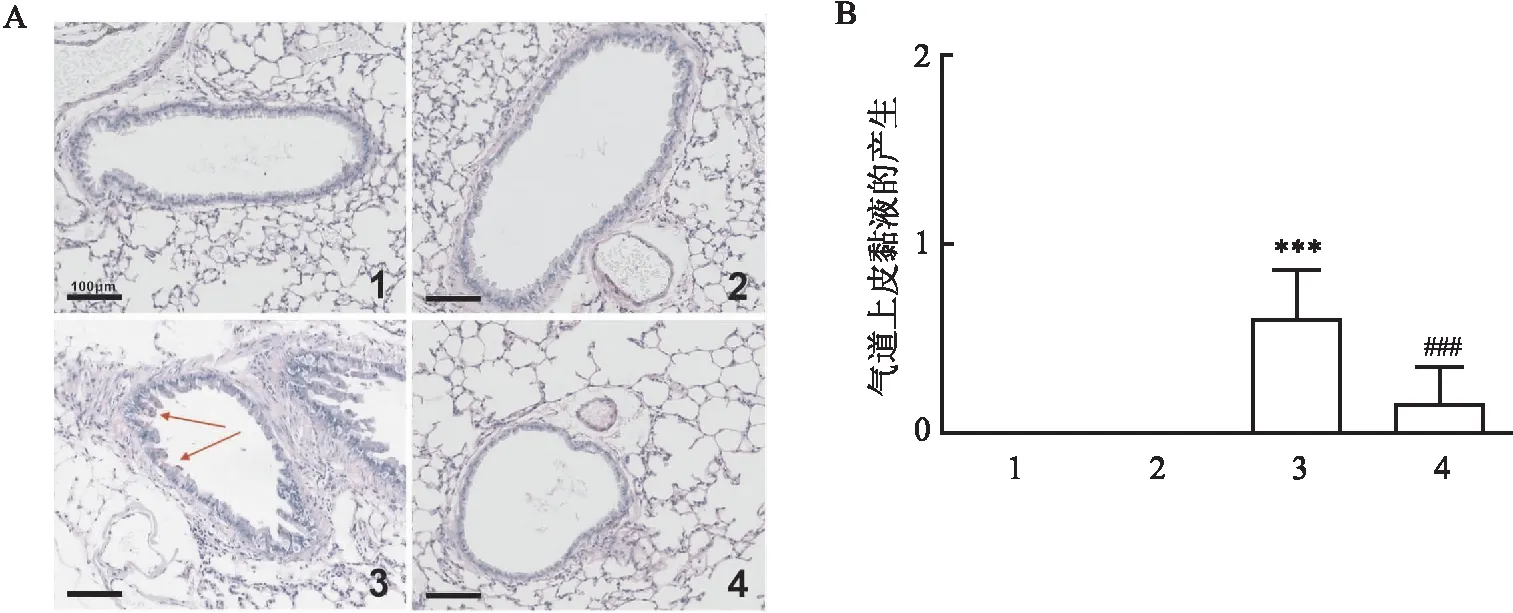
图2 SS-31抑制O3介导小鼠气道黏液产生
2.3 SS-31对O3介导的肺部氧化应激水平的影响O3增加了小鼠肺组织MDA水平(67.67±58.45,P<0.01),SS-31预处理降低O3暴露诱导的MDA水平(51.08±33.73,P<0.001)。O3降低了GSH/GSSG的比值(0.51±0.184,P<0.05),SS-31预处理提高了GSH/GSSG的比值(1.486±0.819,P<0.01)。见图3。
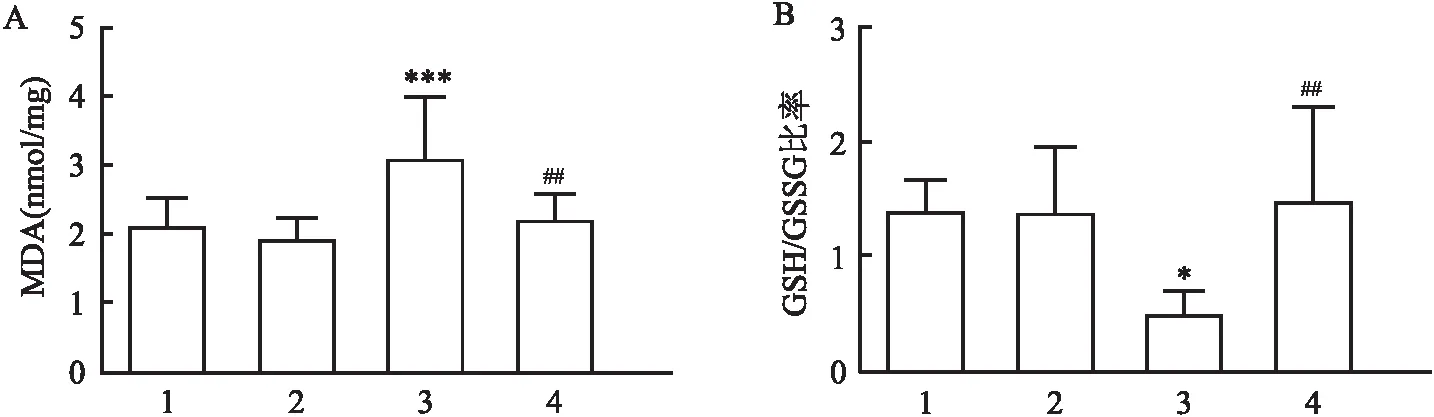
图3 SS-31对O3诱导的肺部氧化应激的影响
2.4 SS-31对O3介导的炎症因子和黏液蛋白水平的影响与PBS+Air组相比,PBS+O3组小鼠肺组织炎症因子,包括IL-1β(2.039±0.992,P<0.001)、IL-6(3.055±0.713,P<0.001)、IL-18(1.832±0.362,P<0.05)、MCP-1(1.843±0.409,P<0.01)和黏液蛋白MUC5B(2.434±1.786,P<0.05)的mRNA水平增加。SS-31预处理抑制O3暴露诱导的炎症因子IL-1β(1.238±0.646,P<0.05)、IL-6(1.702±0.71,P<0.01)、IL-18(0.739±0.321,P<0.001)、MCP-1(1.141±0.473,P<0.05)和黏液蛋白MUC5B(0.964±0.553,P<0.05)mRNA水平的表达。见图4。
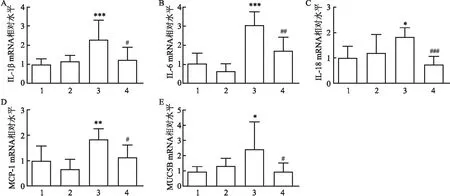
图4 SS-31对O3介导的肺部炎症因子和黏液蛋白表达水平的影响
2.5 SS-31对O3引起的NLRP3的表达及Caspase 1和GSDMD的活化水平的影响与PBS+Air组相比,PBS+O3组小鼠肺组织炎性小体NLRP3表达水平增加(1.007±1.131,P<0.05),Caspase 1(1.118±0.226,P<0.05)和GSDMD(0.967±0.272,P<0.05)的活化增强。SS-31预处理降低O3暴露引起的NLRP3(0.736±0.177,P<0.05)及Caspase 1(0.698±0.174,P<0.01)和GSDMD(0.592±0.205,P<0.01)的活化水平。见图5。
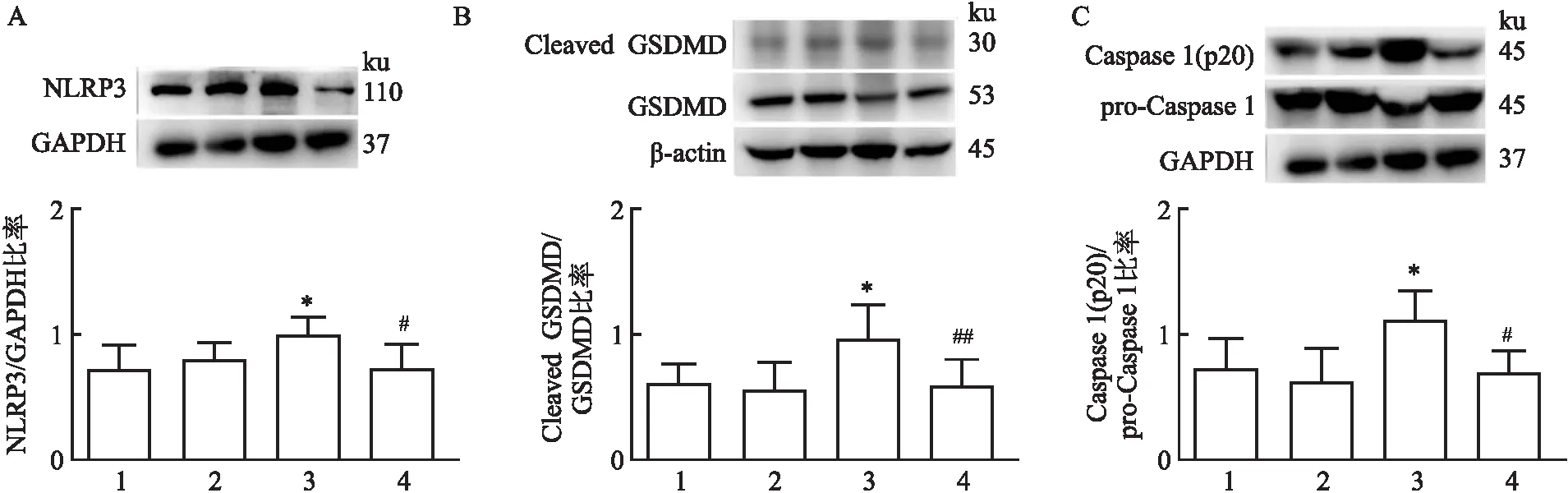
图5 NLRP3/Caspase 1/GSDMD蛋白表达水平
3 讨论
ROS在氧化应激、气道炎症、上皮细胞损伤、黏液分泌等过程中起着关键作用。炎症细胞在吞噬过程中产生大量ROS,同时,组织细胞如上皮细胞、平滑肌细胞在炎症状态下也可以产生ROS[6]。线粒体及其电子传递链是产生ROS的主要细胞器之一。O3诱导的氧化应激可能参与炎症小体NLRP3复合物的激活。小鼠急性臭氧暴露和慢性臭氧暴露均通过Caspase激活的炎症小体NLRP3激活ROS并诱导肺部炎症和氧化应激,该过程的发生、发展需要通过炎症小体NLRP3激活Caspase 1,促进pro-IL-1β和pro-IL-18向成熟的IL-1β和IL-18的转化,裂解的GSDMD穿透细胞膜[7]。在烟草暴露模型中,烟草能够激活炎症小体NLRP3,提高Caspase 1、IL-1β和IL-18的表达水平,并增强Caspase 1的活性[8]。因此,该研究使用MDA为氧化应激的标志物(膜脂质过氧化物指数),SS-31抑制O3介导的肺组织MDA水平。同时,SS-31也降低炎症小体NLRP3蛋白水平和Caspase 1、GSDMD活性水平表达增加。
气道高反应性是哮喘和气道炎症的一个重要特征,一些外部环境因素,如烟草、细菌和病毒感染,是气道高反应的高危因素。了解气道高反应性的发生机制对于阐明哮喘的发病是至关重要的,而气道高反应性的程度与哮喘的严重程度密切有关。然而,迄今为止,导致气道高反应的潜在分子机制尚未完全了解。近期研究[9]表明,臭氧暴露可增加急性期细胞因子,包括IL-1、IL-6、IL-8、IL-18和一些趋化因子。IL-6可以通过选择性地调节急慢性炎症中的趋化因子和细胞因子,在炎症反应中招募白细胞。IL-1和TNF-α等促炎细胞因子的合成和释放可以增加对Ach和气道中性粒细胞和肺泡巨噬细胞的反应性[10]。氧化应激可导致炎症反应加重并且诱导气道高反应。在对小鼠急性O3暴露模型的研究中,线粒体靶向抗氧化剂SS-31能够抑制由O3介导的气道高反应和BALF中炎症细胞,降低肺组织炎症因子(IL-1β、IL-6、IL-18和MCP-1)mRNA表达水平。
气道黏液高分泌是哮喘重要的病理特征。气道黏液主要是由糖蛋白、脂质、非糖蛋白、无机盐、水组成。在O3刺激下,小鼠气道黏液分泌增多,会引起纤毛功能障碍,阻塞气道,影响有效呼吸运动[11]。MUC5B是由杯状细胞产生,研究表明哮喘气道上皮杯状细胞增生明显,肺组织中MUC5B mRNA也会明显升高。然而,O3诱导的非嗜酸性粒细胞哮喘增强气道黏液分泌的潜在分子机制目前尚不清楚。有研究[12]表明,O3诱导的氧化应激可能参与黏液蛋白的分泌。MCP-1是CC趋化因子家族的一员,是一种重要的促炎细胞因子,主要是由肺上皮细胞产生,介导单核细胞到达受损组织,参与增加血管通透性,加重组织炎症。研究表明,在烟草刺激下,MCP-1可以通过其受体CCR2诱导趋化并激活支气管上皮细胞黏蛋白相关作用的激酶如MAPK,MCP-1表达增强与黏液蛋白MUC5AC和MUC5B蛋白表达增加有关[13]。而PM2.5可通过刺激气道上皮细胞从而引起黏液的过度分泌,同时,黏液蛋白MUC5B在控制PM2.5诱导的炎症反应中起着关键作用,具有控制炎症和维持免疫稳定性的功能[14]。此外,炎症小体NLRP3可以调节气道上皮细胞功能,NLRP3可介导鼻病毒诱导的炎症、焦亡和黏液分泌[15]。该研究表明O3不仅介导气道黏液高分泌,而且促进小鼠肺组织的黏液蛋白MUC5B、炎症小体NLRP3和IL-1β的表达。

