卒中伴阻塞性睡眠呼吸暂停综合征的生物学标志物研究进展
黄真灿,张亚男,孙晴晴,吴小丹,王赞
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)是一种与睡眠相关的呼吸障碍,主要表现为由上呼吸道反复阻塞或狭窄导致的睡眠期间气流完全或不完全停止,但胸腹式呼吸运动依然存在。既往研究已经证实OSAS是脑梗死的独立危险因素[1]。OSAS导致卒中的机制较为复杂,包括血流动力学、血管内皮、神经、炎症、代谢、血栓性改变等[2]。睡眠期间重复性阻塞性呼吸暂停和低通气,可能导致间歇性缺氧及睡眠片段化,导致氧化应激及血流动力学变化[3]。交感神经系统的激活与这些呼吸事件有关,导致血压和心率升高,内皮素和一氧化氮水平降低,进而导致血管功能受损[4]。在OSAS患者中观察到炎症级联反应,包括TNF、核转录因子κB、自由基、脂质过氧化反应,血管黏附因子和血管内皮生长因子升高以及抗氧化能力下降[5]。活性氧的形成激活转录因子,通过促进内皮细胞、白细胞和血小板的活化来影响炎症和免疫反应,从而导致动脉粥样硬化形成和血栓形成。根据美国睡眠医学学会指南对呼吸事件的评分标准,多导睡眠监测(polysomnography,PSG)中记录的呼吸暂停低通气指数是诊断OSAS严重程度的“金标准”。但PSG检查过程时间长,需要耗费大量人力及物力,部分患者配合度较差,无法完成,很难用于大规模流行病学调查及筛查等,因此需要一种简便的具有筛选和诊断意义的检查工具。Jurado-Gamez等[6]研究已证实OSAS患者血清中存在多种差异表达的蛋白,并可能参与OSAS致病的某一环节,如代谢途径、炎症途径及凝血途径等,或通过正反馈加重OSAS,其可能解释OSAS与脑血管疾病的相关性。本文就载脂蛋白B(apolipoprotein B,ApoB)、纤维连接蛋白、铜蓝蛋白、免疫球蛋白λ轻链、丝聚蛋白、甲状腺素转运蛋白、E-选择素、组织型纤溶酶原激活物(tissuetype plasminogen activator,t-PA)、纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,PAI-1)在卒中伴OSAS中的作用进行综述(图1)。
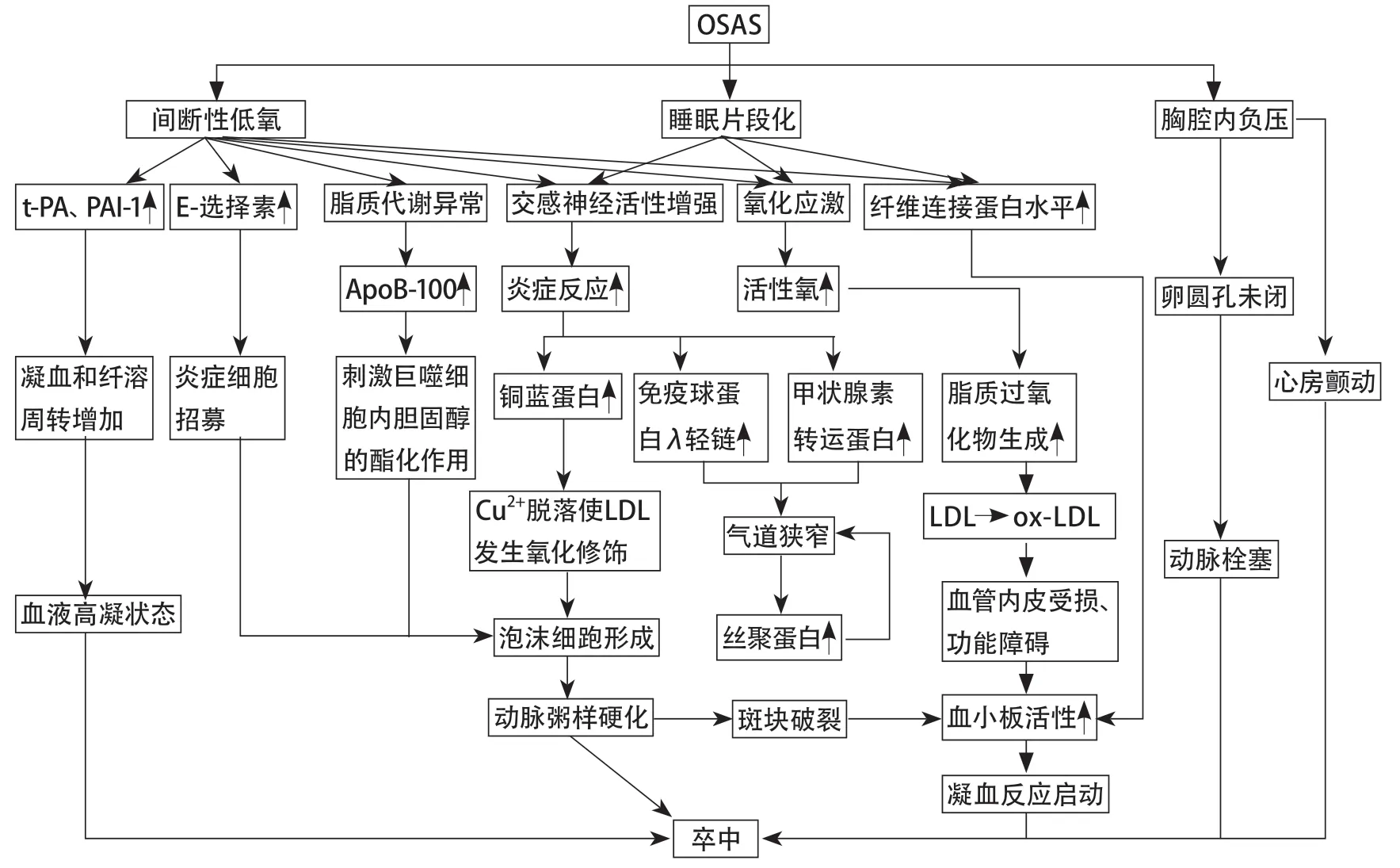
图1 OSAS导致卒中相关生物学标志物机制
1 卒中伴阻塞性睡眠呼吸暂停综合征代谢途径的生物学标志物
1.1 载脂蛋白B ApoB主要由肝细胞合成与表达,是除HDL-C之外其他载脂蛋白的重要组成部分,其中在LDL-C中比例最高。因此ApoB是所有导致动脉粥样硬化脂蛋白中的关键载脂蛋白[7]。此外,载脂蛋白AI(apolipoprotein AI,ApoAI)是抗动脉粥样硬化的HDL-C的主要组成成分,因此,ApoB与ApoAI的比值也代表了潜在的致动脉粥样硬化因子和保护因子之间的平衡关系。在一项大规模研究中,OSAS患者的ApoAI水平低于非OSAS患者,而ApoB水平高于非OSAS患者[8]。此外,Cao等[9]研究也表明OSAS与ApoB水平的升高和ApoAI水平的降低有关,因此与ApoB/ApoAI增加有关,并进一步促进全身血管动脉粥样硬化。其中大动脉粥样硬化是导致脑梗死的最主要原因,因此OSAS患者心脑血管疾病的风险增加与ApoB水平增加相关。
1.2 铜蓝蛋白 铜蓝蛋白是一种具有抗炎特性的血浆蛋白,作为铜转运蛋白发挥作用,对正常铁稳态至关重要[10-11]。铜蓝蛋白被发现与动脉粥样硬化有关[12]。Lavie等[12]研究发现吸烟者的铜蓝蛋白水平和TG水平明显高于非吸烟者,患有严重睡眠呼吸暂停的吸烟者铜蓝蛋白水平最高,高密度脂蛋白水平最低。本课题组研究表明OSAS患者铜蓝蛋白水平升高。在阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)患者中,由于急性炎症,细胞表面的糖脂脱落增加,导致血液中唾液酸异常增加。活化的唾液酸转移酶降解和去催化铜蓝蛋白,从而影响其正常降解过程,导致血清铜蓝蛋白水平升高[13]。
1.3 纤维连接蛋白 纤维连接蛋白是一种多态性高分子量糖蛋白,以可溶性形式存在于血浆和其他体液中,也以不溶性形式存在于大多数组织的细胞外基质中,其是内皮细胞活化的蛋白质标志物[14]。使用免疫组织学技术,已经证明纤维连接蛋白在动脉内膜粥样硬化病变中很突出,尤其是在发展中的纤维斑块,在卒中疾病中起重要作用[15-16]。Zhang等[17]应用串联质谱标记定量蛋白质组学技术发现在OSAS组和非OSAS组之间纤维连接蛋白表达水平的差异具有统计学意义。本课题组既往研究发现纤维连接蛋白在OSAS患者中水平升高,且轻度OSAS患者较中重度OSAS患者升高更显著,考虑可能有代偿机制参与[18]。OSAS患者血清纤维连接蛋白水平升高的机制是缺氧在转录水平上增加纤维连接蛋白合成,并促进纤维连接蛋白分泌到细胞外液中[17]。一项研究发现,纤维连接蛋白的主要降解酶(包括MMP-2和MMP-9)在OSAS患者中水平增加,这表明细胞外纤维连接蛋白水平的增加不是由降解减少引起的,缺氧可以促进肌成纤维细胞中纤维连接蛋白的合成和分泌[19]。
2 卒中伴阻塞性睡眠呼吸暂停综合征炎症途径的生物学标志物
2.1 免疫球蛋白λ轻链 免疫球蛋白单体由2条相同的轻链及2条相同的重链组成。免疫球蛋白轻链分为λ型和κ型两类,前者为各类免疫球蛋白所共有。免疫球蛋白λ轻链主要通过炎症通路免疫反应而生成,OSAS患者在长期反复间歇低氧刺激下,机体免疫系统长期处于激活状态,进一步导致免疫球蛋白λ轻链生成增加,过多的免疫球蛋白λ轻链会沉积在内脏和软组织内,如果沉积在咽部软组织会进一步加重气道狭窄,进而加重OSAS,形成恶性循环[20]。
2.2 丝聚蛋白 丝聚蛋白是一种重要的表皮蛋白,对表皮的屏障功能起着重要作用[21]。OSAS患者在睡眠中反复发生上气道部分或完全闭塞,咽部塌陷。咽部主要的软性结构为软腭,软腭表面覆盖黏膜。正常软腭上皮黏膜层完整,细胞层状整齐排列,黏膜下层组织疏松,可见黏液性腺泡整齐排列[22]。随着OSAS严重程度增加,血氧下降,软腭黏膜层鳞状上皮细胞由正常演变为肿胀、变形、过度角化。黏膜下疏松结缔组织中炎症细胞浸润,并可见大量脂肪空泡[23]。轻度OSAS组软腭上皮黏膜层完整,细胞层状整齐排列,为复层鳞状上皮,黏膜下层组织疏松,固有层增厚,有少量脂肪细胞分布。中度OSAS组鳞状上皮细胞肿胀、角化,基底层细胞少许液化变性,固有层增厚,黏膜及黏膜下结缔组织中少量淋巴细胞浸润。重度OSAS组鳞状上皮细胞明显肿胀,形态不规则,过度角化,基底层细胞液化变性,固有层增厚,黏膜下可见大量脂肪空泡[24]。由此可以看出随着OSAS严重程度的增加,软腭上皮细胞角化程度亦加重。丝聚蛋白是体现细胞角化程度的指标,其在OSAS中的表达可能增加,但仍需要进一步研究证实。
2.3 甲状腺素转运蛋白 甲状腺素转运蛋白又称前白蛋白,是一种由127个氨基酸组成的四聚体蛋白质,其主要作用是作为转运甲状腺素和视黄醇的载体蛋白。研究发现中度/重度OSAS患者的血浆视黄醇结合蛋白-4水平高于健康对照组,且与内脏脂肪面积和血浆TG水平呈正相关。OSAS合并代谢综合征患者的血浆视黄醇结合蛋白-4水平高于无代谢综合征患者。已有研究指出呼吸暂停本身刺激视黄醇结合蛋白分泌,实际通路为间歇低氧诱导核转录因子-κB激活,刺激细胞因子(如视黄醇结合蛋白)的释放[25],进而引起其载体甲状腺素转运蛋白表达增加,尤其在合并代谢综合征的患者中更显著。视黄醇结合蛋白-4与血脂异常有关,从而在OSAS相关卒中发生发展中发挥重要作用[26]。
3 卒中伴阻塞性睡眠呼吸暂停综合征凝血途径的生物学标志物
3.1 E-选择素 E-选择素是一种表达于内皮细胞,并依赖于Ca2+的异亲型细胞黏附分子,能够特异性地识别并结合到其他细胞表面的特定糖基。E-选择素通过促进血液中白细胞与血管内皮细胞的黏附来促进动脉粥样硬化,然后迁移到内皮下并有利于动脉粥样硬化病变的形成。Peres等[27]研究表明OSAS患者中的黏附分子如可溶性细胞间黏附分子-1、血管细胞黏附分子-1、E-选择素水平升高,尽管这3种黏附分子都与BMI有关,但只有E-选择素与OSAS的严重程度独立相关。此外,在OSAS患者中还发现血液循环中E-选择素及其他黏附分子的增加与颈动脉内膜中层厚度增加有关,这也是亚临床动脉粥样硬化的标志[28]。纳入650例OSAS患者的荟萃分析显示持续气道正压通气(continuous positive airway pressure,CPAP)治疗显著降低了OSAS患者循环血液中可溶性细胞间黏附分子-1和E-选择素的水平。因此,可溶性细胞间黏附分子-1和E-选择素可能是评价CPAP治疗降低OSAS患者心血管危险性的有效指标[29]。
3.2 组织型纤溶酶原激活物 t-PA作为丝氨酸蛋白酶家族的一员,主要是通过使纤溶酶原活化为纤溶酶降解血栓,保证血管的通畅性。Bagai等[30]的研究结果表明OSAS患者的PAI-1和t-PA水平显著高于非OSAS患者,CPAP治疗后OSAS患者血液系统高凝性得到改善。一项横断面研究发现阻塞性睡眠呼吸暂停还对纤维蛋白溶解系统平衡的昼夜节律产生不利影响,使平均PAI-1活性和抗原滴度更高,但平均t-PA活性显著降低[25],因此后续需要进一步研究OSAS对t-PA的影响[30]。阻塞性睡眠呼吸暂停中的间歇性缺氧和昼夜时钟基因活性的变化可能是导致这些变化的原因,纤维蛋白溶解系统平衡的良好变化可能也是CPAP治疗中心脑血管事件减少的基础。因此,OSAS患者的纤维蛋白溶解失衡促进血管内血栓的形成。
3.3 纤溶酶原激活物抑制剂-1 PAI-1是纤溶系统的主要抑制物,通过抑制纤溶酶的活化,使尿激酶型纤溶酶原激活物和t-PA失活并抑制纤维蛋白溶解。Bagai等[30]的研究结果表明PAI-1与呼吸暂停低通气指数、血氧饱和度<90%的时间百分比和氧饱和度指数呈显著正相关,且经过CPAP治疗后,PAI-1数值显著下降。Ifergane等[31]发现卒中伴OSAS患者PAI-1、TNF和IL-6水平均升高。大量证据表明OSAS患者的PAI-1水平升高,且PAI-1还可以通过血管系统内非依赖性抗纤溶物质的复杂相互作用诱导内皮功能障碍和动脉粥样硬化[32]。因此,PAI-1通过纤溶系统紊乱、内皮功能障碍、动脉粥样硬化及系统炎症等病理生理机制促进卒中的发生。
4 卒中伴阻塞性睡眠呼吸暂停综合征内皮损伤途径的生物学标志物
慢性缺血缺氧影响血管的形态和功能,交感神经过度激活和胰岛素抵抗,氧化应激和炎症及一氧化氮依赖的血管扩张会导致血管内皮功能进一步减弱。研究显示,硝基酪氨酸、蛋白质碳基、硫代巴比妥酸、异构前列腺素在卒中伴OSAS的内皮损伤机制中起重要作用。
总之,卒中与OSAS既存在共同的发病机制,又存在差异。OSAS促发卒中,也促进脑血管病的危险因素如冠心病、糖尿病、高脂血症等的发生,影响患者生活质量。应积极开展标准PSG和院外OSAS的筛查,卒中伴OSAS若能够通过血清标志物筛查预测、诊断和随访OSAS,将有助于卒中伴OSAS的早期诊断及治疗,从而改善卒中及相关并发症,以及患者的预后。
【点睛】本文重点阐述阻塞性睡眠呼吸暂停综合征导致卒中的病理生理机制中的生物标志物,为卒中合并阻塞性睡眠呼吸暂停综合征的筛查提供了研究方向。

