山豆根多糖对猪圆环病毒Ⅱ型感染3D4/2细胞增殖活性及炎症信号通路基因调控作用的研究
韦秋旭,赵 怡,杨 剑,陈虹伶,李禧梦,冯国越,胡焜翔,胡庭俊
( 广西大学动物科学技术学院,广西 南宁 530005 )
猪圆环病毒Ⅱ型(porcine circovirus type 2,PCV2)是猪圆环病毒相关疾病(PCVAD)的主要病原体,对全球养猪业造成重大经济损失[1]。PCV2 亦与其他病毒产生共感染,如与猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)的混合感染在国内外均造成了巨大的经济损失[2]。且由于病毒基因组不断进化,疫苗在猪生产中难以起到很好的保护作用[3],因此寻找控制疾病发展的新方法迫在眉睫。
有研究表明,天然化合物具有良好的抗病毒作用[4-5],中草药中的抗病毒天然化合物的筛选备受关注。山豆根(Sophorae tonkinesisRadix.)是豆科植物越南槐(Sophora tonkinensisGapnep.)的干燥根与根茎,又称广豆根、苦豆根,具有清热解毒、消肿止痛的功效[6]。山豆根多糖(SSP)是从山豆根中提取出的有效多糖成分,具有抗氧化、抗病毒、增强机体免疫等[7-8]活性。课题组前期研究发现,SSP能够降低PCV2感染诱发的RAW264.7细胞的炎症反应[7]。本试验旨在研究SSP对猪肺泡巨噬细胞系3D4/2细胞体外增殖活性的影响及SSP对PCV2感染诱发的炎症相关信号通路基因的调控,旨在为SSP的临床应用提供参考。
1 材料与方法
1.1 试验材料
PCV2(SH 株)由南京农业大学农业部动物疫病诊断与免疫重点开放实验室惠赠,由广西大学动物科学技术学院基础兽医药理实验室经PK-15 细胞增殖保存,通过Reed-Muench法测定病毒滴度为104TCID50/0.1 mL。
试验所用SSP由广西大学实验室提取并保存,内毒素含量<0.005 μg/g。
3D4/2 细胞为猪肺泡巨噬细胞系传代细胞,由广西大学动物科学技术学院基础兽医药理实验室冻存传代。
1.2 主要试剂与仪器
CCK-8 试剂盒(上海碧云天生物技术);RNAiso plus(北京宝日医生物技术有限公司);5× All-in-One Master Mix 及BlastaqTMGreen 2× qPCR Master Mix(爱必梦生物科技有限公司)。
Multimode Plate Reader 多功能酶标仪(瑞士PerkinElmer);超微量紫外分光光度计(美国GE 公司);梯度PCR 仪、CFX96TMReal-Time System(美国BIO-RAD 公司);3K-15 台式高速冷冻离心机(德国Sigma公司)。
1.3 CCK-8 法测定SSP 对PCV2 感染3D4/2 细胞活性的影响
将3D4/2 细胞以1×105cell/mL,以每孔100 μL 铺于96孔板中,共设7组,每组12个重复,于37 ℃、5%CO2条件下培养过夜。经DMEM 完全培养液或PCV2 处理2 h 后,分别加入含药物或不含药物培养液继续培养0、12、24、48 h,终止培养后按照CCK8 试剂盒说明书测定细胞增殖活性。具体试验分组及处理见表1。

表1 SSP对PCV2感染3D4/2细胞活性的影响试验分组与处理Tab.1 Grouping and treatment of the effect of SSP on the activity of 3D4/2 cells infected with PCV2
1.4 qRT-PCR 检测SSP 对PCV2 感染3D4/2 细胞通路相关基因的影响
将3D4/2 细胞以2×105cell/mL,以每孔1 mL 铺于12 孔板中,共设5 组,每组3 个重复,试验分组及处理见表2。

表2 SSP对PCV2感染3D4/2细胞通路相关基因的影响试验分组与处理Tab.2 Grouping and treatment of genes related to the pathway of 3D4/2 cells infected with PCV2 by SSP
作用24 h 后,弃去培养液,PBS 清洗3 次后加入RNAiso Plus 裂解5 min,按照说明书提取总RNA,反转录得到cDNA后按照表3引物进行荧光定量PCR扩增。

表3 引物序列Tab.3 Primer sequence
反应体系(20 μL):酶10 μL、上游引物0.5 μL、下游引物0.5 μL、cDNA 1 μL、ddH2O 8 μL。
扩增条件:95 ℃预变性2 min,95 ℃变性15 s,60 ℃延伸30 s,共40个循环。熔解曲线按照仪器自身设置进行。
1.5 数据统计与分析
试验数据采用SPSS 23.0 软件进行单因素方差分析,LSD法进行多重比较。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 SSP 对PCV2 感染3D4/2 细胞增殖活性的影响(见图1)
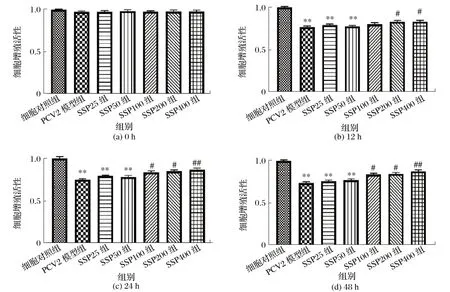
图1 SSP对PCV2感染的3D4/2细胞增殖活性的影响Fig.1 Effect of SSP on proliferation activity in PCV2 infected-3D4/2 cells
为评估SSP 对PCV2 感染的猪肺泡巨噬细胞系3D4/2细胞体外增殖活性调节作用,使用CCK-8 法测定了不同浓度SSP对PCV2感染的3D4/2细胞活性的影响。
由图1(a)可知,各组细胞未经病毒感染和药物作用时,细胞活性水平均在0.95 以上,且各组间差异均不显著(P>0.05)。
由图1(b)可知,PCV2感染3D4/2细胞12 h后,与细胞对照组相比,PCV2模型组细胞活性极显著降低(P<0.01);与PCV2 模型组相比,SSP200 组及SSP400 组细胞活性均显著升高(P<0.05)。
由图1(c)可知,PCV2感染3D4/2细胞24 h后,与细胞对照组相比,PCV2模型组细胞活性极显著降低(P<0.01);与PCV2 模型组相比,SSP100 组及SSP200 组细胞活性显著 升 高(P<0.05),SSP400 组 细 胞 活 性 极 显 著 升 高(P<0.01)。
由图1(d)可知,PCV2感染3D4/2细胞48 h后,与细胞对照组相比,PCV2模型组细胞活性极显著降低(P<0.01);与PCV2 模型组相比,SSP100 组及SSP200 组细胞活性显著 升 高(P<0.05),SSP400 组 细 胞 活 性 极 显 著 升 高(P<0.01)。
综上所述,SSP 浓度小于50 mg/L 时在各时间点对3D4/2 细胞活性无显著影响,与PCV2 模型组相比差异均不显著(P>0.05);经100~400 mg/L SSP 处理后,细胞活性在12 h 开始升高,且随着时间增加细胞活性逐渐升高,但均低于正常活性,表明100~400 mg/L SSP 能够显著提高PCV2感染的3D4/2细胞体外增殖活性。
2.2 SSP对PCV2感染3D4/2细胞炎症相关信号通路的影响(见图2、图3)
图2 β-actin、p38和p65基因熔解曲线Fig.2 Melt curves of β-actin, p38 and p65 gene
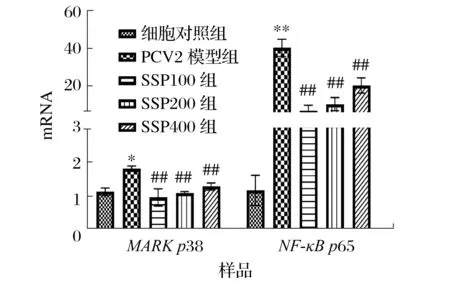
图3 SSP对PCV2感染的3D4/2细胞炎症信号通路基因表达的影响Fig.3 Effect of SSP on inflammatory pathway gene expressions in PCV2-infected 3D4/2 cells
病毒感染能够诱发细胞内信号通路激活,本试验使用qRT-PCR 检测通路基因表达的变化以得到通路激活情况,结果见图2。由图2可知,荧光定量PCR熔解曲线峰单一无杂峰,引物设计合理,无非特异性产物。
由图3 可知,与细胞对照组相比,PCV2 感染24 h 后3D4/2 细胞MAPK p38 mRNA 表达水平显著上升(P<0.05);与PCV2模型组相比,不同浓度SSP作用后,p38表达水平极显著下降(P<0.01)。与细胞对照组相比,PCV2感染24 h后的3D4/2细胞内NF-κB p65 mRNA表达水平极显著上升(P<0.01);与PCV2 模型组相比,各浓度SSP 作用后能够极显著降低3D4/2 细胞内NF-κB p65 mRNA表达水平(P<0.01)。
3 讨论
细胞增殖是细胞生长的重要生理功能之一,是了解基因、蛋白质和通路作用机制的重要手段[9]。中草药多糖具有提高细胞活性、提升抗氧化能力、抗病毒能力等多种生物活性[10]。Deng 等[11]研究发现,黄芪多糖能够通过促进miR-136-5p 和miR-149-5p 等miRNA 的表达,进而改善高糖和棕榈酸诱导的小鼠胰腺β 细胞凋亡,促进细胞增殖。灵芝多糖-金纳米复合材料能够促进脾细胞中CD4+和CD8+T 细胞的增殖,进而抑制癌症的进程[12]。委陵菜多糖能够增加RAW264.7 细胞NO 的分泌,并增进脾淋巴细胞增殖,激活NF-κB 信号通路[13]。本课题组前期研究发现,SSP在25~400 mg/L浓度范围内对细胞无毒性作用[14]。本研究探讨了SSP 对PCV2感染3D4/2细胞后细胞活性的调节作用,结果显示,100~400 mg/L SSP能够显著调节PCV2感染诱发的细胞活性降低现象,并且呈剂量依赖性。
有研究表明,病毒感染与炎症密切相关。细胞因子通过细胞外信号调节激酶(ERK1/2)、p38丝裂原活化蛋白激酶(MAPK)和磷脂酰肌醇3-激酶(PI3K)/Akt 途径诱导核因子-kB(NF-κB)活性,NF-κB通过释放各种可诱导的炎性细胞因子在炎症反应中起到关键作用[15-16]。NF-κB 信号通路和MAPK 信号通路是重要的炎症信号通路。研究发现,LPS 通过激活NF-κB 与MAPKs 途径导致促炎介质和细胞因子的过量产生[17]。而病毒刺激能够诱发细胞炎症反应,激活NF-κB信号通路途径,药物可通过抑制NFκB活化从而抑制病毒等引发的炎症反应。山柰酚能够通过p38 MAPK 信号通路降低炎性因子的表达发挥抗炎和神经保护作用[18]。江勇等[19]研究发现,白术多糖能够抑制白细胞介素-6(IL-6)和白细胞介素-1β(IL-1β)等细胞因子的合成,通过抑制TLR4/NF-κB 信号通路的活化,进而保护大鼠肠黏膜的免疫功能。
本研究结果显示,PCV2 感染后3D4/2 细胞中p65 和p38 基因的转录水平显著增多,而SSP 作用24 h 能够显著降低其表达,表明SSP 可抑制PCV2 感染诱导的3D4/2 细胞炎症信号通路激活,其抗炎作用与抑制NF-κB 和MAPK通路的激活相关,这可能是山豆根多糖抗炎活性与抗病毒的重要机制,可为SSP的临床应用提供参考。
4 结论
本研究结果表明,100~400 mg/L SSP 作用12~48 h 能够显著提升PCV2 感染诱发的3D4/2 细胞活性,并在作用24 h时显著降低PCV2感染诱发的3D4/2细胞中p65和p38基因的表达,但SSP 是否是通过NF-κB 和MAPK 信号通路调节PCV2诱发的炎症反应仍需进一步试验加以研究。

