大黄素调控miR-16-5p/STAT3对心肌梗死大鼠模型保护作用机制研究
谢小芳 赵展庆 符妹垂
心肌梗死后心肌组织出现大面积变性坏死,造成严重的心力衰竭及心率失常,随时危及患者生命[1,2]。持续性缺血缺氧触发的心肌组织强烈炎性级联反应是造成心肌梗死后心功能损伤的主要病理基础,抗炎干预可有效减轻心肌梗死后心肌细胞凋亡和心肌组织损伤,改善心功能[3,4]。研究显示miR-16-5p在缺血性心肌损伤中起着重要的调节作用,下调miR-16-5p表达可有效保护心肌细胞免受缺氧/复氧诱导的损伤[5],抑制Janu激酶2(Janus Kinase 2,JAK2)/信号转导子和转录激活子3(signal transducer and activator of transcription 3,STAT3)信号激活可抑制缺血缺氧诱导的心肌细胞凋亡,有效保护心肌梗死大鼠心脏[6];另有研究证明,miR-16-5p可调控STAT3表达,进而介导神经系统疾病和糖尿病的发生发展[7],因此下调miR-16-5p/STAT3信号可能是防治心肌梗死后心损伤的有效策略。大黄素具有显著抗炎、抗心肌缺血、抗凋亡特性,能用于心血管疾病的防治[8],可发挥抗氧化应激以及抗凋亡功效而促使缺氧复氧心肌细胞存活[9],还可抑制JAK2/STAT3信号激活并缓解小鼠动脉粥样硬化病变[10],因而推测大黄素可能通过miR-16-5p抑制STAT3而对心肌梗死大鼠发挥保护作用,本文以不同剂量大黄素处理心肌梗死模型大鼠,对此推测做验证。
1 材料与方法
1.1 实验动物 Wistar大鼠,体重205~220 g,雄性,7周龄左右,SPF级,购自杭州启真实验动物科技有限公司,合格证号:SCXK(浙)2022-0005。大鼠在屏障环境的动物房内饲养,饲养条件:照明为昼夜12 h/12 h交替,温度22.5~25.5℃、相对湿度55%~65%。
1.2 主要材料及试剂 miR-16-5p agomir、miR-16-5p agomir阴性对照、miR-16-5p及U6引物由上海吉玛制药技术有限公司提供;大黄素(纯度≥98%,货号E8390)、一步法荧光定量PCR试剂盒(货号T2210)、2,3,5氯化三苯基四氮唑(2,3,5-Triphenyl-2H-Tetrazolium Chloride,TTC)染色液(2%,货号G3005),北京索莱宝科技有限公司;Trizol试剂(货号:AHF1813A),美国Invitrogen公司;大鼠肿瘤坏死因子-α(TNF-α)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(货号ab236712)、HE染色试剂盒(货号ab245880)、大鼠白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒(货号ab255730)、TUNEL染色试剂盒(货号ab206386)、兔抗大鼠Anti-β-actin一抗(货号ab8227)、兔源抗大鼠Anti-p-STAT3抗体(货号ab76315)、兔源抗大鼠Anti-Caspase-3抗体(货号ab184787)、兔源抗大鼠Anti-STAT3抗体(货号ab68153)、辣根过氧化物酶标记小鼠抗兔二抗(货号ab99697)、兔源抗大鼠Anti-Bax抗体(货号ab32503),美国Abcam公司等。
1.3 主要仪器 小动物呼吸机(型号R407),购自深圳瑞沃德生命科技有限公司;超高分辨率小动物超声成像系统(型号Vevo3100),购自加拿大Visualsonics Inc公司;石蜡切片机(型号ARM-2216),购自湖北安立信医疗实业有限公司;实验室双目生物显微镜(型号CM1000),购自深圳市星明光学仪器有限公司;酶标仪(型号HBS-1096C),购自南京德铁实验设备有限公司;标准型垂直电泳系统(型号SE400)、全湿电转印系统(型号TE62),购自美国Amersham公司等。
1.4 方法
1.4.1 分组及处理:将大黄素、miR-16-5p agomir、miR-16-5p agomir阴性对照溶于0.9%氯化钠溶液,制为6、12 ml/kg大黄素药液、20 nmol/ml miR-16-5p agomir药液和20 nmol/ml miR-16-5p agomir阴性对照药液备用。大鼠随机分为假手术组、模型组、大黄素低剂量组、大黄素高剂量组、miR-16-5p agomir组、miR-16-5p agomir阴性对照组、大黄素高剂量+miR-16-5p agomir组,每组12只。大黄素低剂量组、大黄素高剂量组大鼠灌胃30、60 mg/kg大黄素(6、12 ml/kg的大黄素药液均5 ml/kg,1次/d)[11],同时尾静脉注射5 ml/kg的0.9%氯化钠溶液(2次/周);miR-16-5p agomir组、miR-16-5p agomir阴性对照组大鼠灌胃5 ml/kg的0.9%氯化钠溶液(1次/d),同时尾静脉注射miR-16-5p agomir及miR-16-5p agomir阴性对照各100 nmol/kg(20 nmol/ml miR-16-5p agomir药液和20 nmol/ml miR-16-5p agomir阴性对照药液均5 ml/kg,2次/周)[12];大黄素高剂量+miR-16-5p agomir组灌胃60 mg/kg大黄素(12 ml/kg的大黄素药液5 ml/kg,1次/d),另尾静脉注射miR-16-5p agomir 100 nmol/kg(20 nmol/ml miR-16-5p agomir药液5 ml/kg,2次/周);假手术组和模型组大鼠灌胃5 ml/kg的0.9%氯化钠溶液(1次/d),同时尾静脉注射5 ml/kg的0.9%氯化钠溶液(2次/周),7组均干预处理1周。
1.4.2 超声检测心功能:药物处理后24 h,参照文献[13]建立心肌梗死模型:以3%戊巴比妥钠腹腔注射麻醉(剂量为1.6 ml/kg),气管插管后连接小动物呼吸机辅助呼吸,胸部脱毛备皮后于左侧胸骨第3、4肋间开胸,暴露心脏后找到,冠状动脉左前降支,对其进行结扎,直至左心室前壁由红变苍白及心电图ST段抬高即表示造模成功,假手术组大鼠开胸后仅穿线不结扎,30 min后放开结扎线缝合,恢复心脏血流2 h后采用小动物超声成像系统检测大鼠心功能指标:左心室收缩末期内径(LVDS)、左心室射血分数(EF)、左心室舒张末期内径(LVDD),测3个心动周期取平均值。
1.4.3 采集标本:心功能检测结束后,每组取6只大鼠采集其颈动脉血,离心得到血清标本,-80℃冰箱备用;开胸取出心脏,取梗死区附近的心肌组织约0.6 g加入RAPI缓冲液研碎匀浆,离心得到蛋白样品液,以BCA法测出总蛋白浓度后存在-80℃冰箱备用;再次取梗死区附近的心肌组织约0.4 g于液氮中备用;剩余心肌组织蒸馏水清洗、10%甲醛固定、梯度(80%、90%、95%、100%)乙醇脱水、热石蜡包埋、切片备用。
1.4.4 TTC染色检测7组大鼠心肌梗死面积:每组剩余的6只大鼠开胸取出心脏,沿冠状面切为厚片,分别浸没入2%的TTC染色液中避光孵育20 min染色,然后以10%甲醛固定后拍照,计算心肌梗死面积,公式为:心肌梗死面积=梗死面积/切片总面积×100%。
1.4.5 HE和TUNEL染色分别检测7组大鼠心肌组织病理变化、心肌细胞凋亡:取出1.4.3中的心肌组织石蜡切片,二甲苯脱蜡、梯度(100%、95%、80%、75%)乙醇水化,分别进行HE和TUNEL染色(各染3张),洗片后采用实验室双目生物显微镜摄取HE和TUNEL染色后的切片,并采用Image J软件分析TUNEL染色后的切片图像并定量其视野中凋亡细胞数及总心肌细胞数,计算心肌细胞凋亡率,公式为:心肌细胞凋亡率=凋亡细胞数/总心肌细胞数×100%。
1.4.6 ELISA法测定7组大鼠血清及心肌组织炎性因子IL-1β、TNF-α水平:取出1.4.3中存在-80℃的血清和心肌组织样品液并解冻,每组取0.24 ml,采用ELISA试剂盒测定血清及心肌组织中IL-1β、TNF-α水平,参照各自试剂盒说明书中步骤进行。
1.4.7 实时荧光PCR检测7组大鼠心肌组织miR-16-5p水平:取1.4.3中存在液氮的心肌组织,加入Trizol试剂研磨后提取并测出总RNA浓度,每组取适量总RNA采用一步法荧光定量PCR试剂盒检测出每组大鼠miR-16-5p、 U6基因Ct值,以U6做内参对照并以2-ΔΔCt法量化miR-16-5p的相对表达。见表1。
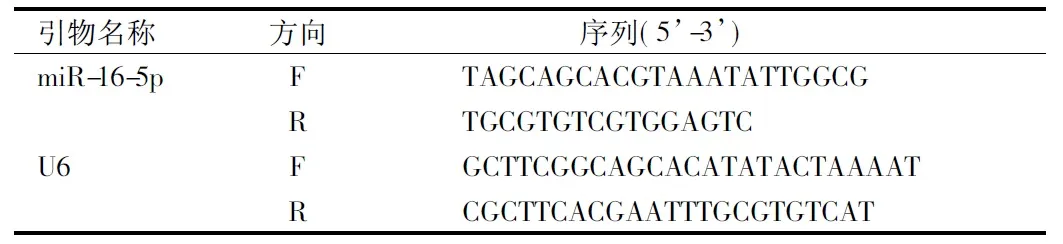
表1 引物序列
1.4.8 免疫印迹法检测7组大鼠心肌组织凋亡蛋白(Bax、Caspase-3)及STAT3 表达:取1.4.6中剩余的心肌组织样品液,100℃煮沸变性蛋白,每组取适量蛋白电泳(120 V恒压,85 min)分离,电转(40 mA稳流,85 min)移到硝酸纤维膜,5%牛血清白蛋白封闭膜上蛋白非特异抗原后将STAT3、p-STAT3、β-actin、Bax、Caspase-3蛋白条带剪下,分别孵育兔源抗大鼠Anti-STAT3、p-STAT3、β-actin、Bax、Caspase-3抗体,洗膜后孵育辣根过氧化物酶标记小鼠抗兔二抗,化学发光显色7组蛋白条带后摄取其图像,采用Image-J软件定量7组蛋白条带灰度值后分析得出相对表达量。
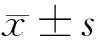
2 结果
2.1 大黄素对7组大鼠心功能的影响 与假手术组比较,模型组大鼠LVDS、LVDD明显升高(P<0.05),EF明显降低(P<0.05)。与模型组比较,大黄素低、高剂量组大鼠LVDS、LVDD均降低(P<0.05),EF均升高(P<0.05);大黄素高剂量组大鼠LVDS、LVDD相比大黄素低剂量组进一步降低(P<0.05),EF进一步升高(P<0.05);miR-16-5p agomir组大鼠LVDS、LVDD升高(P<0.05),EF降低(P<0.05);miR-16-5p agomir阴性对照组大鼠LVDS、LVDD、EF无明显变化(P>0.05)。与大黄素高剂量组比较,大黄素高剂量+miR-16-5p agomir组大鼠LVDS、LVDD升高(P<0.05),EF降低(P<0.05)。见表2。
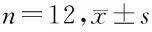
表2 7组大鼠心功能指标LVDS、LVDD、EF
2.2 大黄素对7组大鼠心肌梗死的影响 与假手术组比较,模型组大鼠心肌梗死面积明显升高(P<0.05);与模型组比较,大黄素低、高剂量组大鼠心肌梗死面积均降低(P<0.05),大黄素高剂量组大鼠心肌梗死面积比大黄素低剂量组进一步降低(P<0.05),miR-16-5p agomir组大鼠心肌梗死面积升高(P<0.05),miR-16-5p agomir阴性对照组大鼠心肌梗死面积无明显变化(P>0.05);与大黄素高剂量组比较,大黄素高剂量+miR-16-5p agomir组大鼠心肌梗死面积升高(P<0.05)。见表3,图1。
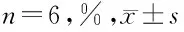
表3 7组大鼠心肌梗死面积
2.3 大黄素对7组大鼠心肌组织病理形态的影响 假手术组大鼠心肌组织形态正常无病理变化;模型组大鼠心肌细胞排列紊乱,部分心肌纤维变性出现灶性坏死,组织内有炎性细胞浸润;与模型组比较,大黄素低、高剂量组大鼠心肌组织病理损伤均减轻,大黄素高剂量组大鼠心肌组织病理损伤进一步减轻,miR-16-5p agomir组大鼠心肌组织病理损伤加重,miR-16-5p agomir阴性对照组大鼠心肌病理损伤无明显变化;与大黄素高剂量组比较,大黄素高剂量+miR-16-5p agomir组大鼠心肌组织病理损伤加重。见图2。

图2 7组大鼠心肌组织病理变化(HE染色×200)
2.4 大黄素对7组大鼠心肌纤维化的影响 与假手术组比较,模型组大鼠心肌细胞凋亡率明显升高(P<0.05);与模型组比较,大黄素低、高剂量组大鼠心肌细胞凋亡率均降低(P<0.05),大黄素高剂量组大鼠心肌细胞凋亡率相比大黄素低剂量组进一步降低(P<0.05),miR-16-5p agomir组大鼠心肌细胞凋亡率升高(P<0.05),miR-16-5p agomir阴性对照组大鼠心肌细胞凋亡率无明显变化(P>0.05);与大黄素高剂量组相比,大黄素高剂量+miR-16-5p agomir组大鼠心肌细胞凋亡率升高(P<0.05)。见图3,表4。
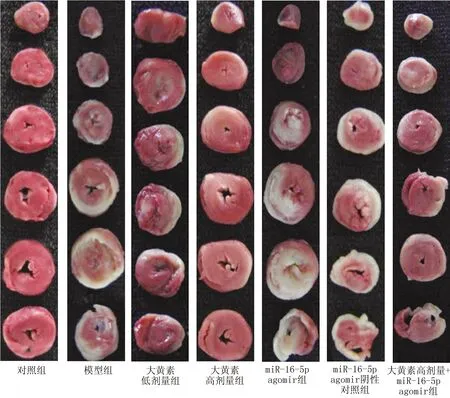
图1 TTC染色检测7组大鼠心肌梗死面积

图3 7组大鼠心肌纤维化(TUNEL染色×200)
表4 7组大鼠心肌细胞凋亡率
2.5 大黄素对7组大鼠心肌组织凋亡蛋白(Bax、Caspase-3)、miR-16-5p/STAT3信号因子表达的影响 与假手术组比较,模型组大鼠心肌组织Bax及Caspase-3蛋白表达、miR-16-5p表达、p-STAT3/STAT3明显升高(P<0.05);与模型组比较,大黄素低、高剂量组大鼠心肌组织Bax及Caspase-3蛋白表达、miR-16-5p表达、p-STAT3/STAT3均降低(P<0.05),大黄素高剂量组大鼠比大黄素低剂量组进一步降低(P<0.05),miR-16-5p agomir组大鼠心肌组织升高(P<0.05),miR-16-5p agomir阴性对照组大鼠心肌组织无明显变化(P>0.05);与大黄素高剂量组比较,大黄素高剂量+miR-16-5p agomir组大鼠心肌组织Bax及Caspase-3蛋白表达、miR-16-5p表达、p-STAT3/STAT3升高(P<0.05)。见表5,图4。

图4 免疫印迹检测7组大鼠心肌组织凋亡蛋白及STAT3蛋白表达;A 假手术组;B 模型组;C 大黄素低剂量组;D 大黄素高剂量组;E miR-16-5p agomir组;F miR-16-5p agomir阴性对照组;G 大黄素高剂量+miR-16-5p agomir组

表5 7组大鼠心肌组织凋亡蛋白、miR-16-5p/STAT3信号因子相对表达水平
2.6 大黄素对7组大鼠血清及心肌组织炎性因子的影响 与假手术组比较,模型组大鼠血清及心肌组织IL-1β、TNF-α水平明显升高(P<0.05);与模型组比较,大黄素低、高剂量组大鼠血清及心肌组织IL-1β、TNF-α水平均降低(P<0.05),大黄素高剂量组相比大黄素低剂量组进一步降低(P<0.05),miR-16-5p agomir组升高(P<0.05),miR-16-5p agomir阴性对照组无明显变化(P>0.05);与大黄素高剂量组比较,大黄素高剂量+miR-16-5p agomir组大鼠血清及心肌组织IL-1β、TNF-α水平升高(P<0.05)。见表6。

表6 7组大鼠血清及心肌组织IL-1β、TNF-α水平
3 讨论
口服硝酸酯类药物、介入手术等是心肌梗死常用临床治疗手段,但患者心脏功能恢复及预后不甚理想,因此探寻疗效更好的治疗方式有重要价值[14,15]。本文通过冠状动脉左前降支结扎法建立心肌梗死模型,结果显示造模大鼠血清及心肌组织炎性因子水平明显升高,促使大鼠心肌细胞凋亡,心肌细胞排列紊乱,部分心肌纤维变性出现灶性坏死,组织内有炎性细胞浸润,严重损害心功能,揭示心肌梗死模型建立成功。
通过抑制炎症水平和心肌细胞凋亡可明显减轻心肌梗死大鼠心功能损伤[16,17]。大黄素可发挥抗氧化、抗心肌缺血、抗炎、抗凋亡的功效,在心血管疾病的治疗中具有很好的应用前景[9],通过降低氧化应激及抑制凋亡等途径减轻硫酸吲哚酚诱导的心肌细胞损伤[18],并通过增强抗氧化功能而缓解大鼠心肌缺血再灌注损伤,保护其心功能[11]。本文以不同剂量大黄素处理心肌梗死大鼠,均可降低其LVDS、LVDD、心肌梗死面积、心肌细胞凋亡率、血清及心肌组织IL-1β、TNF-α水平、心肌组织Bax、Caspase-3蛋白表达,升高EF,减轻大鼠心肌组织病理损伤,表明大黄素可降低炎性因子表达,抑制炎症,减轻心肌细胞凋亡及组织损伤,改善心功能,最终起到心保护作用,且剂量越高作用越强,进一步证实了大黄素对心肌损伤的防治作用。
miR-16-5p和STAT3是调控细胞凋亡、炎症、纤维化的重要因子,在各种心脏疾病发病机制中发挥着重要调控作用,miR-16-5p在缺血性扩张型心肌病患者血浆中表达升高,可在体外促进内质网应激诱导的心肌细胞凋亡,通过抑制细胞凋亡和炎症可有效缓解心脏损伤;降低STAT3磷酸化可显著抑制胶原蛋白表达,通过对抗心肌纤维化改善心肌梗死引起的心衰,保护心功能[19]。本文结果显示以miR-16-5p agomir上调心肌梗死大鼠miR-16-5p表达,可升高炎性因子及STAT3磷酸化水平,增强大鼠炎症和心肌细胞凋亡,加重其心肌组织及心功能损伤,而大黄素可降低心肌梗死大鼠miR-16-5p表达及STAT3磷酸化,表明miR-16-5p/STAT3信号参与介导心肌梗死的发生及大黄素对心肌梗死大鼠的治疗过程;以大黄素处理心肌梗死大鼠同时采用miR-16-5p agomir上调miR-16-5p表达,相比大黄素单独处理,可降低大鼠EF,升高其LVDS、LVDD、心肌梗死面积、心肌胶原纤维占比、血清及心肌组织IL-1β、TNF-α水平、心肌组织Bax、Caspase-3蛋白表达、miR-16-5p表达及p-STAT3/STAT3,加重大鼠心肌组织病理损伤,表明上调miR-16-5p表达可减弱大黄素的抗炎功能,消除其对心肌梗死大鼠心肌组织损伤和心肌细胞凋亡的减轻作用,最终逆转大黄素对心功能的保护作用,揭示大黄素对心肌梗死大鼠发挥保护作用是通过下调miR-16-5p实现的。
综上所述,大黄素可通过下调miR-16-5p而减弱STAT3磷酸化,从而降低炎性因子表达,抑制炎症,减轻心肌梗死大鼠心肌组织损伤和心肌细胞凋亡,最终修复大鼠心功能,发挥心保护作用,阻断miR-16-5p/STAT3信号传导可能是其药理机制之一,本文为大黄素用于心肌梗死的临床治疗提供了新的理论依据及科学资料,有利于大黄素的开发应用。

