中间苍白杆菌尼古丁降解相关基因ocnH的克隆及功能分析
王萌蕾,许倍滔,夏珍珍,王力,张建国,李晓华*
(1 中南民族大学 生命科学学院 & 微生物资源与利用湖北省工程技术研究中心, 武汉 430074;2 江苏神力生态农业科技有限公司, 宜兴 214221)
尼古丁占烟叶质量的2%~8%[1-2].尼古丁化学结构稳定,巨毒,为N-杂环化合物,可通过生物膜和血脑屏障,与神经系统中的烟碱乙酰胆碱受体相互作用,引起迷幻、恶心、高血压、分散、心律失常、惊厥、塌陷甚至死亡,可产生多种致癌、致突变效应[3-5].微生物可利用尼古丁作为唯一的生长碳氮源[6].微生物降解尼古丁被认为是最有前途的生物修复方法[7],目前一些微生物已被用于降解烟草废物[8-9].微生物降解尼古丁主要途径有吡啶途径、吡咯途径、脱甲基途径以及吡啶与吡咯途径的混合途径[10].其中马来酸顺反异构酶是吡咯途径和混合途径中最后的降解酶,作用于马来酸(maleic acid)转化成富马酸(fumaric acid)的过程,进入TCA循环[11].
富马酸,又称反丁烯二酸、延胡索酸,是一种天然存在的有机酸[12],也是一种重要的有机化工原料和精细化工产品.目前,富马酸的生产大都通过化学合成法制备,化学合成法具有成本高、副产物多及可能造成环境污染,目前逐渐转向环境友好的生物法来制备富马酸[12].马来酸顺反异构酶(EC 5.2.1.1,Maleate cistrans Isomerase,MaiA)能够将马来酸(顺丁烯二酸)催化转化成富马酸(反丁烯二酸)的异构酶,属于Asp/Glu消旋酶超家族,能够在C-C双键不断裂的情况下,实现顺式丁烯二酸向反式丁烯二酸的异构化[13-14].产生马来酸顺反异构酶的微生物主要有:假单胞菌属(Pseudomonas)[15]、产碱杆菌属(Alcaligenes)[16]、沙雷氏菌属(Serratia)[17]、变形杆菌属(Proteus)和节杆菌属(Arthrobacter)[13]等.
具有尼古丁降解能力的中间苍白杆菌SCUEC4菌株[18]中的ocnH基因与根癌土壤杆菌SCUEC1菌株中的马来酸顺反异构酶相关基因agnH基因具有较高同源性,因此推测ocnH基因编码蛋白OcnH为马来酸顺反异构酶[19-20].本研究对ocnH基因进行了克隆和异源表达,并对表达条件进行了优化,在此基础上对ocnH基因的功能进行分析,探索中间苍白杆菌尼古丁降解代谢可能途径,以期为利用烟草加工的污染物尼古丁来合成富马酸提供思路.
1 材料与方法
1.1 菌株和质粒
中间苍白杆菌SCUEC4菌株、E. coliBL21(DE3)菌株、原核表达载体pET28a(+)保藏于中南民族大学生命科学学院微生物资源与利用湖北省工程技术研究中心.
1.2 培养基
LB液体培养基和固体培养基,pH值7.0.
1.3 实验方法
1.3.1ocnH基因克隆和重组质粒pET28a(+)-ocnH的构建
提取中间苍白杆菌SCUEC4菌株总DNA,扩增.正向引物:5′-CGCGGATCCATGACAGAAAAGATATAT-3′(下划线处:BamH I酶切位点);反向引物:5′-CCC AAGCTTTTAAGCGGTCGCCTTCATA-3′(下划线处:Hind Ⅲ酶切位点).PCR反应体系:SCUEC4菌株总DNA 1.0 μL,ocnH-F 1.0 μL,ocnH-R 1.0 μL,10×PCR buffer 2.5 μL,dNTP Mixture 1.0 μL,Taq DNA聚合酶0.3 μL,ddH2O 18.2 μL,总体积25.0 μL. 扩增程序:(1)95 ℃ 5 min,(2)95 ℃ 30 s,(2)60.8 ℃ 30 s,(4)72 ℃30 s,(2)~(4)30个循环,(5)72 ℃ 5 min. 对PCR目的片段进行回收纯化,与载体pET28a(+)进行连接,转化E. coliBL21(DE3). 挑取Kan抗性菌落,提取质粒,Hind Ⅲ 与BamH I双酶切验证并测序.
1.3.2ocnH基因编码的氨基酸生物信息学分析
NCBI进行序列检索,N-J法构建进化树.通过在线软件ExPASy ProtParam、NCBI BLASTp、PROSITE、Phyre2及SWISS-MODEL预测OcnH蛋白的理化性质、氨基酸保守结构域(CD)、蛋白质的二级结构及三级结构[3].利用在线软件SignalP 5.0 Server预测OcnH蛋白有无信号肽.
1.3.3ocnH基因的功能分析
将含重组质粒pET28a(+)的E. coliBL21(DE3)菌株和含重组质粒pET28a(+)-ocnH的E. coliBL21(DE3)菌株,按1%接种量分别接于有50 μg/mL马来酸培养基中,30 ℃, 180 r/min,培养24 h后取发酵液,12000 r·min-1离心10 min,0.22 μm滤膜过滤,HPLC检测.检测波长为210 nm,采用Agilent ZORBAX Eclipse XDB-C18,4.6 mm×150 mm,流动相为磷酸盐缓冲液(pH 3.0)∶甲醇(色谱纯)=9∶1(V/V),流速0.5 mL/min,柱温30 ℃,进样量10 μL.
1.3.4ocnH基因在大肠杆菌中的表达与条件优化
(1)浓度:将25 mL转化成功的大肠杆菌培养液加入1 mol·L-1异丙基硫代半乳糖苷(IPTG)至终浓度分别为0.2、0.4、0.6、0.8和1.0 mmol·L-1.(2)温度:16、20、25、30、37 ℃六个不同温度设置.(3)时间:分别为10、15、20、25、30、35、40 h七个不同时间点.然后离心诱导表达菌液,重悬于5 mL裂解液中,超声破碎15 min. 随后4 ℃ 4000 r·min-1离心10 min,收集全菌液、上清液、沉淀,SDS-PAGE凝胶检测.
2 结果与分析
2.1 ocnH基因的克隆与重组质粒pET28a(+)-ocnH的构建
以SCUEC4菌株总DNA为模板扩增后获得1条600 bp左右的片段(图1).该片段回收纯化、酶切后与载体质粒pET28a( +)连接,转化E.coliBL21(DE3)感受态细胞.双酶切验证,得到分别对应600 bp处的ocnH基因双酶切片段和5.3 kb处的pET28a(+)质粒双酶切片段的2个片段(图2).测序结果表明与SCUEC4菌株全基因组测序中ocnH基因序列一致.

图1 ocnH PCR基因扩增片段Fig.1 PCR amplification of ocnH gene

图2 重组质粒pET28a(+)-ocnH的构建Fig.2 Construction of recombinant plasmid pET28a(+)-ocnH
2.2 OcnH蛋白氨基酸序列分析
由图3可知,OcnH蛋白分别与Ochrobactrumsp.SJY1中的VppH[19]、AgrobacteriumtumefaciensSCUEC1的AgnH[20]中的马来酸异构酶具有较高同源性.

图3 OcnH蛋白氨基酸序列的系统进化树Fig.3 Phylogetic tree of OcnH protein amino acid sequence
ExPASy ProtParam在线分析得出:OcnH蛋白有194个氨基酸,理论分子量为20.6 kDa,pI为5.34;带正电荷(Arg+Lys)和带负电荷(Asp+Glu)的氨基酸残基数分别为18个和23个(可推测出为酸性蛋白质);分子式为C901H1479N251O276S11;脂肪指数值为106.65,不稳定指数值为29.46;平均亲水系数值(GRVAY)为0.22(可推测出为疏水性蛋白).进一步通过在线软件分析预测后可知,OcnH蛋白属于Asp/Glu乙内酰脲消旋酶超家族.OcnH蛋白的二级结构及三级结构中,44.85%为α-螺旋,9.79%为β-折叠.根据在线软件推测,它应属于非分泌性蛋白.
2.3 ocnH基因在大肠杆菌中异源表达
在20 ℃、0.2 mmol·L-1IPTG的条件下诱导表达20 h的pET28a(+)-ocnH重组质粒转化的大肠杆菌,SDS-PAGE电泳表明(图4),与仅含pET28a(+)质粒的对照E. coliBL21(DE3)菌株对比,含ocnH基因重组质粒的大肠杆菌在25.0 kDa处有大量融合蛋白,与OcnH蛋白的理论大小20.6 kDa相符合,表明基因异源表达成功.

图4 E. coli BL21(DE3)中OcnH蛋白的表达分析Fig.4 Analysis of the OcnH protein expression in E. coli BL21(DE3)
2.4 不同浓度IPTG对 OcnH蛋白表达量的影响
含pET28a(+)-ocnH重组质粒的BL21(DE3)菌株在不同IPTG浓度条件下,20 ℃诱导表达20 h,结果如图5所示,IPTG浓度从0.2增加到0.6 mmol·L-1,OcnH蛋白量呈上升趋势,IPTG浓度从0.6增加到1.0 mmol·L-1,OcnH蛋白量反而呈下降趋势,表明0.6 mmol·L-1IPTG浓度下OcnH蛋白表达量较高.
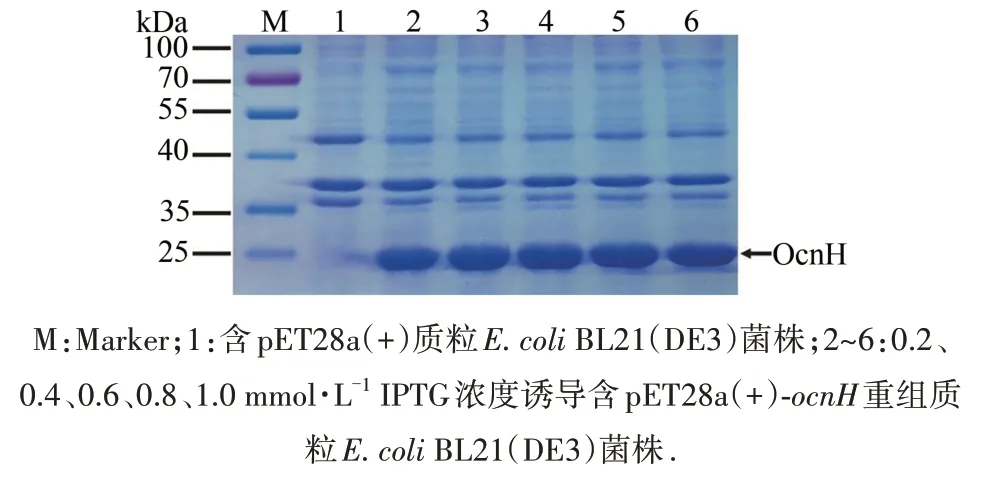
图5 不同浓度 IPTG对OcnH蛋白表达的影响Fig.5 Effect of different concentrations of IPTG on the expression of the OcnH protein
2.5 不同温度对OcnH蛋白表达量的影响
在0.2 mmol·L-1IPTG浓度下,含重组质粒的BL21(DE3)菌株在不同温度下诱导培养20 h(图6).结果表明,在16~25 ℃之间,OcnH蛋白量随温度升高而逐渐增加,但温度从25增加到37 ℃,OcnH蛋白量反而略有减少,表明OcnH蛋白表达量较高的温度在25 ℃.
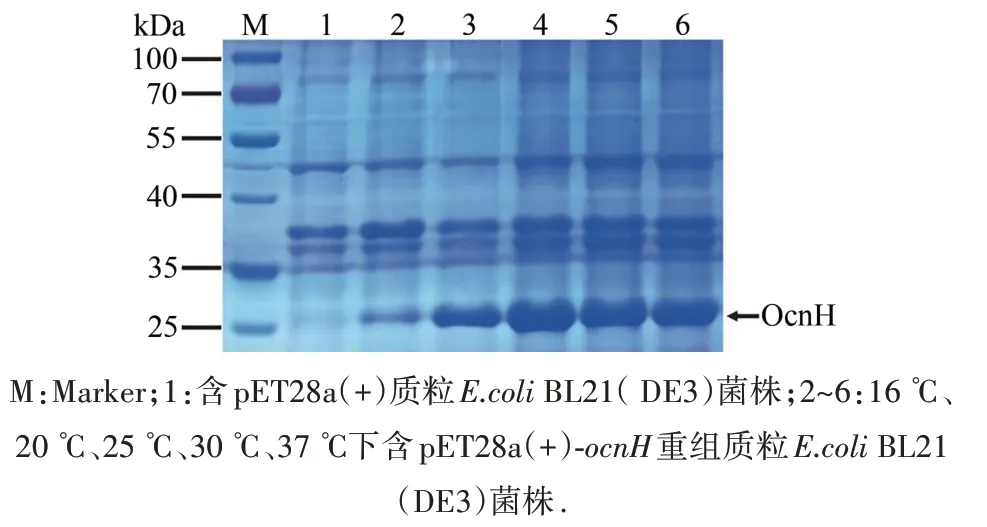
图6 不同诱导温度对OcnH蛋白表达的影响Fig.6 Effect of different induction temperatures on the expression of the OcnH protein
2.6 不同诱导时间对 OcnH蛋白表达量的影响
在20 ℃、0.2 mmol·L-1IPTG条件下,对含重组质粒的大肠杆菌BL21(DE3)菌株诱导时间从10增加到20 h,OcnH蛋白的表达量增加;诱导时间从20增加到40 h,OcnH蛋白表达量呈下降趋势,表明OcnH蛋白表达量较高的的时间为20 h(图7).
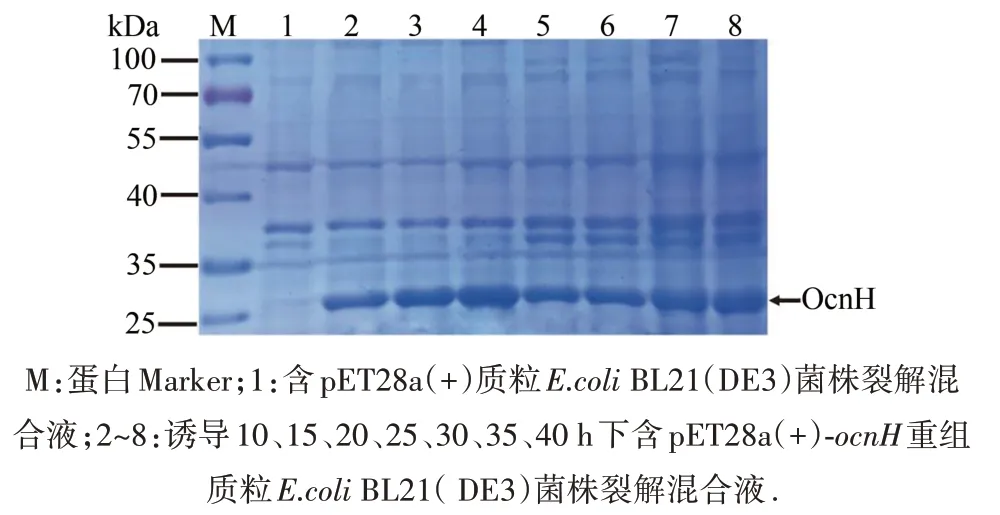
图7 不同诱导时间对 OcnH蛋白表达量的影响Fig.7 Effect of different induction time on the expression of the OcnH protein
2.7 ocnH基因功能分析
以马来酸为底物,HPLC进行测定.结果如图8所示,对照菌株(含空质粒pET28a(+)的E. coli菌株)在初始溶度50 μg/mL马来酸的培养基中培养24 h后,马来酸峰面积仍为9763.59 mAU·s,没有变化,富马酸峰面积为0 mAU·s(图8(c));而含重组质粒pET28a(+)-ocnH的E. coli菌株在初始溶度50 μg/mL马来酸的培养基中培养24 h后,马来酸峰面积减少到656.49 mAU·s,富马酸峰面积增加到8500.98 mAU·s(图8(d)),表明含重组质粒pET28a(+)-ocnH的E. coliBL21(DE3)菌株将马来酸转化为富马酸,OcnH蛋白具有马来酸异构酶功能.

图8 含pET28a(+)-ocnH质粒的E. coli BL21(DE3)的功能分析Fig.8 Functional analysis of E. coli BL21 (DE3) strain containing recombinant plasmid pET28a(+)-ocnH
3 结语
进行尼古丁降解菌代谢途径的探究,对尼古丁污染环境的生物修复具有潜在应用价值.本研究结果表明:ocnH基因大小为585 bp,编码蛋白分子量约为20.6 kDa.重组表达菌株在IPTG浓度为0.6 mmol·L-1、诱导温度为25 ℃、诱导表达时间为20 h时,OcnH蛋白的表达量较高.转入pET28a(+)-ocnH的大肠杆菌BL21(DE3)菌株具有将马来酸转化为富马酸的功能,研究结果为阐明中间苍白杆菌SCUEC4菌株尼古丁降解代谢途径奠定了基础.

