急性心肌梗死治疗前后超声心动图指标变化及其临床意义
魏 苇,覃 慧,韦丽娜,兰菲菲
(1河池市第三人民医院功能科 广西 河池 547000)
(2广西国际壮医医院超声科 广西 南宁 530000)
急性心肌梗死(acute myocardial infarction,AMI)是由多种因素引起的冠状动脉粥样硬化病变,导致心肌细胞严重且持久的急性缺血性坏死,是心血管内科常见的高危疾病,其起病急、恶化快,患者预后较差[1]。该病的并发症也较多,常见如心律失常、心力衰竭、室壁穿孔及心源性休克等,致死率较高。对于AMI目前临床上较为常用且效果良好的微创经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI),其能通过改善患者心肌血流灌注,缩小心肌缺血及梗死范围,在一定程度上降低患者急性期的死亡率,但患者的预后仍不理想[2-3]。研究显示[4],在治疗后1年内至少有5%~10%的AMI患者死亡,并有50%以上的患者需要再次住院。因此,若能及早准确评估AMI患者心室收缩功能,对患者进行手术治疗以及对改善其预后有着十分重要的临床意义。目前临床上诊断AMI除了根据患者临床症状外,还可根据心肌酶谱、冠状动脉造影、胸部X线以及超声心动图等。其中有研究发现[5-6],采用心电图可提供心室重构信息、舒张功能参数、血流动力学参数,同时其对AMI可有95%~98%的预测价值。目前临床上有关超声心动图在AMI方面的研究报道较少。基于此,本研究对2021 年1月—2023年1月在河池市第三人民医院行PCI治疗的AMI患者76例进行回顾性研究,通过采用超声心动图观察其治疗前后的左室收缩功能指标变化,以明确心动超声图的应用价值。报道如下。
1 资料与方法
1.1 一般资料
回顾性选取2021年1月—2023年1月在河池市第三人民医院进行PCI治疗的AMI患者76例,其中男性46例,女性30例,年龄34~84岁,平均年龄(63.55±8.64)岁;梗死部位:前间壁34例,后下壁21例,单纯下壁14例,广泛前壁7例;冠状动脉造影病变:单支32例,双支或多支44例。患者均自愿参与并签署知情同意书。
纳入标准:①符合AMI诊断标准[7],入院时伴有急性胸痛症状,且经体检、病史以及超声心动图等检查确诊;②患者均行PCI治疗;③临床相关资料完整者。排除标准:①伴有肾、肝功能障碍者;②梗死后1周内出现有心源性休克、心力衰竭者;③合并有心肌病或心脏瓣膜疾病、先天性心脏病以及急性肺动脉栓塞等患者;④伴有高血脂、糖尿病、高血压等需要同时进行对症治疗者。
1.2 方法
1.2.1 超声心动图检测 采用飞利浦便捷式彩色多普勒超声心动图仪CX50进行超声心动图检测,探头频率为(2.0~2.5)MHz,探头深度15~20 cm。患者取平卧或左侧卧位,平静呼吸。以患者的胸骨轴面、心尖腔面、左室切面等作为基础切面,对各切面的轴线与轴心位置进行调整,以保证轴线经过切面为最大面积,从而获取超声血流图像。利用Teichholtz校正公式重复测量相关超声心动图指标,所有指标均测量3 次,取平均值。上述操作均由本院具有丰富经验的超声医师完成。
1.2.2 治疗方法 所有患者均接受PCI治疗,术前均口服300 mg阿司匹林(厂家:山东新华制药股份有限公司,国药准字:H37022905)、300 mg氯吡格雷(厂家:深圳信立泰药业股份有限公司H20120018),术中注射1 万U普通肝素(厂家:武汉生物化学制药有限公司,国药准字:H20123352);按照放置的心电图导联、血管堵塞程度等对栓塞动脉进行定位。选用符合患者相关情况的球囊,对其狭窄及闭塞的管腔实施扩张,接着进行血管内支架置入术,注意观察患者扩张后情况(如残余狭窄、远端冠状动脉血流以及是否有内膜夹层或撕裂等),手术过程中,除需要监测患者心率、血压外,还要密切观察超声心电图变化情况;及时发现和解决出现问题的患者,并给予对症治。手术后,患者给予氯吡格雷与阿司匹林,口服,均75 mg/d,然后注射肝素(5 000 U),治疗维持7 d。
1.2.3 手术成功标准 局部残余狭窄<20%,梗死相关动脉心肌梗死溶栓治疗(thrombolysis in myocardial infarction,TIMI)血流分级为3级,且无相关PCI并发症。
1.3 观察指标
分析术前、术后7 d及术后3个月所有患者的超声心动图指标参数,包括左室收缩末期容积(left ventricular end-systolic volume,LVESV)、舒张末容积(left ventricular end-diastolic volume,LVEDV)、左房直径(left atrial diameter,LA)、左室收缩末直径(left ventricular end-systolic diameter,LVDS)及左室舒张末直径(left ventricular end-diastolic diameter,LVDD);通过计算得出每搏输出量(stroke volume,SV)和左室射血分数(left ventricular ejection fraction,LVEF)。
1.4 统计学方法
采用SPSS 23.0统计软件分析数据。符合正态分布的计量资料以均数±标准差()表示,两组间比较采用t检验,多组间比较采用方差分析;计数资料以频数(n)、百分率(%)表示,采用χ2检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 治疗前后超声心动图指标变化
AMI患者术前、术后7 d、术后3个月的超声心动图各个指标相比差异具有统计学意义(P<0.05);术后7 d的SV与LVEF高于术前,LVDS、LVESV、LA、LVDD、LVEDV均小于术前,差异均有统计学意义(P<0.05);与术前、术后7 d相比,术后3个月超声心动图各个指标改善更显著(P<0.01)。见表1。
表1 治疗前后超声心动图指标变化()
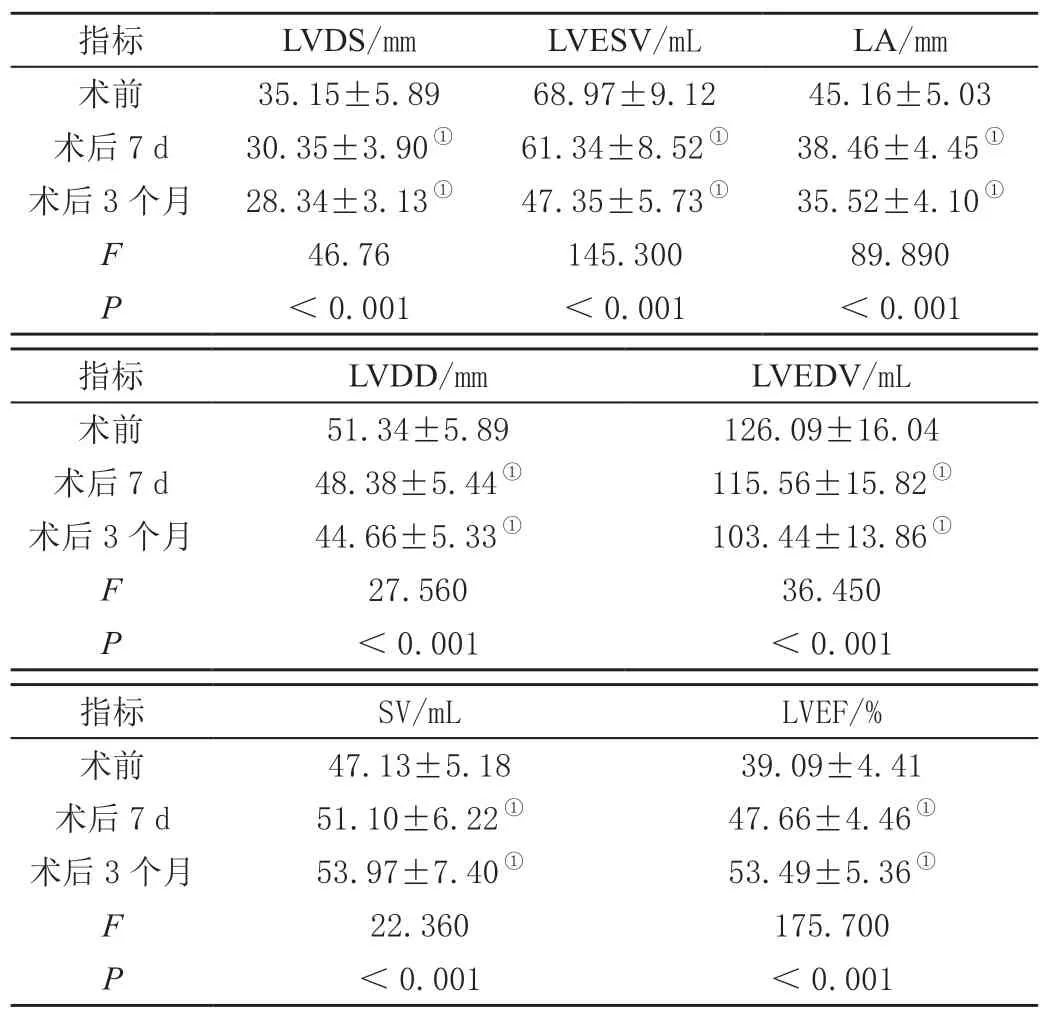
表1 治疗前后超声心动图指标变化()
注:①表示与术前相比,P<0.05。
指标LVDS/mmLVESV/mLLA/mm术前35.15±5.8968.97±9.1245.16±5.03术后7 d30.35±3.90①61.34±8.52①38.46±4.45①术后3个月28.34±3.13①47.35±5.73①35.52±4.10①F 46.76145.30089.890 P<0.001<0.001<0.001指标LVDD/mmLVEDV/mL术前51.34±5.89126.09±16.04术后7 d48.38±5.44①115.56±15.82①术后3个月44.66±5.33①103.44±13.86①F 27.56036.450 P<0.001<0.001指标SV/mLLVEF/%术前47.13±5.1839.09±4.41术后7 d51.10±6.22①47.66±4.46①术后3个月53.97±7.40①53.49±5.36①F 22.360175.700 P<0.001<0.001
3 讨论
发病的AMI患者心肌运动功能均处于急剧下降状态,相对应的整体心功能也下降,而患者在发生血管血栓形成到心肌完全坏死需一定时间,因而,在该时间段内,若能及时有效完成疏通闭塞的血管,将可挽救濒死或部分尚未坏死的心肌细胞[8]。PCI为目前治疗AMI患者中作为常用且最为有效的心肌缺血再灌注治疗方式,介入治疗或手术治疗能使已经发生梗死或狭窄的冠状动脉快速扩桩与改善,使闭塞的血管重新开通,重建血运并为病变部位提供侧支循环,进而在整体上改善左室功能[9-10]。介入治疗能显著有效改善AMI患者预后的原因有:①PCI能使心肌细胞及血管再生,并能提供侧支循环;②开通梗死部位相关冠状动脉能挽救部分尚未坏死的肌细胞,缩小梗死面积,改善冠脉血流,提高心肌灌注水平,改善心室重构,从而减少心力衰竭;③PCI治疗能维持梗死部位及其周围的电稳定性来降低恶性心律失常发生风险。
在AMI诊断方面临床上大多是通过心肌酶谱检查或采用超声心动图等来进行,当前已有研究表示,在结扎冠状动脉几秒之后,室壁将发生出现运动异常、减弱或消失[11]。而超声心动图用于AMI,在辅助AMI检测方面因价格经济实惠、简单快捷、方便无创、敏感性高、易于临床开展等优势得到了广泛应用。AMI患者在超声心动图上常见表现主要为出现梗死部位室壁运动状态显示为运动消失或减弱,部分甚至还可出现反常运动,左心室肥厚(增厚),左室射血分数减低[12-13]。超声心动图能实时并直观地显示室壁运动过程并具有较高的敏感性,当超声心动图显示室壁反常运动状态时,表示患者伴有严重的心肌缺血(如出现有心肌梗死、缺血性心肌病等);相反地,若超声心动图显示室壁运动无异常则近于表示无心肌梗死[14]。此外,超声心动图能直观及清晰地显示出心脏结构,而通过对室壁反常运动进行分析,即可进一步确定梗死部位、梗死范围以及梗死程度,进而实现相关冠状动脉情况的预测;同时还可显现心脏内血流方向以及血流速度,当血流时相与其血流性质得到明确时,可清晰、直观显示心肌梗死者室壁节段厚度以及运动情况[15]。本研究通过超声心动图能明确检出AMI患者的心脏的各项指标,也体现了超声心动图的优势。本研究结果显示,AMI患者术前、术后7 d、术后3 个月的超声心动图各个指标相比,差异均有统计学意义(P<0.05);术后7 d的LVDS、LVESV、LA、LVDD、LVEDV均低于术前,SV与LVEF高于术前;与术前、术后7 d相比,术后3个月超声心动图各个指标改善更显著(P<0.01)。而上述这些指标均为评估左室重构的重要指标,其中LVEF可作为判断心脏收缩功能的重要指标。可见,超声心动图能有效反映AMI患者PCI治疗前后的左室收缩功能的变化。
综上所述,AMI患者PCI治疗前后采用超声心动图检测,能有效反映患者的左心室收缩功能的变化,可为评价AMI患者预后提供有效依据,有很好的临床应用价值。

