基于TCGA数据库及分子对接探讨黄芪治疗胃癌的作用机制
胡文杰 王钰婷 于白莉


[摘要] 目的 探討黄芪治疗胃癌的作用机制。方法 通过中药系统药理学数据库和分析平台检索黄芪的化学成分及作用靶点。癌症基因组图谱数据库下载胃癌基因表达谱及临床特征数据,采用加权基因共表达网络分析(weighted correlation network analysis,WGCNA)识别胃癌共表达模块。将黄芪的作用靶点与胃癌共表达模块、差异基因取交集。STRING数据库构建蛋白质–蛋白质相互作用(protein-protein interaction,PPI)网络并提取黄芪改善胃癌预后的潜在靶点。通过GSE54129数据集、人类蛋白质图谱数据库、分子对接对潜在靶点进行验证。结果 共检索到黄芪有效活性成分16个及对应靶点190个;筛选得到差异表达基因2694个,其中上调基因1124个,下调基因1570个;构建的WGCNA共表达网络发现青绿色模块与胃癌有显著而稳定的相关性,构建韦恩图得到黄芪改善胃癌预后的27个差异表达基因。PPI网络鉴定得到10个关键基因,其中,微囊蛋白1(caveolin 1,CAV1)、前列腺素E2受体EP3亚型(prostaglandin E2 receptor EP3 subtype,PTGER3)与胃癌患者的生存显著相关。分子对接结果发现,黄芪活性成分与PTGER3具有较好的结合能。结论 黄芪改善胃癌预后的作用机制可能与调节CAV1和PTGER3有关。
[关键词] 黄芪;加权基因共表达网络分析;胃癌;生存分析;生物信息
[中图分类号] R735.2 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.16.019
The mechanism of astragalus in treatment of gastric cancer based on TCGA database and molecular docking
HU Wenjie, WANG Yuting, YU Baili
Department of General Practice, Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu, 610075, Sichuan, China
[Abstract] Objective To explore the mechanism of astragalus in treatment of gastric cancer. Methods The chemical constituents and targets of astragalus were searched through traditional Chinese medicine systems pharmacology database and analysis platform. The Cancer Genome Atlas database was downloaded for gastric cancer gene expression data and clinical data, and weighted correlation network analysis (WGCNA) was used to identify gastric cancer co-expression modules. The target of astragalus was intersected with gastric cancer co-expression modules and differential genes. Potential targets were validated using the GSE54129 dataset, Human Protein Atlas database, and molecular docking. Results A total of 16 active ingredients and 190 corresponding targets of astragalus were retrieved. 2694 differentially expressed genes were screened, of which 1124 genes were up-regulated and 1570 genes were down-regulated. The constructed WGCNA co-expression network showed a significant and stable correlation between the cyan module and gastric cancer, and 27 differentially expressed genes of astragalus were obtained by constructing the Venn diagram. Ten key genes were identified by PPI network, among which caveolin 1 (CAV1) and prostaglandin E2 receptor EP3 subtype (PTGER3) were significantly correlated with the survival of patients with gastric cancer. The molecular docking results showed that the active ingredients of astragalus had good binding energy with PTGER3. Conclusion The mechanism of astragalus improving the prognosis of gastric cancer may be related to regulating CAV1 and PTGER31.
[Key words] Astragalus; Weighted correlation network analysis; Gastric cancer; Survival analysis; Bioinformatics
![]() 胃癌居全球癌癥发病谱的第5位与死因谱的第4位,据估计全球每年新增胃癌病例超过100万例[1-2]。在中国,多数胃癌患者被发现时已处于疾病晚期,5年生存率不足50%[3]。胃癌的早期诊断较为困难,尽管采取新辅助化疗、放射治疗及免疫治疗等多种治疗手段,但其复发率与转移率仍较高[4]。因此,如何降低胃癌术后的复发率和转移率,减轻药物不良反应,改善胃癌患者预后,是临床研究的重点。黄芪具有补气固表、托毒生肌的功效,其抗癌机制主要围绕调节肿瘤免疫、抑制肿瘤细胞增殖、抗肿瘤细胞迁移侵袭、诱导肿瘤细胞凋亡、抗新生血管生成及联合化疗药物的增效减毒等方面[5-6]。研究表明黄芪提取物可抑制人胃癌SGC-7901细胞体外增殖且通过线粒体途径诱导其凋亡,但黄芪改善胃癌预后的作用靶点及潜在机制目前尚未明确[5]。中药成分复杂,作用靶点较多,本文通过生物信息学揭示黄芪在胃癌预后中的潜在价值,为黄芪治疗胃癌的新药开发及质量评价提供依据。
胃癌居全球癌癥发病谱的第5位与死因谱的第4位,据估计全球每年新增胃癌病例超过100万例[1-2]。在中国,多数胃癌患者被发现时已处于疾病晚期,5年生存率不足50%[3]。胃癌的早期诊断较为困难,尽管采取新辅助化疗、放射治疗及免疫治疗等多种治疗手段,但其复发率与转移率仍较高[4]。因此,如何降低胃癌术后的复发率和转移率,减轻药物不良反应,改善胃癌患者预后,是临床研究的重点。黄芪具有补气固表、托毒生肌的功效,其抗癌机制主要围绕调节肿瘤免疫、抑制肿瘤细胞增殖、抗肿瘤细胞迁移侵袭、诱导肿瘤细胞凋亡、抗新生血管生成及联合化疗药物的增效减毒等方面[5-6]。研究表明黄芪提取物可抑制人胃癌SGC-7901细胞体外增殖且通过线粒体途径诱导其凋亡,但黄芪改善胃癌预后的作用靶点及潜在机制目前尚未明确[5]。中药成分复杂,作用靶点较多,本文通过生物信息学揭示黄芪在胃癌预后中的潜在价值,为黄芪治疗胃癌的新药开发及质量评价提供依据。
1 材料与方法
1.1 药物靶点
通过中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)以生物利用度≥30%、类药性≥0.18为筛选标准,得到黄芪的有效活性成分及对应靶点。对应靶点通过UniProt数据库矫正去重。
1.2 胃癌基因表达谱下载及差异分析
进入癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库,下载胃癌基因表达谱及相应临床特征数据,去除临床信息不全样本,以P<0.05、|Log2FC|>1为筛选标准筛选差异表达的基因并建立差异表达矩阵。
1.3 加权基因共表达网络分析
利用R软件将下载的胃癌基因表达谱进行加权基因共表达网络分析(weighted correlation network analysis,WGCNA),构建无标度网络,设置合适的阈值(β)。将β转换为拓扑重叠矩阵(topological overlap matrix,TOM)及相应的相异度(1-TOM),构建1-TOM矩阵的层次聚类树形图,将相似的基因表达划分为不同的模块。将得到模块中的基因靶点与黄芪的作用靶点进行交集,选取交集靶点最多的模块作为目标模块。取目标模块、黄芪作用靶点、差异表达基因三者的交集,其共同靶点为黄芪改善胃癌预后的潜在靶点。
1.4 基因功能富集分析
为了解黄芪改善胃癌患者预后的模块基因的生物学功能,利用R软件以P<0.05为筛选标准对模块靶点进行基因本体论(gene ontology,GO)富集分析,包括生物过程、细胞成分、分子功能三部分。
1.5 蛋白质-蛋白质相互作用网络
将黄芪改善胃癌预后的靶点导入STRING数据库构建蛋白质–蛋白质相互作用(protein-protein interaction,PPI)网络,下载TSV格式文件,导入Cytoscape软件构建PPI网络可视化图。利用Cytoscape软件的CytoHubba插件计算每个节点的最大团中心性(maximal clique centrality,MCC)值,MCC值高的前10个基因被认为是黄芪改善胃癌预后的关键基因。
1.6 生存分析
利用R软件,对TCGA数据库下载的基因表达数据和临床数据进行分析,采用Kaplan-Meier法对关键基因进行单因素生存分析,比较不同基因表达水平患者的总生存时间。
1.7 数据验证
为验证关键基因的稳健性,进入基因表达综合(Gene Expression Omnibus,GEO)数据库下载数据集GSE54129,该数据集包括111例胃癌组织和21例癌旁组织的基因表达谱芯片,利用R语言对关键基因在肿瘤组织和癌旁组织的表达进行验证。人类蛋白质图谱(Human Protein Atlas,HPA)数据库提供大量特定人类组织和细胞的转录组和蛋白质组学数据。在HPA数据库检索生存相关基因,下载该基因在胃癌组织与癌旁组织中的免疫组化图谱,明确关键基因在胃癌组织中的蛋白水平。
1.8 分子对接
从PubChem数据库下载小分子化合物的mol2格式文件,蛋白质结构数据库(Protein Data Bank,PDB)下载大分子蛋白结构,利用PyMOL软件对大分子去除原配体,去水加氢处理。将大分子与小分子配体导入AutoDock软件构建活性口袋,明确中心位点,进行分子对接。
2 結果
2.1 成分靶点构建
通过TCMSP得到黄芪有效活性成分16个及其对应靶点190个,构建“成分–靶点”网路,见图1。图中节点代表黄芪的有效活性成分及靶点,节点与节点之间的连线代表成分与靶点的关系,由图1可知槲皮素(MOL000098)、山奈酚(MOL000422)、黄芪异黄烷苷(MOL000378)、刺芒柄花素(MOL000392)、异鼠李素(MOL000354)等成分为黄芪的主要活性成分。
2.2 胃癌的差异基因分析
从TCGA数据库下载胃癌基因表达谱,筛选得到差异表达基因2694个,其中上调基因1124个,下调基因1570个,根据结果绘制差异表达基因火山图,见图2。
2.3 WGCNA
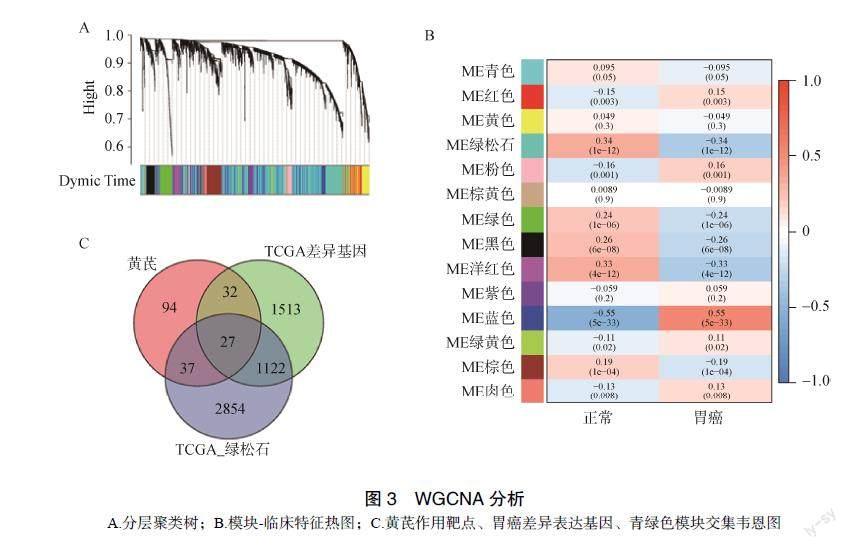
基于1-TOM矩阵的基因层次聚类对共表达网络模块的聚类树状图进行排序,共确定14个模块,绘制“模块–临床特征”热图。构建的WGCNA共表达网络发现青绿色模块与胃癌有显著而稳定的相关性,将青绿色模块、胃癌差异表达基因、黄芪作用靶点取交集构建韦恩图,得到黄芪改善胃癌预后的27个差异表达基因,见图3。
2.4 GO富集分析
GO富集结果显示,黄芪改善胃癌预后的27个关键基因主要富集在细胞对化学应激的反应和细胞对氧化应激的反应等生物过程、基底质膜和细胞基质等细胞成分、G蛋白耦联神经递质受体活性和乙酰胆碱受体活性等分子功能,见图4。
2.5 PPI网络
STRING数据库构建PPI网络,得到17个节点,74条边,图中红色及黄色节点为关键基因,见图5。
2.6 生存分析及HPA数据库验证
在10个关键基因中,微囊蛋白1(caveolin 1,CAV1)、前列腺素E2受体EP3亚型(prostaglandin E2 receptor EP3 subtype,PTGER3)与胃癌患者的生存显著相关(P<0.05),CAV1、PTGER3高表达的胃癌患者生存率均显著低于低表达患者,见图6。验证数据集GSE54129表明,CAV1、PTGER3在肿瘤组织中高表达(P<0.05),见图7。
2.7 分子对接
PDB数据库暂未收录CAV1蛋白,无法进行分子对接,下载PTGER3蛋白(PDB ID:6AK3)与黄芪的主要活性成分(Degree前5)进行分子对接,见表1。其中槲皮素与山奈酚为主要作用于PTGER3的活性成分,与靶点对接结合能均小于–5.0kcal/mol,表明配体分子均可与受体蛋白较好地结合。
3 讨论
中医学认为“正气存内,邪不可干”,胃癌的发生主要取决于正气的盛衰。黄芪为补药之长,在《神农本草经》中位列上品。研究表明,黄芪可提高人体免疫力[7]。黄芪作为单味中药或配伍用药在抗胃癌中应用广泛,但其存在有效成分、作用靶点、潜在机制不明确等问题,给临床使用带来一定困惑。网络药理学的发展为揭示中药多成分、多靶点、多通路的作用机制提供新策略[8]。本研究通过收集胃癌的差异表达基因得到疾病靶点,并构建加权基因共表达网络,最后通过分子对接,HPA数据库进行多手段验证,为黄芪治疗胃癌的作用机制提供新的见解。
本研究发现,槲皮素、山奈酚是黄芪改善胃癌预后的主要有效成分,该结果与黄芪指纹图谱测定结果一致[9-10]。槲皮素和山奈酚均为黄酮类化合物,对肿瘤具有较好的抑制作用[11-12]。槲皮素能够通过调控CAV1蛋白的表达有效抑制胃癌细胞的增殖和侵袭[13]。此外,槲皮素可通过抑制c-Jun/ATF2/Bcl-xL途径增强5-氟尿嘧啶对胃癌的凋亡诱导活性[14]。细胞实验同样发现,槲皮素通过抑制Wnt/β-catenin信号通路诱导MKN45细胞凋亡[15]。山奈酚通过上调P53基因促进细胞凋亡,并抑制PARP1基因和PARP1蛋白的表达,造成DNA损伤,从而抑制胃癌细胞增殖[16-17]。槲皮素、山奈酚可作为黄芪治疗胃癌的潜在物质基础。
GO富集结果显示,黄芪改善胃癌患者预后的27个关键基因主要与细胞对氧化应激的反应、细胞凋亡负调节、活性氧(reactive oxygen species,ROS)代谢过程有关。氧化应激与肿瘤的关系非常复杂,ROS刺激肿瘤形成,促进肿瘤细胞的转化/增殖,但高水平的ROS具有细胞毒性,可导致肿瘤细胞凋亡[18]。研究表明,黄芪可通过清除自由基抑制氧化应激,促进肿瘤细胞凋亡及抑制增生[19-20]。
本研究发现黄芪具有抗肿瘤转移和抗新生血管生成的潜在作用[21]。CAV1是一种膜蛋白,在肝癌、结肠癌、乳腺癌、肾癌、肺癌等多个瘤种中高表达,其可通过糖酵解、线粒体生物能量学、谷氨酰胺分解、脂肪酸代谢和自噬等参与促进肿瘤的发生发展[22-23]。CAV1在胃癌的发生发展过程中发挥复杂的作用。胃癌早期,CAV1在胃上皮细胞的表达呈进行性下降,而在胃癌晚期,CAV1表达上调,并与胃癌不良预后呈正相关[24-25]。生存分析发现,CAV1高表达提示预后不佳。研究还发现黄芪活性成分可逆转si-CAV1对CAV1蛋白的抑制[26]。PTGER3是前列腺素E2作用的4种受体之一,对肿瘤转移和血管生成具有促进作用[27]。研究表明PTGER3表达上调可能参与肠型胃癌的发生发展,且其高表达提示患者预后不良[28]。张林等[29]发现,黄芪主要活性成分槲皮素治疗胃癌的主要靶点为PTGER3。分子对接结果表明,黄芪中主要活性成分能较好地与PTGER3结合。
综上,黄芪在改善胃癌患者生存预后中发挥重要作用,其机制可能与CAV1、PTGER3等靶点的抗肿瘤转移和抗新生血管生成有关。
[参考文献][1] SMYTH E C, NILSSON M, GRABSCH H I, et al. Gastric cancer[J]. Lancet, 2020, 396(10251): 635–648.
[17] 王丽君, 戴志升. 山奈酚对胃癌细胞PARP1以及P53基因表达的影响研究[J]. 基因组学与应用生物学, 2020, 39(03): 1270–1274.

