基于微卫星标记的克氏原螯虾种群遗传多样性和遗传结构分析
高杨 田灿 姜京京 唐永凯 张成锋 冯文荣 李冰 陈铭 卢泽宇 苏胜彦 朱健


摘要:为了解当前我国不同地区克氏原螯虾种群的遗传背景情况,以期为人工养殖、新品种选育和资源保护提供参考依据。选取江苏洪泽湖(HZH)、湖北洪湖(HH)、湖南洞庭湖(DTH)、山东微山湖(WSH)、安徽巢湖(CH)、江西鄱阳湖(PYH)6个典型区域的克氏原螯虾群体作为研究对象,采用14对微卫星引物对来自6个地区的168份样品进行遗传多样性检测。结果可知,各群体不同标记位点的等位基因数在3~14之间,平均期望杂合度为0.81,平均多态信息含量分布在0.42~0.59之间,各群体均处于中高度遗传多样性水平。6个群体均发生一定程度Hardy-Weinberg平衡偏离,仅有少数位点在单一群体满足Hardy-Weinberg平衡,同时连锁不平衡检测发现9个连锁座位对处于不平衡状态。遗传距离结果显示,6个克氏原螯虾群体的遗传一致度(I)处于0.127 8~0.643 9之间,各群体间遗传距离(D)处于0.440 2~2.057 3之间。群体间遗传分化指数(Fst)接近0.5,反映出群体间的基因交流水平较弱,存在高度的遗传分化。AMOVA分析发现,39.65%的遗传变异来源于群体间,97.99%的遗传变异来源于个体间。遗传结构数据显示,K=5时,6个群体间存在显著的结构差异。上叙结果可知,6个地区的克氏原螯虾群体具有丰富的遗传多样性,群体间出现了显著分化,可通过隔离保种、杂交、选择育种等方式保护利用克氏原螯虾的种质资源,为我国克氏原鳌虾产业的持续健康发展提供良种支持。
关键词:克氏原螯虾;遗传多样性:微卫星标记;遗传结构
中图分类号:S917;S966.12文献标志码:A
文章编号:1002-1302(2023)05-0191-09
克氏原螯虾(Procambarus clarkii)别称淡水小龙虾,原产自北美洲,20世纪前中叶引入我国。该虾具有肉质鲜美、生长速度快、环境适应力强的特点,进而深受渔民和消费者的喜爱[1-2]。21世纪以来,我国克氏原螯虾养殖技术日益成熟完善,养殖方式愈发多元,养殖产量也日益增长。据中国渔业统计年鉴统计,我国克氏原螯虾2018年产量达163.87万t,2019年达208.96万t,首次突破200万t,2020年虽受疫情影响,产量仍达239.37万t[3],创下历史新高。当前,克氏原螯虾已成为我国第六大淡水经济养殖品种。然而在逆向选择、捕大留小的生产模式下,养殖后代病害频发、规格参差不齐,严重制约克氏原鳌虾产业的持续健康发展,亟需通过良种选育来提高种质性能,促进产业持续健康发展。大量的水产养殖经验告诉我们,优秀的种质来源决定了水产生物生产养殖的命脉,而在新品种选育过程中,对国内已存在的主要遗传资源进行遗传评估成为首先需要解决的问题。
遗传多样性常用来评估用于选育种质的选择空间,因而受到国内外学者的重点关注。对于克氏原螯虾遗传多样性的研究,当前主要集中在分子标记及区域群体的选择上。关于分子标记,常用的检测方法有Random Amplified Polymorphic DNA(RAPD)[4-5]、Amplified fragment length polymorphism (AFLP)[6]和Simple Sequence Repeats(SSR)[7-8]。其中,SSR以高的多态性和共显性[9],成为研究克氏原螯虾遗传多样性和遗传关系的首选技术。关于区域群体的选择则较为广泛,遍及全国克氏原螯虾养殖生产省份。邢智珺等采用8个微卫星标记分析了江苏省境内8个地区克氏原螯虾的遗传多样性[10];黄小芳等利用8对微卫星引物分析了广西境内5个地区克氏原螯虾遗传多样性[11]。研究结果均表明,选点区域内克氏原螯虾群体遗传多样性丰富。以上研究选点分布集中于单一或少数的省份,尚未就全国范围内典型水域的野生克氏原螯虾群体开展研究。为此本研究进行了江苏洪泽湖(HZH)、湖北洪湖(HH)、湖南洞庭湖(DTH)、山东微山湖(WSH)、安徽巢湖(CH)、江西鄱阳湖(PYH)6個典型水域克氏原螯虾野生种质资源遗传多样性水平的差异研究,以期为克氏原螯虾养殖提供重要的亲本来源,为新品种的选育和野生种的资源保护工作提供参考。
1 材料与方法
1.1 试验动物
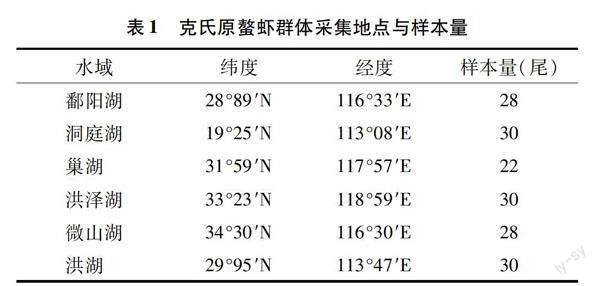
分别从江苏洪泽湖(HZH)、湖北洪湖(HH)、湖南洞庭湖(DTH)、山东微山湖(WSH)、安徽巢湖(CH)、江西鄱阳湖(PYH)六大淡水湖泊中捕捞克氏原螯虾群体,各群体取22~30尾个体。由表1可知,雌雄加以区分,剪去尾节,置于预先备好装有乙醇的2 mL离心管中,-20 ℃保存。
1.2 基因组DNA提取
总基因组DNA提取采用苯酚/三氯甲烷法[12]提取尾节组织的总基因组DNA,DNA通过琼脂糖凝胶电泳检验纯度,[HJ1.5mm]紫外分光光度计测定D260 nm和D280 nm,合格的DNA稀释浓度至0.05 mg/L,保存于 -20 ℃ 加以备用。
1.3 微卫星引物扩增
参考GenBank已发表的微卫星序列[13]及本实验室自行开发的微卫星序列共14对(表2)。正向引物的5′端FAM标记,委托无锡天霖生物有限公司加以合成。PCR反应总体系:DNA模板 2.0 μL,Taq酶12.5 μL,上下游引物各1.0 μL,最后加灭菌的超纯水至25.0 μL。
PCR反应程序为:94 ℃预变性5 min;94 ℃变性10 s,在最适退火温度下退火10 s,72 ℃延伸 15 s,30个循环;最后72 ℃再延伸10 min,4 ℃保存。PCR产物通过ABI3730XL测序仪(美国应用生物系统公司)进行毛细管电泳检测,通过GeneMarker软件进行基因型分型。
1.4 数据分析
利用14对SSR标记鉴定到的6个克氏原螯虾群体的基因型,使用Popgene32(v1.3.2)软件[14]对6个克氏原螯虾群体的等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)、似然比检验Hardy-Weinberg平衡、遗传分化指数Fst(F-statistics,Fst)、Neis标准遗传距离(Ds)和中性进行分析检测。使用Genepop的列联表方法进行连锁不平衡分析[15]。使用Botstein等的方法计算每个位点的多态信息含量(PIC)[16]。遗传结构分析采用Structue 2.3软件[17],遗传结构图绘制采用CLUMPP1.1.2[18]和distruct软件[19]。
2 结果与分析
2.1 克氏原螯虾遗传多样性分析
通过毛细管电泳检测14对微卫星引物在168份样品中的基因型及其频率分布,14个微卫星位点在6个克氏原螯虾群体内共检测到等位基因124个。由表3可知,这些标记在单个的克氏原螯虾群体中的等位基因数在3~14之间,等位基因数最多的是PCLG08位点。各群体内的等位基因数在1~8之间不等,平均等位基因数最低的是巢湖群体,仅为1.93;最高的是洪泽湖群体,数值达4.14;其余群体的平均等位基因数均处于2~3之间不等。各群体的有效等位基因数在1.00~5.16之间,数目最多的同样是PCLG08位点。从等位基因数和有效等位基因数的结果来看,洪泽湖群体分别有11个和9个位点的数值最高,数值最高的位点数量远超其他群体。而在观察杂合度和期望杂合度2项指标上,洪泽湖群体同样多数位点指标数值显著高于其他群体。14对微卫星的中性测试分析见表4,可知各个位点都处于95%置信区间范围内,属中性位点。
由表5可知,根据香农指数分析,洪泽湖克氏原螯虾群体的遗传多样性最为丰富, 其余5组克氏原螯虾群体的遗传多样性相差较小,群体间变异程度低。此外,各群体的多态信息含量介于0.26~0.73之间。当PIC值>0.5时,定义为高多态性;当PIC值处于0.25~0.50之间,定义为中度多态性。本调查分析中,洪泽湖群体在14个位点中均处于高度多态水平。巢湖群体有3个中度多态位点,11个高度多态;洞庭湖群体有6个中度多态位点,8个高度多态位点;洪湖群体有3个中度多态位点,11个高度多态位点;鄱阳湖群体有5个中度多态位点,9个高度多态位点;微山湖群体有2个中度多态位点,12个高度多态位点。综合可知,洪泽湖群体多态性水平最高,遗传多样性也最为丰富,最适合作为养殖生产中的亲本来源。
2.2 6个群体Hardy-Weinberg平衡分析和连锁不平衡检验
Hardy-Weinberg平衡分析结果,由表6可知,没有1对位点在6个群体中都符合哈代温伯格平衡,各个位点在各群体中均存在明显的哈代温伯格平衡偏离现象。其中,仅有PCLG10位点在2个群体中存在哈代温伯格平衡偏离,剩余的标记位点均在多个群体出现Hardy-Weinberg平衡偏离情况。
对6组克氏原螯虾群体进行连锁不平衡检测,共检测到59个基因座位对,其中,巢湖群体和洪泽湖群体均存在6个连锁座位对的不平衡状态,鄱阳湖群体是连锁座位对处于不平衡状态最少的群体,仅为3对,与此同时,各个群体处于不平衡状态时相应的连锁座位对并不相同。对于整个群体而言,一共检测到9个连锁座位对处于不平衡状态。
2.3 6个群体遗传距离分析
遗传距离结果见表7,可知6个克氏原螯虾群体的遗传一致度(I)在0.127 8~0.643 9之间,遗传距离(D)在0.440 2~2.057 3之间。遗传一致度的数值结果同遗传距离数值成反比关系,遗传一致度数值越大,遗传距离越小,反映出的亲缘关系也越接近。6组不同区域的克氏原螯虾群体中,微山湖和鄱阳湖群体间的遗传一致度最高,数值达0.643 9,对应的遗传距离则为最小的0.440 2,说明微山湖和鄱阳湖这2个群体亲缘关系较近。亲缘关系最远的是洪湖和鄱陽湖群体,这2个群体的遗传距离达2.057 3,数值相比其他群体差距明显。长年迁徙下,群体间的遗传距离结果偏大,各群体间交流受阻,群体为适应当地生活环境而出现分化现象。
2.4 克氏原螯虾遗传结构分析
Fis结果显示,14个位点均出现负值,数值最小的是PCLG28位点,Fit结果显示,8个位点出现负值,数值最大的是PCLG10位点,仅为0.3,尚未达0.5水平。Nm反映了群体间的交流程度,Nm越大,基因交流越为频繁[20],在数值上同Fst值成反比,Fst是反映遗传分化的指标。PCLG02位点下的群体交流程度较为频繁,达4.81,同时,群体间的Fst数值大多接近0.5,6个群体仅存在微弱的基因交流,同时群体间已经出现高度分化现象。这可能与克氏原螯虾自身习性密切相关,大部分时间栖息于自掘的洞穴内,且游泳运动水平不强引起相互间交流较少。AMOVA分析结果见表8,可知39.65%的变异来自于群体间,97.99%的变异来自于个体间(P<0.01),个体间的遗传变异程度远大于群体间。
运用Structure软件对6个克氏原螯虾群体的遗传结构进行分析,执行K=2~6的假设,设定10次重复,结果见图1。K=2时,巢湖群体和鄱阳湖群体遗传结构没有差异;K=3时,鄱阳湖群体和洪泽湖群体遗传结构没有差异;K=4时,巢湖群体和洪泽湖群体遗传结构差异不明显; K=6时, 各群体间遗传结构差异不如K=5时更为明显。综合来看,K=5时,结果最佳。
3 结论
3.1 我国大型淡水湖泊克氏原螯虾遗传多样性丰富
遗传多样性作为生物多样性的重要组成部分,是衡量生物携带遗传信息程度的重要指标,其水平可直接反映物种的遗传变异程度,而遗传变异程度恰能反映物种的生长性能、繁育性能等育种指标情况。对克氏原螯虾的溯源及入侵路线问题,国内的许多水产研究者已经进行过长足的研究,收集了多个水系多重地域的克氏原螯虾种质群体进行遗传分析,已经初步得出,克氏原螯虾从我国江苏省南京市引入,同时伴随长江、淮河两大水系逐渐向外扩展[21]。
相较以往的研究,本研究采样点符合主要克氏原螯虾群体养殖分布和迁移路线,涉及湖南、湖北、安徽、江西、江苏、山东6省,且均来源于我国境内知名的大型淡水湖泊,研究对象更加富有代表性。其次,所选取的14个微卫星位点均为中高度多态性位点,结果更能精确反映这些群体的真实遗传多样性水平。运用14对微卫星引物测出6个不同克氏原螯虾群体的平均期望杂合度0.81,平均多态信息含量0.42~0.59,综合观察发现,六大淡水湖泊的克氏原螯虾具有较高的遗传多样性。遗传多样性大小依次为洪泽湖>洪湖>微山湖>巢湖>鄱阳湖>洞庭湖。造成这样的原因可能是克氏原螯虾从南京市引入,而洪泽湖隶属淮河水系地理位置上同属江苏省,较好地保留了初始时的种质特征。另外很重要的一点是洪泽湖水域环境复杂,水生植物丰富,给个体间的交流提供了良好的环境条件。洪湖地处的湖北省近些年来一直都是我国克氏原螯虾养殖产量最大的省份,围绕水域湖泊更是兴建了许多人工养殖基地,人为的引进种同野生种之间获得了基因交流的机会,自身遗传多样性相对较高。此外,环境因素与生物遗传多样性息息相关,物种迫于环境压力而引起自身的遗传变异,同样也是造成区域物种遗传多样性水平变化的重要原因。综合发现,洪泽湖克氏原螯虾群体遗传多样性最丰富,最适合作为人工选育的亲本来源。除此外,还可通过建立适当规模的克氏原螯虾种质资源保护区,进而有效地留住野生种资源。与之前研究相比,虽说存在采样点经纬度上微弱的差异,但产生的结果却是一致的,即我国大型淡水湖泊内克氏原螯虾野生种群的遗传多样性丰富,可进一步为良种选育提供优质的种质资源。一般来说,外来引进物种常受瓶颈效应和遗传漂变作用影响,生物多样性会有所降低[22],外来引入的克氏原螯虾可能经过多次杂交及人为的多次引入,造成自身遗传多样性不降反升,这一问题需要引起重点关注。
3.2 我国克氏原螯虾群体分化现象严重
克氏原螯虾的引入至今已有60~70年,喜攀爬使其很容易从当前水体跨越进入其他水体,进而同其他水体的相同物种进行长期杂交,加上受到不同的空间水文影响、山川河流阻隔,为群体间的分化创造了条件。除此,人为引种也会加剧原本亲缘关系相近的物种在不同区域的分布[23]。
本研究采用14个多态位点对6个地域的克氏原螯虾分析测试发现,各群体均存在显著的杂合子不足现象。杂合子不足现象多由物种间非随机交配或近亲杂交引起,常见于多个物种间[24]。其中,近亲杂交在克氏原螯虾的群体内极为普遍。首先,幼年虾体初期会附着于母体腹部寻求庇护,此期间内亲缘关系相近的幼虾会发生近交现象。更重要的是,受市场需求刺激,大规模的捕捞引起野生种群数量锐减,种群世代间基因比例波动大。非随机交配和近交结果导致了所有检测位点在所有群体中均偏离哈代温伯格平衡,仅有少数位点在单一群体满足哈代温伯格平衡,这说明群体间已经出现基因型的分化差异。分化的原因可能源于为了适应环境变化的压力。除此之外,克氏原螯虾作为一种经济水产作物,近些年养殖规模逐渐扩大,人工养殖区域和密度日益增加,而大型淡水湖泊恰好提供了适合进行克氏原螯虾养殖的天然理想化场所,再经长期的地理隔离效应,已形成相对独立的类群。
参考文献:
[1]Senol R,Kilic S,Tasdelen K. Pulse timing control for LED plant growth unit and effects on carnation[J]. Computers and Electronics in Agriculture,2016,123:125-134.
[2]倪静静. 水温、pH和饲料对克氏原螯虾摄食行为及其肉质的影响[D]. 扬州:扬州大学,2016.
[3]农业农村部渔业渔政管理局. 2020年中国渔业统计年鉴[M]. 北京:中国农业出版社,2020.
[4]Barbaresi S,Gherardi F,Mengoni A,et al. Genetics and invasion biology in fresh waters:a pilot study of Procambarus clarkii in Europe[M]. Springer Netherlands,2007:381-400.
[5]Macaranas J,Mather P,Hoeben P,et al. Assessment of genetic variation in wild populations of the redclaw crayfish (Cherax quadricarinatus,von Martens 1868) by means of allozyme and RAPD-PCR markers[J]. Marine and Freshwater Research,1995,46(8):1217-1228.
[6]黃 羽,戴银根,毕成武,等. 长江中下游地区6个克氏原螯虾群体遗传多样性分析[J]. 南昌大学学报(工科版),2011,33(3):243-247.
[7]王长忠. 长江中下游地区克氏原螯虾群体遗传多样性分析[D]. 武汉:华中农业大学,2009.
[8]邢智珺. 江苏克氏原螯虾典型群体遗传多样性微卫星分析[D]. 上海:上海海洋大学,2014.
[9]秦海峰,龙 宁,吴建国,等. 甜叶菊微卫星富集文库的构建与多态性标记的筛选[J]. 作物学报,2014,40(3):447-456.
[10]邢智珺,姜虎成,陆 伟,等. 江苏8个克氏原螯虾群体遗传多样性微卫星分析[J]. 上海海洋大学学报,2014,23(5):656-662.
[11]黄小芳,唐章生,刘俊丹,等. 广西不同地区克氏原螯虾群体遗传多样性微卫星分析[J]. 南方农业学报,2020,51(2):437-444.
[12]Sambrook J,Fritsch E F,Maniatis T. Molecular cloning:a laboratory manual[M]. New York:Cold Spring Harbor Laboratory Press,1989.
[13]Belfiore N M,May B. Variable microsatellite loci in red swamp crayfish,Procambarus clarkii,and their characterization in other crayfish taxa[J]. Molecular Ecology,2000,9(12):2231-2234.
[14]Yeh F. Population genetic analysis of codominant and dominant markers and quantitative traits[J]. Belgian Journal of Botany,1997,129:157.
[15]Rousset F. GENEPOP007:a complete re-implementation of the genepop software for Windows and Linux[J]. Molecular Ecology Resources,2008,8(1):103-106.
[16]Botstein D R,White R L,Skolnick M H,et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. American Journal of Human Genetics,1980,32(3):314-331.
[17]Hubisz M J,Daniel F,Matthew S,et al. Inferring weak population structure with the assistance of sample group information[J]. Molecular Ecology Resources,2009,9(5):1322-1332.
[18]Jakobsson M,Rosenberg N A.CLUMPP:a cluster matching and permutation program for dealing with label switching and multimodality in analysis of population structure[J]. Bioinformatics,2007,23(14):1801-1806.
[19]Rosenberg N A. Distruct:a program for the graphical display of population structure[J]. Molecular Ecology Notes,2004,4(1):137-138.
[20]刘倩倩,叶浩婷,李 放,等. 杭白芷种质资源遗传多样性的SSR分析[J]. 南方农业学报,2018,49(3):418-423.
[21]Yeh F C,Boy T J B. Population genetic analysis of codmminant and dominant markers and quantitave traits[J].Belgian Journal Botany,1997,129:157-163.
[22]Facon B,Pointier J P,Glaubrecht M,et al. A molecular phylogeography approach to biological invasions of the New World by parthenogenetic Thiarid snails[J]. Molecular Ecology,2003,12:3027-3039.
[23]黄 羽. 鄱阳湖流域克氏原螯虾的资源状况及长江中下游克氏原螯虾遗传多样性研究[D]. 南昌:南昌大学,2012.
[24]Serrano M,Calvo J H,Martínez M,et al. Microsatellite based genetic diversity and population structure of the endangered Spanish Guadarrama goat breed[J]. BMC Genetics,2009,10:61.
收稿日期:2022-04-13
資助项目:中国水产科学研究院基本科研业务费(编号:2022XT01);江苏省种业振兴“揭榜挂帅”项目(编号:JBGS[2021]123);中国水产科学研究院淡水渔业研究中心基本科研业务费项目(编号:2021JBFM21)。
作者简介:高 杨(1997—),男,安徽铜陵人,硕士研究生,研究方向为水产动物遗传育种。E-mail:1463455739@qq.com。
通信作者:苏胜彦,博士,副研究员,研究方向为虾蟹遗传育种,E-mail:ouhaicourse@hotmail.com;朱 健,博士,研究员,研究方向为水产动物遗传育种和水产养殖,E-mail:zhuj@ffrc.cn。

