茶树NF-Y基因家族鉴定及非生物胁迫下的表达分析
许芳芳 刘文祥 郑伟 孙耀清 王辉

摘要:NF-Y(nuclear factor-Y,NF-Y)通常是以NF-YA (CBF-B/HAP2)、NF-YB (CBF-A/HAP3)和NF-YC (CBF-C/HAP5) 3种亚基构成异源三聚体的形式调控下游基因的表达,并在生物与非生物胁迫耐受性等方面起着重要作用。本研究在茶树基因组中鉴定分类了茶树NF-Y基因家族成员,为后续的功能分析研究做准备。在研究中鉴定出45个NF-Y转录因子亚基(10个NF-YA,20个NF-YB,15个NF-YC)。染色体定位和同义分析表明,茶樹NF-Y基因分布在14条染色体上,9对基因具有大片段复制,4对基因串联复制,片段复制是家族成员扩张的主要方式。通过序列分析,所有的NF-Y基因具有高度的结构保守性,大多数NF-Y基因有2个以上的内含子。通过启动子顺式元件分析发现,大部分基因含有激素和应激反应元件。转录组分析显示,一部分基因在干旱情况下出现不同程度的转录组丰度增加,而在盐处理后基本没有变化或出现不同程度的丰度下降。随后的qRT-PCR结果显示,在选定的4个基因中,CsNF-YA6、CsNF-YB4在20%PEG处理下出现不同幅度的上调,200 mmol/L 盐处理下,CsNF-YA6、CsNF-YB4、CsNF-YC5在盐处理后2 d出现轻微上调。结合qRT-PCR结果分析表明,在候选基因中存在介导茶树响应干旱胁迫与盐胁迫途径的基因。综上所述,茶树NF-Y基因在茶树非生物胁迫防御等多方面响应并发挥作用,本研究也为揭示相关NF-Y基因在茶树干旱胁迫与盐胁迫下的确切作用奠定了基础。
关键词:茶树;NF-Y家族;干旱胁迫;全基因组分析;基因表达
中图分类号:S571.101文献标志码:A
文章编号:1002-1302(2023)05-0081-13
干旱是限制全球农作物产量的主要制约因素之一。干旱胁迫等非生物胁迫不仅导致植物细胞损伤、破坏细胞结构并降低酶的活性等,更重要的是会对植物生长发育造成影响,导致作物产量下降[1-2]。研究还表明,茶叶的超氧化物歧化酶活性在短期或轻度干旱胁迫下增加,但在长期或严重干旱胁迫下降低,茶树[Camellia sinensis (L.) O. Ktze.]衰老会更快。干旱胁迫不仅会影响茶树代谢活动以及生长发育,同时干旱还会导致茶树芽叶数量、长度以及百芽质量等方面明显下降,造成茶产量下降;并且导致茶叶中主导茶叶品质的总游离氨基酸、咖啡碱和水浸出物等品质成分降低。近年来随着研究深入,NF-Y基因家族也被发现响应干旱处理,在干旱处理下,过表达BnNF-YA3的拟南芥在种子萌发、根生长上发挥作用[3];NF-Y基因作为参与非生物胁迫的基因在调节植物抗逆性上的功能逐渐被挖掘,这在其他物种中也已经被证实,NF-YB 基因与NF-YA、NF-YC基因之间具有协同作用并介导干旱等非生物胁迫。
核因子NF-Y是普遍分布于真核生物中的一类转录因子,又叫亚铁血红素激活蛋白(heme-activator proteins,简称HAPs)或CCAAT结合因子(CCAAT-binding factor,简称CBF),NF-Y蛋白是转录因子家族,普遍存在于真核生物中,每个基因家族不仅代表其蛋白结构具有一定的相似性,更是代表基因之间具有功能上的相似性。NF-Y基因家族属于CCAAT结合因子家族,最初定义为酵母蛋白中的血红素激活蛋白(HAP)家族。NF-Y转录因子因含有3种不同亚基被分为3个部分:NF-YA (HAP2/CBF-A)、NF-YB (HAP3/CBF-B)、NF-YC (HAP5/CBF-C)。由于近年来NF-Y基因在干旱胁迫下功能逐渐被挖掘,在植物中,已经有多种植物的NF-Y家族基因被鉴定出来,在拟南芥中一共鉴定出36个(10个NF-YA,13个NF-YB、13个NF-YC亚基)NF-Y基因[4],同时在拟南芥的转基因研究中发现拟南芥大多数NF-YA基因在干旱胁迫下表达上调[5]。在杨树中,共鉴定出52个NF-Y基因,并通过生信分析预测候选基因PtNF-YA3在抗逆性上可能有作用[6]。目前已有研究证实NF-YA相关基因在非生物胁迫中发挥作用,过量表达小麦TaNF-YA10-1的拟南芥植株在盐胁迫下显著上调[7],AtNF-YA5的过度表达也可以提高转基因植物的耐旱性,减少叶片失水[8];此外,OsNF-YA7还被证实有可能以不依赖脱落酸(ABA)的方式增强水稻的耐旱性[9]。在NF-YB相关基因的研究中发现在狗尾草中SiNF-YB8在提高大豆抗旱性方面发挥了关键作用,同样的在TaNF-YB3的研究中发现TaNF-YB3参与调节ABA信号通路,并呈现出改善植物抗旱性的作用[10]。在NF-YC相关基因的研究中发现在百慕大草中Cdt-NF-YC1的过表达水稻植株在干旱和盐胁迫下增强了植株的耐受性,并对ABA的敏感性增加,拟南芥ABF3和ABF4与NF-YC一起通过在干旱条件下诱导SOC1转录来促进开花[11]。
茶树原产于东亚,在我国云南省、四川省等地分布广泛。茶因含有多酚类化合物、咖啡碱等多种生物活性物质以及抗氧化、延缓衰老、治疗疾病等多种功效在某某领域广泛应用,不仅营养丰富而且具有极高的经济价值。尽管对于NF-Y基因的研究已经很多,茶树全基因组重组序列的公布为茶树NF-Y基因家族的鉴定与挖掘提供了便利,但是对于茶树NF-Y基因家族的分析由于基因组未完全组装存在着不确定性。本研究依据生物信息学方法从茶树基因组中鉴定并分类CsNF-Y家族成员,并确认家族基因染色体位置,在分析基因重复、系统发育关系、基因结构和保守域以及顺式元件的基础上阐述CsNF-Y基因的生物学功能。通过 qRT-PCR 分析CsNF-Y基因的表达模式,分析它们在干旱与干旱ABA胁迫下的作用。以期为后续研究提供信息支撑。
1 材料与方法
1.1 材料处理
试验材料来源于信阳农林学院教学实践茶园,选取生长状态良好、长势基本一致的二年生福鼎大白茶树移栽花盆中(丹麦泥炭土),设置人工气候室生长条件为温度(22±2) ℃,湿度65%,以未处理的植株作为对照(CK),进行模拟干旱(20% PEG-6000)、高盐(200 mmol/L NaCl)处理,200 mmol/L 氯化钠溶液和20% PEG-6000溶液分别浇灌植物(500 mL溶液),处理(0、24、48、72 h)后使用1芽3叶(混样)的方法采样。每个处理保持3个生物学重复,取样后液氮速冻后保存于-80 ℃备用。
1.2 茶树NF-Y基因家族鉴定
在拟南芥信息资源库(TAIR;http://www.arabidopsis.org/)下载36个已经报道的拟南芥 NF-Y 蛋白序列备用,茶树候选基因是通过在Pfam蛋白家族数据上下载隐马尔可夫模型(PF02045和PF00808),以E-value<1.0e-10对茶树基因组进行检索。基因组与蛋白组数据从TPIA数据库(http://tpia.teaplant.org/)下载。为了确认结果无误筛掉非基因家族基因,将所得的基因蛋白序列上传至PfamScan (https://www.ebi.ac.uk/Tools/pfa/pfamscan/)与SMART (http://smart.embl-heidelberg.de/)上,以E-value<1.0e-10进行检索,通过检索结果查看基因是否含有NF-Y结构域,然后做进一步筛选。此外,Siefer对NF-Y 3个亚族结构的描述如下:NF-YA保守结构域序列:f-V-N-A-K-Q-Y-h-x-I-l-r-R-R-q-x-R-A-k-l-E-a-x-x-K-l-i-k-x-R-K-P-Y-l-H-E-S-R-H-x-H-A-x-r-R-p-R-G-s-G-G-R-E,NF-YB保守结构域序列:r-e-q-D-r-x-L-P-I-A-N-v-x-R-I-M-K-x-x-L-P-x-x-n-x-k-i-s-k-D-A-K-e-t-x-Q-E-C-v-s-E-F-I-S-F-v-T-s-E-A-s-d-k-C-q-x-E-k-R-K-T-I-n-g-d-D-x-L-w-A-m-x-t-L-G-F-x-d-Y-x-e-p-L-x-k-x-Y-x-L-x-k-y-R-e-x-x-e-g-e,NF-YC保守结构域序列:l-P-l-a-R-I-K-K-I-M-K-x-D-e-D-V-x-m-I-s-a-e-A-P-x-l-f-a-K-A-c-E-M-F-I-x-e-L-T-x-R-s-W-x-h-t-e-e-n-k-R-r-T-l-q-k-x-d-i-a-a-A-v-x-r-x-d-x-x-f-D-F-L-x-x-D-x-V-P,大写字母是完全保守的位点,小写字母x代表非保守位点,其他均为相对保守的位点,通过保守结构域序列比对进一步筛选。
1.3 序列比对和系统发育分析
首先对CsNF-Y使用DNAMAN6.0进行蛋白序列比对并对保守结构域(>75%)进行标记,其次将茶树、拟南芥[4]的NF-Y基因一起进行多重序列比对(Clustal W),再构建进化树进行进化分析。使用MEGA 6.0软件以ML(maximum likelihood)法构建并进行bootstrap测试(n=1 000),进化树使用Evolview (https://evolgenius.info//evolview-v2)在线工具进行美化。
1.4 茶树NF-Y基序与启动子顺势作用元件分析
使用MEME (https://meme-suite.org/meme/tools/meme)对NF-Y基因的保守基序进行鉴定,设置参数:基序数量12,每个基序出现0或者1次,最佳基序宽度范围为6~50个氨基酸残基,最大错配15个。使用TBtools将CsNF-Y基因上游2.0 kb启动子序列提取并提交于PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)鉴定顺势作用元件。结果作图使用TBtools软件[12]。
1.5 染色体定位与复制事件
将鉴定基因通过提供的信息进行过滤整理,使用TBtools将鉴定的CsNF-Y基因可视化定位在茶树染色体上,使用TBtools V1.098669进行同义分析,同时利用DNASP6.0软件对重复复制事件的Ka、Ks、Ka/Ks[13]值进行计算,进一步分析重复复制发生的时间。
1.6 RNA提取,cDNA文库获取
根据十六烷基三甲基溴化铵(CTAB)方法从叶片组织中提取总RNA。每个样品为0.5 g,进行3个生物学重复。使用 NanoDrop ND-1000 (Thermo Fisher Scientific,沃尔瑟姆,马萨诸塞州,美国)测定RNA浓度,并在1%琼脂糖凝胶上测定质量。TBtools用于生成热图。RNA-seq数据可从NCBI-SRA获得(干旱与盐胁迫:ERP012919),首先使用IlluminaRNA-seq软件将原始数据去除低质量reads,并使用HISAT2与茶树基因组[C. sinensis var. sinensis ‘Shuchazao(CSS-SCZ)]对齐。采用KALLISTO软件首先对基因组转录本建立索引,将整理好的转录组数据比对建立好的索引计数获得TPM (每千个碱基的转录每百万映射读取的Transcripts)转录组表达数据。根据TPM表达量制作热图,热图使用TBtools 生成。
1.7 实时荧光定量分析
对试验处理不同节点样品cDNA使用实时荧光定量PCR用于分析基因表达。首先使用Primer 5.0软件设计基因引物,引物长度150~250 bp。使用实时荧光定量分析,以1 μL cDNA模板,10 μL SYBR Premix ExTaq (TaKaRa,日本),2 μL特異性引物,7 μL ddH2O为反应体系;PCR热循环参数如下:95 ℃ 5 min;95 ℃ 20 s,60 ℃ 20 s,72 ℃ 10 s,45个循环。CsPTB-RT是茶树肌动蛋白的特异性引物,用于内部对照,使基因表达正常化.基因的相对表达量采用2-ΔΔCT法进行分析,每个样品进行3次生物重复。
1.8 数据分析
使用SPSS 22.0对所有数据进行统计方差分析并进行学生t检验,使用GraphPad Prism绘图。
2 结果与分析
2.1 茶树NF-Y基因家族鉴定
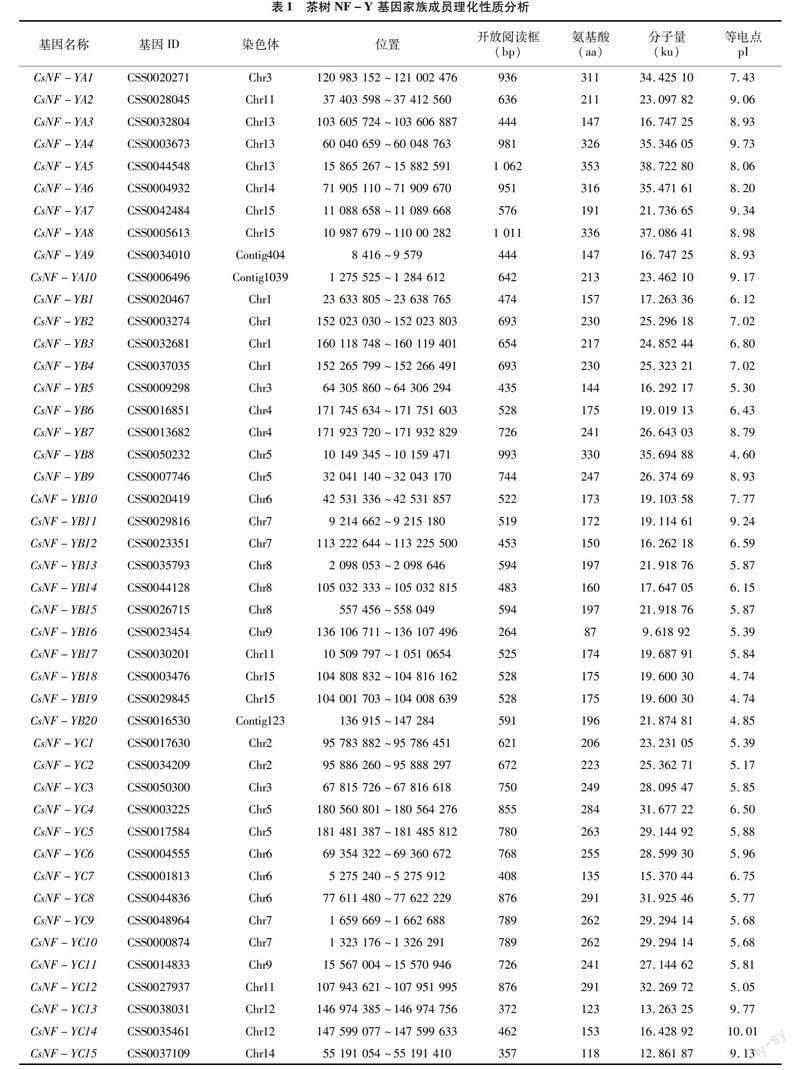
在茶树CSS-SCZ基因组中共鉴定出45个 NF-Y 基因(10个NF-YA、20个NF-YB、15个NF-YC)。为了区分这些基因,根据基因的亚族与染色体位置进行分类命名:CsNF-YA1~CsNF-YA10、CsNF-YB1~CsNF-YB20、CsNF-YC1~CsNF-YC15(表1)。所有基因的基因名称、基因ID、染色体位置、开放阅读框(open reading frame,ORF)、氨基酸(amino acids)、蛋白质分子质量(molecular weight )、等电点(isoelectric point)见表1。通过序列分析,45个CsNF-Ys的氨基酸长度从87 aa (CsNF-YB16)到353 aa(CsNF-YA5)不等,CsNF-Y 3个亚家族中,CsNF-YA长度(范围为147~353 aa,平均长度255.1 aa)最长,其次是 CsNF-YC 长度(范围为118~291 aa,平均长度223.73 aa),CsNF-YB 长度(范围为87~330 aa,平均长度191.35 aa)最短,氨基酸长度具有明显的差异。开放阅读框长度为264 bp (CsNF-YB16)~1 062 bp (CsNF-YA5),预测的分子量为9.62 ku (CsNF-YB16)~38.72 ku(CsNF-YA5),预测理论等电点为4.60(CsNF-YB8)~10.01(CsNF-YC14)。
2.2 2种植物 NF-Y 基因的系统发育分析
本研究根据其氨基酸序列,结合45个茶树 NF-Y(10个NF-YA,20个NF-YB,15个 NF-YC),36个拟南芥NF-Y基因的氨基酸序列构建了进化树(图1)。通过成员数量比较发现,相比拟南芥NF-YB、NF-YC分别扩展了7、2个基因,NF-YA数量一致。进化分析发现,茶树与拟南芥的NF-Y蛋白序列同源性较高,结果表明,相似基因可能在功能上具有相似性。
2.3 CsNF-Y基因的保守基序和基因结构分析
保守基序分析显示,茶树NF-Y基因家族保守基序数量为12个(图2),基序长度范围为15~50 aa,基因保守基序数量范围为2~6个,大多数基因都含有2~6个基序,有趣的是NF-YAs特异性的含有基序(3)和(8),NF-YBs与NF-YCs特异性的都含有基序(1),除了NF-YB16没有基序(2),NF-YBs、NF-YCs其他基因都含有基序(2),同时NF-YCs特异性含有基序(6)。因此,茶树 NF-Y 基因在进化发育过程中是具有很大的差异性的。本研究对茶树NF-Y基因外显子-内含子进行结构分析(图2),分析发现,14个(31.1%)无内含子,6个(13.3%)只有1个内含子,25个(55.6%)为2~6个内含子。因此,大多数基因都有内含子,基因结构相对复杂。
2.4 染色体定位,基因复制与进化分析
染色体定位显示45个基因分布在14条染色体上(图3),大部分染色体上分布2~4个基因,总体来看,基因分布比较均匀,每条染色体上均匀分布了2~4个CsNF-Ys。本研究对茶树NF-Y基因的复制事件进行分析(图4),发现在CsNF-Y基因中,9对基因对为片段复制,4对基因对为串联复制。片段复制事件在染色体分布方面在Chr04上最多,其次是Chr03,而在Chr10上没有复制事件产生。对复制事件发生时间进行分析发现,在剔除CsNF-YA3/CsNF-YA9和CsNF-YB15/CsNF-YB13 2对发生同义突变位点较多、进化距离较远的基因对数据后得到11对复制事件的信息,有趣的是所有基因对Ka/Ks比值小于1,进化时间范围为5.58×106~93.80×106年(表2)。
2.5 茶树CsNF-Y基因的保守结构域
本研究使用DNAMAN 6.0对CsNF-YAs、CsNF-YBs、CsNF-YCs的蛋白序列进行多重比对。结果表明,3个亚科都有保守结构域,在CsNF-YAs中,由52个氨基酸组成的与拟南芥NF-YA保守结构域高度相似的氨基酸结构(图5-A);与CsNF-YAs一样,经过多重序列比对,CsNF-YBs与 CsNF-YCs 分别由84和75个氨基酸组成其保守结构域(图5-B、图5-C),并且结构域与拟南芥 NF-YB 和NF-YC亚家族保守结构域高度相似,这与Siefers对NF-Y3个亚族结构的描述[4]一致。但是,在CsNF-Y基因中个别基因保守氨基酸序列存在缺失和改变,说明基因在进化过程中功能出现分化。
2.6 茶树CsNF-Y基因启动子顺式作用元件
通过顺式作用元件分析发现,基因家族成员相关顺式作用元件共有3类,分别是胁迫相关(防御和压力反应、厌氧诱导、缺氧特异性诱导、干旱诱导、伤口反应元件、低温);发育相关(胚乳表达、种子特异性调控、分生组织表达、玉米蛋白代谢调节、昼夜节律控制、栅栏叶肉细胞、细胞周期调控、胚乳特异性阴性表达、顺式作用调控元件根特异性、光敏色素下调表达);激素相关(赤霉素反应、脱落酸响应、生长素反应、MeJA响应、水杨酸响应)的顺势作用元件(图6-a)。在对非生物胁迫相关顺式作用元件进行分析发现,有22个基因含有1个或多个干旱响应顺式作用元件MBS,3個基因含有GC-motif,35个基因含有脱落酸响应顺式作用元件ABRE(图6-b),结合进化树分析发现,3个亚家族成员中除了CsNF-YB9没有ARE抗氧化顺式作用元件,其余均有ARE顺式作用元件,比较突出的是NF-YB亚家族90%成员含有ABRE顺式作用元件,远高于NF-YA亚家族(60%)、NF-YC亚家族(73%)。
2.7 茶树CsNF-Y基因胁迫下的表达分析
本研究从NCBI-SRA获得RNA-seq数据(干旱与盐胁迫:ERP012919),根据转录组数据分析得出的TPM表达量筛选出NF-Y基因的表达量数据构建45个基因的热图,以观察这些基因的表达水平(图7)。结合热图与启动子分析,本研究发现5个完全无表达基因(CsNF-YB3、CsNF-YB11、CsNF-YC13、CsNF-YC14、CsNF-YC15),表达的40个基因中有22个基因含有不同数量的MBS顺势作用元件,8个基因干旱胁迫下表达量升高,5个基因不表达,其余基因出现不同程度表达量降低。结合进化树分类分析发现,在盐处理下,相对于对照处理3个亚家族大部分基因转录组丰度变化差异很小,没有明显的上升出现,大部分出现降低或维持同一水平,部分基因如NF-YA6与NF-YC5明显响应盐胁迫并负反馈;对于干旱胁迫NF-YB13与NF-YB4、NF-YC7等基因表达出现显著差异。
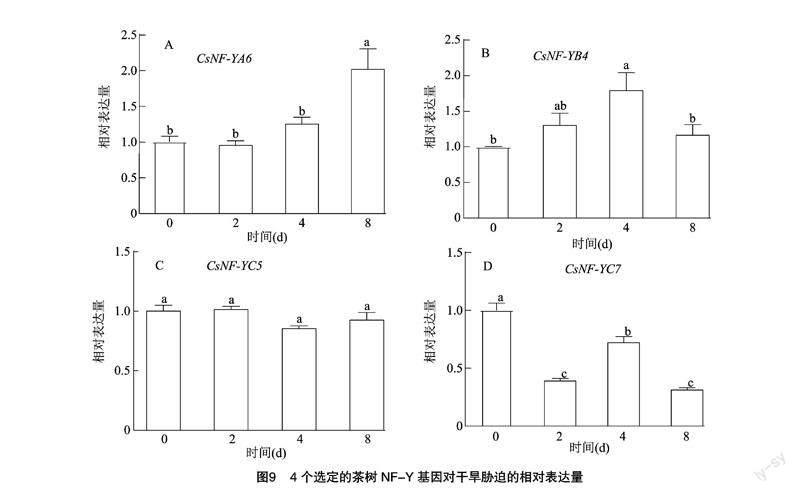
挑选了4个差异表达基因, 通过qRT-PCR分析进一步验证基因在干旱与盐胁迫下的功能(图8、图9),结果发现4个选定的基因(CsNF-YA6、CsNF-YB4、CsNF-YC5、CsNF-YC7)中除CsNF-YC7出现负调控,其他3个基因在盐处理的第2天(48 h)均出现不同程度的显著上调;在进行模拟干旱处理后,CsNF-YA6、CsNF-YB4在处理后4 d均出现明显上调(图9),CsNF-YC5无明显差异,CsNF-YC7明显下调并负反馈。
3 讨论
NF-Y基因已经在很多物种中被证实响应干旱胁迫,目前已经在棉花[14]、柑橘[15]、大麦[16]、小麦[10]、桃[17]中鉴定出NF-Y基因并响应干旱胁迫。Mantovani 对NF-Y基因家族的特性做了描述,其中包括相對保守结构域、亚基分类以及相应的生物学功能[18],这为接下来的分析提供了便利。在茶树中共鉴定出45个NF-Y成员,拟南芥(36个)、柑橘(22个)、西瓜(19个)、梨(24个)、番茄(59个)[19],对比之下茶树的NF-Y基因相对较多,这可能是茶树基因组相对较大或者在进化过程中出现大量的基因复制造成的。基因复制是基因多样化的基础,从而实现了遗传新颖性,因此基因复制也是物种进化与适应的主要来源[20]。本研究中,笔者所在课题组鉴定了45个基因分布在14条染色体上,大多数CsNF-Y基因分布于2端,这可能为CsNF-Y基因复制提供了便利。在45个CsNF-Y基因组中发现有18个基因参与片段复制,7个基因参与串联复制,因此片段复制是其扩张的主要复制方式。由于基因对的Ka/Ks值均小于1,表明所有CsNF-Y基因选择了负纯化选择,同时发现,同源基因对CsNF-YC8和CsNF-YC13氨基酸保守序列相对较少,这可能与发生非同义突变有关。此外茶树的进化起始点尚不清楚,无法判断这些基因的进化是否影响评估物种的产生,但是在 CsNF-Y 基因中可以看到最老的基因重复时间为93.80百万年前,我们从中可以看到这些基因的进化痕迹。
根据保守结构域序列可以对基因进行分类,NF-YB 和NF-YC通过他们的组蛋白折叠结构域(HFD)二聚,它可以以非序列特异性的方式结合DNA,同时作为NF-YA三聚化的支架,然后 NF-YA 特异性识别CCAAT box序列,因此NF-Y成员相互作用于相互作用域与CCAAT位点的DNA结合域识别[21];NF-Y基因在植物发育、生长和繁殖中的特异性特征生长发挥关键作用,这主要得益于NF-Y的亚基组织和DNA结合特性,以及对不同蛋白质模块的适应能力[22]。以已知的酵母、植物和哺乳动物的NF-Y的DNA结合结构域为参照,CsNF-A保守区C端21个氨基酸序列Y-L-H-E-…G-G-R-F被认为,在CCAAT位点与DNA相互作用,推测CsNF-YA保守区N端21个氨基酸序列Y-V-N-A-...-A-K-A-E与其他2个亚基(CsNF-YB和CsNF-YC)相互作用。
NF-YB和NF-YC的保守序列在结构和氨基酸上具有相似性。NF-YB亚基与H2B组蛋白的组蛋白折叠基序相关,而NF-YC亚基与H2A组蛋白相关。以拟南芥中NF-YB的保守区域为参照,31个氨基酸序列:R-x-L-P-…-E-T-x-Q被认为是CsNF-YB的DNA结合域;此外,氨基酸序列A-N-V-x-…T-x-E-A与氨基酸序列 x-R-K-T-…Y-L-x-x长度分别为40 aa与32 aa,被认为是核心区域与CsNF-YA和CsNF-YC相互作用。在CsNF-YC中发现,保守区域的长度为73个氨基酸序列L-P-L-A-D-F-L-V与拟南芥相互作用域相似,被认为是CsNF-YC与CsNF-YA/CsNF-YB相互作用的核心区域,而DNA结合域由2个氨基酸残基“A”和“R”组成,这也是NF-Y基因形成异源三聚体复合物的前提[17],个别氨基酸的突变可能是在进化过程中由于片段复制等原因造成同源性下降,同时也说明了基因家族成员的扩张不仅导致结构域发生变化也导致基因功能分化。
为了确定CsNF-Y基因的进化关系,基于茶树、拟南芥NF-Y基因的氨基酸序列构建了系统发育树。系统发育分析表明,茶树NF-Y基因家族分为3个亚家族(NF-YA、NF-YB、NF-YC),同源关系越近代表着可能具有相似的生物学功能,相关研究中发现,大多数拟南芥NF-YA基因在干旱胁迫下上调表达[23],11个CsNF-YA基因有10个在干旱胁迫下上调表达。此外相关研究中,AtNF-YA5在高ABA浓度下被广泛诱导[8],同样的在茶树中 CsNF-YA6 在干旱诱导下出现上调,而在NF-YB中CsNF-YB4也出现了上调,而对于盐胁迫下只在第2天出现不同程度的上升,表明CsNF-YB4与CsNF-YA6响应干旱胁迫同时响应盐胁迫。在CsNF-YC中,CsNF-YC5、CsNF-YC7对于干旱胁迫与盐胁迫下的表达出现差异,这也验证了之前的结论NF-YC对于干旱的耐受性表达不一致[24],CsNF-YA与CsNF-YB基因与干旱胁迫下的转录模式相似,而CsNF-YC基因与其他非生物胁迫下的转录模式相似。同时这些基因可以作为研究的候选基因,为进一步研究茶树的抗旱抗盐机制提供可能。
基因结构分析表明,大多数茶树CsNF-Y基因有内含子,表明基因结构相对复杂,内含子可以增强它们所含基因的表达[25],CsNF-YA基因具有相似的外显子-内含子结构,并且都具有较多的内含子。为了更全面地研究CsNF-Y基因的进化,对CsN-Y基因保守基序进行研究。每个亚科都具有相似的保守基序与外显子-内含子组织,基因保守基序数为1~6个,其中NF-YA特异性的含有基序(3)和(9),有趣的是NF-YB与NF-YC特异性的都含有基序(1),这可能与NF-YB和NF-YC的保守区域具有同源性有关。
基因启动子中的顺式元素已被证明,在植物生理反应和环境胁迫中是必不可少的。在CsNF-Y基因中笔者所在课题组确定了其激素响应、胁迫响应和植物发育相关的顺式作用元件,其中压力响应顺式作用元件最多,其次是激素响应顺式作用元件。整体上可以看出,NF-YA(4.9个)与NF-YB (4.5个)基因在含有压力顺式作用元件种类和数量上平均值都比NF-YC (4.4个)基因要多。从侧面也验证了NF-YA、NF-YB、NF-YC 3个亚族响应了不同的转录模式,同时NF-YC可能在响应胁迫上不如其他2个亚族。在水稻中,在干旱和高盐胁迫下,响应这2种非生物胁迫的基因启动子区,ABRE元素比那些专门响应单一胁迫的基因启动子区更多。在CsNF-Y基因中都含有1-7个抗氧化顺式作用元件ARE,大部分基因都包含1至6个与ABA相关的顺式作用元件ABRE,同时每个CsNF-Y基因都有光信号响应元件,说明CsNF-Y基因不仅参与了ABA生物通路同时也对植物生长发育具有影响。
相关研究已经证实包括拟南芥NF-YA5、百慕大草Cdt-NF-YC1[26]、大豆GmNF-YA3[27]、拟南芥AtNF-YB1与同源基因玉米ZmNFYB2等基因能顯著提高植株干旱抗性[28]。笔者所在课题组通过qRT-PCR分析表明,4个选定的基因中2个基因在干旱4 d后均出现不同程度的上调,在盐处理下,大部分在2 d均出现上调。在BnNF-YA19、BnNF-YB16的启动子区都包含1个或多个ABRE顺式调控元件,这些基因对NaCl有特异性响应[3],结合顺式作用元件分析,在选定的4个基因中发现大多含有不同数量的ABRE和MBS顺式调控元件。众所周知,ABREs、MBSs、G-boxs、W-boxs这些顺式作用元件在干旱胁迫响应和对下游基因表达的调控上起着重要作用。表明茶树NF-Y基因在干旱与盐胁迫下存在潜在的响应机制。结合在胁迫、发育、激素中存在的其他顺式作用元件,可以说明在茶树中 NF-Y 基因在应激反应和生理发育过程中都有参与。研究结果表明,NF-Y基因响应干旱胁迫与盐胁迫,响应程度的不一致说明了基因参与干旱胁迫与盐胁迫响应途径的不同。
4 结论
自NF-Y家族基因被发现与非生物胁迫密切相关以来,NF-Y基因家族也引来了大家的关注与研究。其中已经在玉米、番茄、桃、大豆上鉴定出了 NF-Y 基因家族成员,并对干旱胁迫等非生物胁迫响应。本研究以茶树为对象,并在茶树中鉴定确认了45个基因成员。通过结构分析、基序分析显示每个亚家族具有典型的特征,对重复事件的分析可以清晰地看到CsNF-Y基因在基因组内通过片段复制进行扩展,通过构建茶树、拟南芥的进化树与抗旱响应启动子顺式元件分析,借助于拟南芥等植物相关基因的功能性报道,笔者所在课题组分析了基因的生物学功能、基因同源关系,并证实了一些基因对如CsNF-YA6、CsNF-YB4具有响应非生物胁迫的功能。这为进一步分析茶树的抗旱与抗盐相关机制打下了基础。最终选取了CsNF-YA6、CsNF-YB4 作为候选基因,为进一步分析研究茶树NF-Y基因的功能并为茶树的抗旱抗盐分子机制提供信息。
参考文献:
[1]Zhu J K. Salt and drought stress signal transduction in plants[J]. Annual Review of Plant Biology,2002,53:247-273.
[2]Yamaguchi-Shinozaki K,Shinozaki K. Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J]. Annual Review of Plant Biology,2006,57:781-803.
[3]Wang J,Jin Z Y,Zhou M J,et al. Characterization of NF-Y transcription factor families in industrial rapeseed (Brassica napus L.) and identification of BnNF-YA3,which functions in the abiotic stress response[J]. Industrial Crops and Products,2020,148:112253.
[4]Siefers N,Dang K K,Kumimoto R W,et al. Tissue-specific expression patterns of Arabidopsis NF-Y transcription factors suggest potential for extensive combinatorial complexity[J]. Plant Physiology,2008,149(2):625-641.
[5]Stephenson T J,McIntyre C L,Collet C,et al. Genome-wide identification and expression analysis of the NF-Y family of transcription factors in Triticum aestivum[J]. Plant Molecular Biology,2007,65(1/2):77-92.
[6]Liu R,Wu M,Liu H L,et al. Genome-wide identification and expression analysis of the NF-Y transcription factor family in Populus[J]. Physiologia Plantarum,2021,171(3):309-327.
[7]Ma X Y,Zhu X L,Li C L,et al. Overexpression of wheat NF-YA10 gene regulates the salinity stress response in Arabidopsis thaliana[J]. Plant Physiology and Biochemistry,2015,86:34-43.
[8]Li W X,Oono Y,Zhu J H,et al. The Arabidopsis NFYA5 transcription factor is regulated transcriptionally and posttranscriptionally to promote drought resistance[J]. The Plant Cell,2008,20(8):2238-2251.
[9]Lee D K,Kim H I,Jang G,et al. The NF-YA transcription factor OsNF-YA7 confers drought stress tolerance of rice in an abscisic acid independent manner[J]. Plant Science,2015,241:199-210.
[10]Yang M Y,Zhao Y J,Shi S Y,et al. Wheat nuclear factor Y (NF-Y) B subfamily gene TaNF-YB3;l confers critical drought tolerance through modulation of the ABA-associated signaling pathway[J]. Plant Cell,Tissue and Organ Culture,2017,128(1):97-111.
[11]Hwang K,Susila H,Nasim Z,et al. Arabidopsis ABF3 and ABF4 transcription factors act with the NF-YC complex to regulate SOC1 expression and mediate drought-accelerated flowering[J]. Molecular Plant,2019,12(4):489-505.
[12]Chen C J,Chen H,Zhang Y,et al. TBtools:an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant,2020,13(8):1194-1202.
[13]Zhang Z,Li J,Zhao X Q,et al. KaKs_Calculator:calculating Ka and Ks through model selection and model averaging[J]. Genomics,Proteomics & Bioinformatics,2006,4(4):259-263.
[14]王园园,赵春月,孙润润,等. 亚洲棉NF-YA基因家族的全基因組鉴定及表达分析[J]. 分子植物育种,2021,19(14):4564-4573.
[15]Pereira S L S,Martins C P S,Sousa A O,et al. Genome-wide characterization and expression analysis of citrus NUCLEAR FACTOR-Y (NF-Y) transcription factors identified a novel NF-YA gene involved in drought-stress response and tolerance[J]. PLoS One,2018,13(6):e0199187.
[16]Liang M X,Hole D,Wu J X,et al. Expression and functional analysis of NUCLEAR FACTOR-Y,subunit B genes in barley[J]. Planta,2012,235(4):779-791.
[17]Li M,Li G X,Liu W,et al. Genome-wide analysis of the NF-Y gene family in peach (Prunus persica L.)[J]. BMC Genomics,2019,20(1):612.
[18]Mantovani R. The molecular biology of the CCAAT-binding factor NF-Y[J]. Gene,1999,239(1):15-27.
[19]Li S,Li K,Ju Z,et al. Genome-wide analysis of tomato NF-Y factors and their role in fruit ripening[J]. BMC Genomics,2016,17:36.
[20]Sémon M,Wolfe K H. Consequences of genome duplication[J]. Current Opinion in Genetics & Development,2007,17(6):505-512. [HJ2mm]
[21]Myers Z A,Holt B F Ⅲ. NUCLEAR FACTOR-Y:still complex after all these years?[J]. Current Opinion in Plant Biology,2018,45(PtA):96-102.
[22]Chaves-Sanjuan A,Gnesutta N,Gobbini A,et al. Structural determinants for NF-Y subunit organization and NF-Y/DNA association in plants[J]. The Plant Journal,2021,105(1):49-61.
[23]Hackenberg D,Keetman U,Grimm B. Homologous NF-YC2 subunit from Arabidopsis and tobacco is activated by photooxidative stress and induces flowering[J]. International Journal of Molecular Sciences,2012,13(3):3458-3477.
[24]Li L L,Yu Y L,Wei J,et al. Homologous HAP5 subunit from Picea wilsonii improved tolerance to salt and decreased sensitivity to ABA in transformed Arabidopsis[J]. Planta,2013,238(2):345-356.
[25]Parra G,Bradnam K,Rose A B,et al. Comparative and functional analysis of intron-mediated enhancement signals reveals conserved features among plants[J]. Nucleic Acids Research,2011,39(13):5328-5337.
[26]Chen M,Zhao Y J,Zhuo C L,et al. Overexpression of a NF-YC transcription factor from bermudagrass confers tolerance to drought and salinity in transgenic rice[J]. Plant Biotechnology Journal,2015,13(4):482-491.
[27]Ni Z Y,Hu Z,Jiang Q Y,et al. GmNFYA3,a target gene of miR169,is a positive regulator of plant tolerance to drought stress[J]. Plant Molecular Biology,2013,82(1/2):113-129.
[28]Nelson D E,Repetti P P,Adams T R,et al. Plant nuclear factor Y (NF-Y) B subunits confer drought tolerance and lead to improved corn yields on water-limited acres[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(42):16450-16455.
收稿日期:2022-08-04
基金項目:河南省林草局科技兴林项目(编号:YLK202138);河南省科技攻关项目(编号:212102110186);信阳农林学院青年基金(编号:QN2021013、QN2021016)。
作者简介:许芳芳(1993—),女,河南驻马店人,硕士,助教,主要从事植物抗逆胁迫及生态保护研究。E-mail:906792515@qq.com。
通信作者:王 辉,硕士,副教授,从事植物造景与养护研究与教学。E-mail:13733159426@163.com。

