小脑在认知与认知功能障碍中的研究进展
唐涣垚,周 亮
(遵义医科大学 贵州省普通高等学校脑科学特色重点实验室,贵州 遵义 563099)
传统研究认为小脑主要调节运动功能,而新近报道发现小脑在调控许多高级认知功能中发挥着不可或缺的作用[1-2]。小脑病变或切除可能会导致不同方面的认知功能受损以及社交行为的异常,例如自闭症谱系障碍(autism spectrum disorders,ASD)和精神分裂症患者常伴随小脑畸形。本文阐述了小脑的神经解剖、认知功能研究进展以及ASD患者小脑结构的变化等方面,以期较深入认识小脑在高级认知功能与认知功能障碍中发挥的作用。
1 小脑的结构与神经投射
按形态结构和进化可将小脑分为小脑前叶、小脑后叶和绒球小结叶,进一步可细分为13个小叶,分别是Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Crus 1、Crus 2、ⅦB、ⅧA、ⅧB、Ⅸ、Ⅹ。其中Ⅰ~Ⅴ属于小脑前叶,Ⅵ~Ⅸ属于小脑后叶,Ⅹ为绒球小结叶。
小脑中主要包括浦肯野细胞和颗粒细胞,其中浦肯野细胞的形态较为复杂。小脑的浦肯野细胞为γ-氨基丁酸(γ-aminobutyric acid,GABA)能神经元,能将抑制性信号发送到小脑的输出核团即小脑深部核团(deep cerebellar nuclei,DCN),通过DCN投射到大脑不同的区域,包括皮层、腹侧被盖区(ventral tegmental area,VTA)、脑桥核(ponti nucleus,PN)以及下橄榄核(inferior olivary nucleus,IO)。每个浦肯野细胞伸出繁杂的平面树突,从平行纤维接收104~105个兴奋性突触[3],还接收单条攀缘纤维的输入,后者是源于脑干下橄榄核神经元的一个轴突分支,沿浦肯野细胞树突主枝“攀缘”而上,沿途形成很多兴奋性突触。
颗粒细胞是脑中数量最多的细胞,位于颗粒层,受到苔藓纤维兴奋性信号的调控。此外,小脑皮质还包含可接收平行纤维信号的3种局部中间神经元——篮状细胞、星状细胞、高尔基细胞。篮状细胞和星状细胞分别向浦肯野细胞胞体和远端树突发送抑制性输出,提供前馈抑制,而高尔基细胞将抑制性信号发送回颗粒细胞,提供反馈控制[4](图1)。

basket cell:篮状细胞;climbing fiber:攀缘纤维;granule cell:颗粒细胞;golgi cell:高尔基细胞;IO:下橄榄核;mossy fibers:苔藓纤维;parallel fibers:平行纤维;purkinje cell:浦肯野细胞;stellate cell:星状细胞。图1 小脑的信号通路联系
小脑和大脑之间存在广泛的双向联系,几乎所有皮层第5层锥体神经元都能发送轴突到达PN,后者的神经元通过苔藓纤维将信号输送至小脑,再由小脑核将抑制性γ-氨基丁酸能神经元的信号转换为兴奋性谷氨酸能神经元,后者将信号经丘脑投射回新皮层,但不能明确投射到新皮层的位置[3]。此外,还有一些小脑区域(主要是VI-VIII小叶和邻近的小脑半球)与新皮层有着密切的联系,尤其是边缘的新皮层区域(图2)。小脑与大脑之间丰富的连接构成了重要的认知功能环路,小脑通过该环路对大脑的认知功能脑区进行调控。
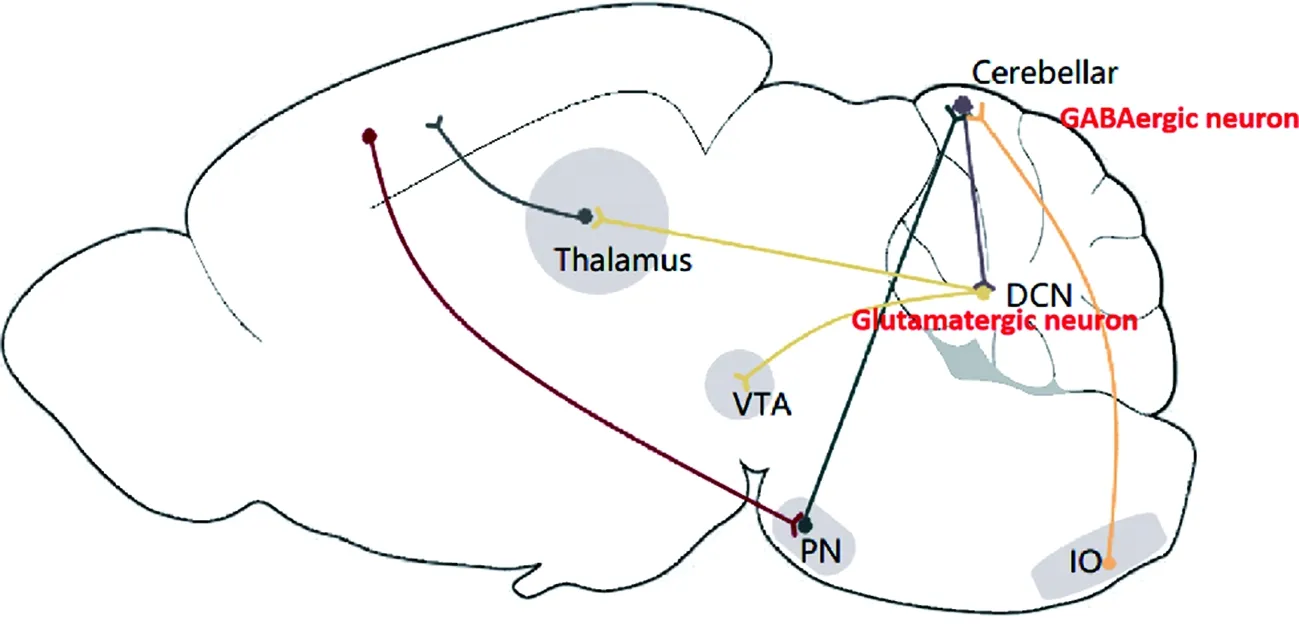
cerebellar:小脑;DCN:小脑深部核团;IO:下橄榄核;PN:脑桥核;thalamus:丘脑;VTA:腹侧被盖区;GABAergic neuron:γ-氨基丁酸能神经元;glutamatergic neuron:谷氨酸能神经元。图2 小脑与其他核团的神经纤维投射联系
2 小脑与认知功能
随着人们对小脑认识的不断深入,研究表明除了传统的运动协调功能外,小脑在调控许多高级认知功能中发挥着不可或缺的作用[1-2],但具体机制仍需进一步探索和挖掘。
2.1 小脑与奖赏 奖赏是一种能产生愉悦和兴奋感觉的正性强化效应,导致趋向行为,最终引导行为加强,诱发生物体有目的、有动机的行为反应。新近研究表明,小脑会影响奖赏相关认知行为[5]。大脑中经典的奖赏回路由多个重要的节点构成,包括VTA的多巴胺能神经元及其2个重要的投射靶点:伏隔核和前额叶皮层[6-7]。部分来源于新皮层的奖赏信号传送至小脑,再由小脑的输出核团DCN发出纤维束经丘脑传至纹状体和前额叶皮层[8-9],或者通过单突触连接传到VTA的多巴胺能神经元上[10]。
有研究表明,小脑核-VTA通路与奖赏系统密切相关[11]。该研究的结果显示,利用光遗传学技术激活这条通路可以明显促进小鼠进入奖赏区域的次数。同样,在明暗箱实验中,小鼠进入白箱时给予一定的光照刺激激活该通路,发现与对照组相比实验组的小鼠进入白箱的次数明显增加,2种实验方法所得结果一致,反映了小脑核-VTA通路与奖赏系统密切相关[11],小脑在奖赏相关的高级认知功能中发挥重要作用。
Gao等[12]将小鼠头部固定,利用胡须辨别物体的位置,观察其向左或向右舔爪报告物体正确位置以获取水奖励,发现内侧小脑核的损伤或者光遗传学干扰会影响小鼠的舔爪选择。采用电生理在前外侧运动皮层(anterolateral motor cortex,ALM)或者小脑核记录神经元放电情况,结果显示这2个位置的神经元表现出相似的激活程度,而用光遗传学抑制ALM能明显减少小脑核中神经元的活性,干扰小脑核也存在相似的情况,以上研究结果揭示了小脑核与ALM之间存在一定的联系。Chabrol等[13]将小鼠放在轨道上奔跑以获得水奖励,并且记录其脑中ALM、外侧小脑核(小脑齿状核)以及位于外侧小脑皮质的浦肯野细胞的放电活性,结果显示接近奖励发放时,这3个区域的神经元开始调控放电活性,在奖励发放时,ALM与齿状核的神经元活性都增强,而浦肯野细胞则会降低自身的活性,减少通过单突触连接输出到齿状核的抑制信号,随之激活ALM,而奖励过后浦肯野细胞放电活性增加,证明奖励发放时浦肯野细胞放电的减少可能是奖励诱发的学习结果。此外,Chabrol等[13]通过在奖励发放之前激活浦肯野细胞来抑制齿状核,发现在短期内ALM大多数神经元的活性被抑制,以上研究结果支持小脑信号输出对于维持新皮层的基本活性十分重要,从而有助于执行任务。
上述研究都表明小脑与奖赏密不可分,小脑能通过与大脑皮质不同核团之间的连接构成多种神经环路来影响大脑功能,但目前对小脑参与奖赏相关的高级认知功能的研究较少,缺乏微观上的理论与证据支持小脑与奖赏之间的联系,今后尚需更多更深入的研究,用多种方法从不同方面对小脑在奖赏过程中的作用进行探索。
2.2 小脑与自闭症 小脑病变或者切除可能会引起不同类型的认知功能受损和异常的社交行为,其形态畸形与成瘾、ASD、认知情感综合征和精神分裂症有着密切联系[14-15]。小脑在神经系统发育疾病中的作用越来越为人们所关注,如智力障碍、ASD、注意力缺陷、多动症和唐氏综合征。目前小脑已被认为是ASD相关的重要脑区之一。
2.2.1 自闭症影响皮层-小脑环路 小脑影响认知功能的基础是“大脑-小脑”环路,即大脑与小脑间广泛的纤维联系,小脑就像丘脑和皮层的上游调控器一样,特定区域的病变会造成整个大脑网络的认知和情感障碍。Ito等[16]提出一个假说来解释小脑在认知功能中扮演的角色,即由前额叶皮层,颞顶皮层以及小脑半球共同编码的神经环路理论。
通过功能性磁共振成像对ASD患者大脑进行检查发现小脑与感觉运动皮层之间连接增加,与联合皮层中主要负责意识管理的多模态脑区(supramodal)连接减少[17-18]。Igelstrom等[19]将与社会认知相关的颞顶交界区分为11个亚区,结果表明ASD患者中右背侧颞顶交界处与小脑左侧Crus Ⅱ区连接减少;而另一个研究报道中左下顶叶与小脑右侧Crus Ⅰ区之间的连接增加[20]。Olivito等[21]研究发现左侧小脑齿状核与皮层之间的静态连接减少,小脑左侧齿状核与多模态脑区之间连接增加,小脑右侧Crus Ⅱ区的体积减小以及它与额叶、颞叶、顶叶之间的连接减少。以上研究结果从不同方面说明ASD患者中存在异常的皮层-小脑环路连接,这可能是ASD认知功能障碍的原因之一。
2.2.2 小脑功能障碍相关的自闭症基因模型 目前的观点认为ASD患者小脑结构和功能存在异常,具体的改变仍处于探索阶段,而大多数ASD都与基因突变相关,且具有高度遗传性。建立相关的基因突变模型对于研究这类患者小脑结构、功能以及相关认知行为的改变十分重要,包括啮齿动物和非人类灵长类动物模型。转基因小鼠模型能证实并扩展基因改变对神经化学和行为的影响,最终有助于寻找ASD的生物标记。下面将逐一介绍相关的基因小鼠模型,如Fmr1、EN2敲除鼠、Staggerer小鼠、Shank3突变小鼠、Tsc1PC和Tsc2PC小鼠、Pten和Shank2敲除鼠。运用这些模型,可以进一步了解小脑功能障碍自身是否会引起ASD相关行为。
ASD小鼠模型存在自闭样行为,同时伴随小脑功能障碍,例如Fmr1、EN2敲除小鼠和Staggerer小鼠。Fmr1基因编码脆性X染色体智力低下蛋白(fragile X mental retardation protein,FMRP),参与发育中的认知功能调节,脆性X染色体综合征(fragile X syndrome,FXS)病人表现出自闭症样的认知功能障碍[22],相应的Fmr1敲除鼠具有多种自闭样行为,如多动症、刻板行为、空间学习能力受损、条件性恐惧减少,且这种模型小鼠小脑中浦肯野细胞树突延长,小脑深部核团体积减小。在Fmr 1敲除鼠和其他ASD模型小鼠上观察到眨眼频率减少[23],已知眨眼条件取决于小脑神经元的突触可塑性,表明这些小鼠存在小脑功能异常。EN2能调控小脑发育相关的基因表达,EN2敲除鼠存在小脑功能异常,如浦肯野细胞的数量减少近40%且小叶形成不良[18],表现出社交能力受损,如社交和攻击性行为减少[24]。Staggerer模型小鼠是RORα基因突变所得,RORα基因对于浦肯野细胞的生存和分化是必需的,Staggerer小鼠的浦肯野细胞在发育期出现丢失,剩下的细胞体积减小,位置也存在异常[20,25],颗粒细胞几乎完全消失,小脑深部核团体积减少,从而引起运动失调、空间学习能力下降、记忆受损、刻板行为以及对新环境的异常反应[26]。
随着研究的深入,发现大约2%的ASD患者存在Shank3基因突变,并出现严重的典型症状和精神障碍,在多种Shank3突变小鼠模型中也得以体现[27]。无论人类还是啮齿动物存在Shank3突变可以观察到小脑畸形,Shank3能控制轴突定位到小脑颗粒细胞树突,其突变会减少谷氨酸受体在突触的表达[28]。最近一项研究采用CRISPR-Cas9技术构建了携带Shank3突变的猕猴,表现出运动缺陷、刻板行为增加以及社交和学习能力受损[29]。
研究表明,在浦肯野细胞中条件性敲除Tsc1,即Tsc1PC小鼠,不仅运动失调,还表现出自闭样行为,包括社交能力受损、刻板行为以及异常的超声发声[30]。Tsc1PC小鼠中浦肯野细胞的内在兴奋性下降,且树突棘密度异常。浦肯野细胞Tsc2敲除的小鼠(Tsc2PC小鼠)也会出现自闭样行为,但没有运动缺陷[31]。在Tsc1PC和Tsc2PC小鼠上使用mTOR抑制剂雷帕霉素均能挽救行为缺陷,有研究报道Pten和Shank2分别对mTOR信号通路和突触形成有重要作用,在浦肯野细胞分别特异性敲除这2个基因,发现Pten敲除会造成浦肯野细胞形态以及放电活性的异常,突变小鼠会表现刻板行为和社交缺陷[32];但是Shank2的缺失则产生不一致的结果,一项研究结果证明会出现异常社交行为和刻板行为[33],而另一项报道显示只有重复行为和焦虑相关行为会有所增加[34]。
综上所述,为明确小脑与ASD之间的关系,条件性转基因模型是常用的方法之一。事实上物种之间,小脑结构高度保守,所以小鼠小脑与人类小脑具有高度相关性,小鼠模型能有效证明小脑缺陷与ASD发病机制密切相关。
3 展望
新近研究表明,小脑信号主要投射至前额叶和后顶叶皮层的多个非运动区域,因此小脑在非运动功能中的作用越来越为人们所关注,包括语言、工作记忆、执行处理、奖赏等高级认知功能。而小脑结构和功能的异常可能产生多种运动和非运动相关缺陷,如ASD患者小脑存在结构、功能以及小脑-皮层连接异常。转基因小鼠在阐明ASD病理生理学的不同机制方面发挥了重要作用,为研究ASD解剖、病理、分子以及治疗提供了良好的基础。在此基础上寻找小脑与ASD之间关联的更有力的证据,可以全面阐明小脑在认知功能中的作用。随着生物学技术的不断发展和运用,为进一步探索小脑非运动功能提供了更好的技术支持,小脑的不同分区之间的功能差异已被逐步揭示,如Ⅶ和ⅧA亚区与工作记忆相关,Ⅵ和Ⅶ亚区与语言相关,而这些不同亚区在认知功能中的调控作用仍有待进一步研究,以期更深入地阐明小脑参与高级认知功能的机制。

