关节镜联合胫骨高位截骨术促进膝关节内侧间室骨性关节炎软骨再生的机制研究
吴疆,赵斌,陈啸,赵谦,骆巍,任富继,黄竞敏
(天津市天津医院运动损伤与关节镜二病区,天津 300211)
随着中国老龄化进程的加剧,膝骨关节炎正成为中老年人群中常见的退行性疾病之一,给患者造成了严重的身心痛苦并加重了社会负担[1]。膝骨关节炎通常会导致关节软骨的磨损,因此对膝关节功能造成严重损伤[2]。膝盖部位的关节炎通常只累及一侧,累及侧往往由于长期受到较大负荷,导致关节对合不良[3]。在股骨和胫骨内侧部位,关节对合不良和纵向软骨丢失均具有明显的关联[4]。
目前,国际上广泛采用胫骨高位截骨术(HTO)治疗膝骨关节炎合并膝内翻,并取得了较好的临床疗效。截骨术能够有效降低内侧间室压力以及疼痛,并且能够延缓骨关节炎的进一步发展及需要进行全膝关节置换术的时间[5-6]。HTO 可以通过修正胫骨,降低患者膝盖内关节软骨的受力程度,改变患者下肢的负重轴线,从而减轻受累侧的负荷[7]。Jung等[8]发现,在经开放楔形胫骨高位截骨术纠正膝内翻之后,即使不采取软骨再生手段,经过两年左右时间,股骨内髁和胫骨内侧平台中退化的软骨仍能够部分覆盖有新生软骨。
研究表明,关节镜联合HTO 能够促进骨关节炎患者的软骨再生[9-10],然而介导此现象的生物学机制仍不清楚。细胞外信号调节激酶(ERK)信号通路与关节软骨细胞的增殖、分化、迁移、凋亡及应激反应等生理过程密切相关,参与骨关节炎发病的整个过程[11-13]。因此,深入研究ERK 信号通路在关节镜联合HTO 治疗骨关节炎疾病中的作用机制具有重大意义。本研究对内侧间室骨性关节炎患者进行关节镜联合HTO 手术治疗,术后1 年,在对上述患者取内固定的同时再次进行关节镜检查,观察术后1 年膝关节内侧间室软骨再生情况;同时取部分新生软骨进行组织病理学检测及分子生物学检测,研究成果有望为骨关节炎临床治疗提供新的思路和方法。
1 对象与方法
1.1 研究对象 本研究共纳入天津市天津医院关节镜科2020 年8 月—2021 年8 月50 例患者。其中男11 例,女39 例。患者平均年龄为(56.0±3.4)岁(54~63 岁),平均体重指数(23.4±3.8)kg/m2(19.6~33.0 kg/m2)。其中包含9 例左膝骨性关节炎以及11例右膝骨性关节炎。所有患者均为膝关节骨性关节炎合并膝内翻,且分级低于Ahlback Ⅱ级,术前膝内翻角平均为192.6°±3.8°(189°~198°)。所有患者均无明显关节不稳,可以进行正常程度的运动。对患者进行关节镜清创联合HTO。术前规划、手术方案以及术后康复训练按照已发表的文献实施[14-16]。患者术后伤口恢复均良好,且1 年内无感染、骨愈合不良、或指甲板断裂等并发症出现。所有患者在进行钢板或螺丝移除时接受二次关节镜检查。纳入患者均知情同意且该研究通过天津市天津医院伦理审查,伦理编号:2020 医伦理085。
纳入标准:(1)膝关节疼痛,活动受限,但日常生活均能独立完成。(2)参加本项研究前2 周未曾服用过消炎镇痛药物。(3)无明显外伤史。(4)影像资料显示单纯膝关节内侧间室骨性关节炎。排除标准:(1)1 年内接受过正规的临床治疗。(2)1 年内有过膝关节手术史。(3)半年内进行过关节内注射治疗。(4)存在全身其他关节疾病。(5)存在神经系统疾病(癫痫等)。(6)存在前庭器官疾病和严重的其他系统疾病。
1.2 方法
1.2.1 关节镜评估 术前对胫骨内侧平台和股骨髁关节软骨进行关节镜观察,术后1 年进行再次观察。采取国际软骨修复协会软骨损伤分级系统(ICRS)对软骨再生进行评分[17]。标准如下:1 级为可见表面细纹或裂缝,或浅表病变;2 级为病变不超过软骨厚度的50%;3 级为病变超过软骨厚度的50%,但是不累及软骨下骨;4 级为病变累及软骨下骨。
患者在移除钢板或螺丝时进行二次关节镜检查,对胫骨内侧平台和股骨髁关节进行再生评分[18-19]。标准如下:1 级为无再生;2 级为具有白色分散的纤维软骨,或者纤维软骨的局部或均匀覆盖。
1.2.2 病理学检测 在患者进行二次关节镜检查时,采集新生骨组织进行病理学分析。用于病理分析的样本,将组织进行固定、脱水并用石蜡包埋后,进行HE、甲苯胺蓝、番红O 固绿染色。此外,对样本进行Ⅱ型胶原的免疫组化染色以确认新生组织为软骨样组织。
1.2.3 qRT-PCR 采用正常软骨作为对照组(A);术后新生组织作为实验组(B)。采用Trizol 法提取所获得的软骨样组织总RNA,使用ReverTra Ace qPCR 逆转录试剂盒,根据说明书将RNA 逆转录为cDNA。待检测靶分子引物序列如下:β-actin:F5′-AGGGGCCGGACTCGTCATACT-3′,R5′-GGCGGCAC CACCATGTACCCT-3′;Collagen Ⅱ:F5′-GCCTGGT GTTCATGGGTTT-3′,R5′-GTCCCTTCTCACCAGGT TTG-3′。根据SYBR®GreenRealtime PCR Master Mix说明书进行qRT-PCR,具体条件:95℃预变性2 min,然后95℃30 s,55℃30 s(记录荧光信号),共40 个循环。β-actin 作为内参,根据公式2-ΔΔCt进行半定量计算[20-21]。
1.2.4 Western 印迹 分析采用正常软骨作为对照组(A);新生组织作为实验组(B)。对所获取的软骨组织,采用RIPA 裂解法提取总蛋白,并用BCA 法测定蛋白含量。之后取10 μg 蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(10% SDS-PAGE),转膜至0.45 μm 的PVDF 膜,经5%脱脂牛奶封闭后,与β-actin(1∶5 000)、collagenⅡ(1∶2 000)、丝裂原活化蛋白激酶激酶(MEK,1∶1 000)、磷酸化丝裂原活化蛋白激酶激酶(p-MEK,1∶1 000)、细胞外调节蛋白激酶(ERK,1∶2 000)或磷酸化细胞外调节蛋白激酶(p-ERK,1∶1 000)一抗4 ℃孵育过夜。次日与相应的HRP 耦联二抗(1∶3 000)孵育,之后利用ECL 化学发光法进行成像分析,采用Image J 软件进行灰度分析[22]。
2 结果
2.1 关节镜评估 新生软骨情况在接受首次关节镜检查时,根据ICRS 分级系统,10 例患者(10%)的胫骨内侧平台或股骨髁关节软骨具有3 级病变,37例患者(74%)具有2 级病变,3 例患者(6%)具有1 级病变。在二次关节镜检查时,2 例患者(4%)为3级病变,26 例患者(52%)为2 级病变,22 例患者(44%)为1 级病变。依据再生评分,在二次关节镜检查时,有47 例患者(94%)能够观察到新生软骨(2 级),仅有3 例患者(6%)未观察到新生软骨(1级)(图1)。
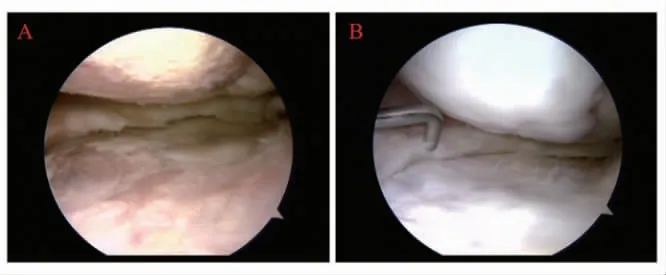
图1 关节镜检测Fig 1 Arthroscopic examination
2.2 病理学及分子生物学评估 新生软骨组织HE和甲苯胺蓝染色结果表明,新生组织周围具有关节软骨的结合或覆盖,并可见明显的纤维化软骨或软骨陷窝(图2A、2B)。番红O 固绿染色结果显示,新生组织内可见呈红色的软骨组织及软骨陷窝,亦可见呈绿色的骨组织(图2D)。免疫组化结果显示,Ⅱ型胶原呈阳性表达(图2C)。
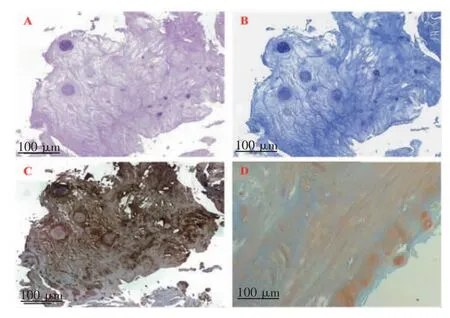
图2 HTO 术后新生组织的病理学染色分析Fig 2 Pathological staining of regenerated tissues after HTO surgery
2.3 新生组织与正常软骨组织CollagenⅡmRNA 表达差异 采用qRT-PCR 检测新生组织(b)与正常软骨组织(a)内CollagenⅡmRNA 的表达情况,结果显示(图3A):新生组织内CollagenⅡ的相对表达量与正常软骨组织间差异无统计学意义(t=0.00,P>0.05)。

图3 再生组织与正常软骨组织ERK 信号通路变化分析Fig 3 Changes of ERK signaling pathway in regenerated tissues and normal cartilage tissues
2.4 新生组织与正常软骨组织CollagenⅡ和MEKERK 信号通路表达差异 Western 印迹结果显示,新生组织(b)与对照组(a)CollagenⅡ表达无明显统计学差异(t=0.00,P>0.05,图3B、3C)。同时,新生组织(b)内p-ERK 和p-MEK 蛋白呈高表达(图3B),两组间表达差异具有明显统计学意义(t=12.8、15.44,均P<0.05,图3D)。
3 讨论
软骨退变是骨性膝关节炎的常见症状。根据软骨的组织学特点,软骨退变通常被认为是不可逆过程。然而,临床研究发现,骨性膝关节炎患者的骨赘面软骨能够分泌Ⅱ型胶原,这些软骨被称作纤维化软骨[17]。作为关节退化的代偿性反应,纤维化软骨可以从关节软骨迁移至外周骨,使得退化的软骨表面得以稳定和恢复,使一些骨性膝关节炎患者的症状逐渐减轻甚至消失[23]。在经截骨术改善患者关节的负重力线后,关节软骨的退行性病变亦可以逐渐减缓或者消失[24]。这些现象说明,退变软骨具有自我修复的潜能。
关节软骨所处的解剖学部位具有十分复杂的生理学和力学微环境,机械刺激对于维持关节软骨正常的结构和功能具有非常重要的意义[25]。Xu 等[26]通过给予大鼠终板软骨细胞间歇周期性机械拉伸发现(0.5 Hz,10%强度,4 h/d,5 d/周),拉伸刺激促进了终板软骨细胞的增殖。Fukuda 等[27]给予终板软骨细胞以不同强度的周期性拉伸,发现低强度的拉伸能促进终板软骨细胞增殖及糖胺多糖合成,然而高强度的拉伸则抑制了软骨细胞增殖及糖胺多糖合成。由此可见,在适度的拉伸强度下,终板软骨细胞的增殖以及合成代谢都得到了增强,有利于软骨结构和功能的维持。然而当拉伸强度超过一定限度时,软骨细胞的增殖则受到抑制,导致关节软骨结构完整性和功能的破坏。在膝关节内侧间室骨性关节炎患者中,内侧间室面的软骨受到超负荷的机械拉伸刺激,引起软骨损伤[26]。HTO 能够降低下肢轴线异常引起的膝内侧间室的负荷,将其转移至膝盖外侧,从而促进膝内侧间室面软骨再生,缓解膝骨关节炎的症状[28]。
本研究采用关节镜发现,在膝内侧间室的软骨损伤处具有新生组织生成。接着,通过HE 染色、甲苯胺蓝染色、Ⅱ型胶原免疫组化确认了这些新生组织为软骨组织。在分子机制层面,发现HTO 术后内侧间室新生组织的Ⅱ型胶原含量与正常软骨相比,没有明显统计学差异,进一步说明HTO 有可能促进缺损部位软骨的修复与再生。另外,通过Western 印迹发现这些组织中高表达磷酸化形式的ERK。ERK分子属于丝裂原活化蛋白激酶(MAPK)家族,在多种细胞中均具有重要信号转导作用[11]。
ERK 被磷酸化之后进入细胞核,启动一系列下游基因的转录,从而影响细胞的增殖和分化过程[29]。Shakibaei 等[30]发现,姜黄素和白藜芦醇可以诱导软骨细胞中ERK 的活化,促进软骨细胞的生存以及增殖,并且抑制了白细胞介素(IL)-1β 诱导的细胞凋亡。相反,ERK 抑制剂则能够抑制软骨细胞增殖。目前尚不清楚ERK 信号是否参与调控接受关节镜联合HTO 的膝骨关节炎患者术后的软骨再生。本研究发现,绝大多数患者在术后1 年左右均出现损伤处的软骨再生,新生组织呈Ⅱ型胶原和磷酸化ERK 高表达。综上得出结论:在膝关节内侧间室骨性关节炎患者中,关节镜联合HTO 能够引起膝关节软骨细胞中ERK 信号通路的活化和细胞增殖,从而促进软骨再生。

