GADD45A 通过端粒替代延长途径调控骨肉瘤细胞增殖
韩鑫宇,李婷芳,王峰
(天津医科大学基础医学院医学遗传学系,天津 300070)
骨肉瘤是一种起源于类骨质组织,常见于儿童和青少年的恶性骨肿瘤,具有极强的侵袭性并且常常在早期发生转移,主要涉及股骨、胫骨和肱骨[1-2]。端粒延长是肿瘤生长所必需的关键过程,不同于绝大多数肿瘤通过激活端粒酶来维持端粒,以骨肉瘤为代表的10%~15%的人类肿瘤通过端粒延长替代途径(alternative lengthening of telomeres pathway,ALT)来维持端粒。使用ALT 延长端粒的肿瘤细胞具有独特的ALT 相关表型,例如含有端粒DNA 的大型早幼粒细胞白血病体(promyelocyte leukemia,PML),称为ALT 相关PML 小体(ALT-related PML bodies,APBs)以及染色体外端粒DNA 环(C-circle)等[3-4]。
生长停滞和DNA 损伤诱导蛋白45a(GADD45A)定位于细胞核,其水平受周期调控,在G1 期最高而S期显著降低。GADD45A 在细胞应激反应中起重要作用[5-6]。此外还有研究表明,GADD45A 参与了小鼠干细胞端粒DNA 损伤反应[7]。GADD45A 在细胞周期进展和停滞、DNA 修复和表观遗传修饰等多方面的作用与ALT 阳性肿瘤频繁的DNA 损伤等特点高度相关[7-8]。因此本文旨在探讨GADD45A 对骨肉瘤细胞生长、端粒功能和端粒延长替代途径的影响。
1 材料和方法
1.1 实验材料 人骨肉瘤细胞U2OS 为本实验室保存,DMEM 培养基(美国Corning 公司),Opti-MEM培养基、胰蛋白酶(美国Gibco 公司),胎牛血清(乌拉圭Lonsera 公司),ChamQ Mix、逆转录试剂盒、dNTP Mix(南京诺维赞生物科技有限公司),DNA 提取试剂盒(Biomiga 倍沃医学科技有限公司),RNA提取试剂盒(美国Promega 公司),无水乙醇、无水甲醇、异丙醇、冰乙酸(天津康科德生物化工公司),4%多聚甲醛、1 mol/L Tris-HCl(pH7.2)、牛血清白蛋白(BSA)、6×DNA loading buffer(北京索莱宝生物技术公司),国产甲酰胺、秋水仙素(上海生工生物技术股份有限公司),进口甲酰胺、TritonX-100、TWEEN-20、Gelatin from cold water fish(美国Sigma 公司),Blocking Reagent、DIG Easy Hyb Granules、CD-Star Ready-to-use solution、Anti-DIG-AP 抗体(瑞士Roche公司),TelC-FITC PNA 探针488/CY3(韩国Panagene公司),DAPI、Anti-γH2AX 抗体(德国Millipore 公司),Anti-PML 抗体(C-5)(Santa Cruz),Alexa 555 goat anti-Mouse 抗体、Lipofectamine RNAi-Max(美国Thermo 公司),siRNA(苏州吉玛基因有限公司),Phi 29 DNAPolymerase(美国NEB 公司),DNase/RNase free water(天根生化科技有限公司),细胞增殖-毒性检测试剂盒CCK-8(兰杰柯科技有限公司)。
1.2 实验方法
1.2.1 细胞培养 将U2OS 细胞接种于10 cm 培养皿中,以DMEM 培养基(含10%胎牛血清)培养于37℃,5%CO2的培养箱中,待细胞密度达70%~80%时进行传代。
1.2.2 siRNA 转染 将U2OS 细胞接种于6 孔板中,待细胞生长至密度为40%时进行转染。取两支离心管加入Opti-MEM 后分别加入siRNA 和Lipofectamine RNAi-Max,震荡混匀后将两管混合,室温静置5 min 后逐滴加入对应细胞中,反应24 h 后弃去转染液每孔加入2 mL 培养基,48 h 后收取细胞用于后续实验。对应siRNA 序列见表1。

表1 目的基因siRNA 序列Tab 1 siRNA sequences of the target gene
1.2.3 稳定敲低细胞系构建 使用pLKO.1 质粒构建shGADD45A 敲低细胞系。shRNA 序列见表2。用293T 细胞对质粒进行包被,吸取过滤病毒上清感染U2OS 细胞构建稳定敲低细胞系。
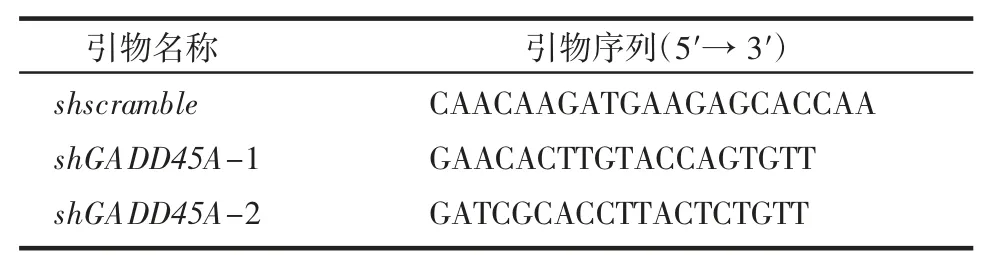
表2 shRNA 序列Tab 2 Sequence of shRNA
1.2.4 实时荧光定量PCR 收取细胞,试剂盒提取RNA。测量RNA 浓度后根据逆转录试剂盒将1 μg RNA 逆转合成cDNA,稀释5 倍后用于后续实时荧光定量PCR。按照primer F 0.4 μL、primer R 0.4 μL、ChamQ Mix 10 μL、无核酸酶水7.2 μL 的体系按照程序进行扩增(表3)。根据荧光曲线的ct 值用2-ΔΔCt计算siRNA 敲低效率。
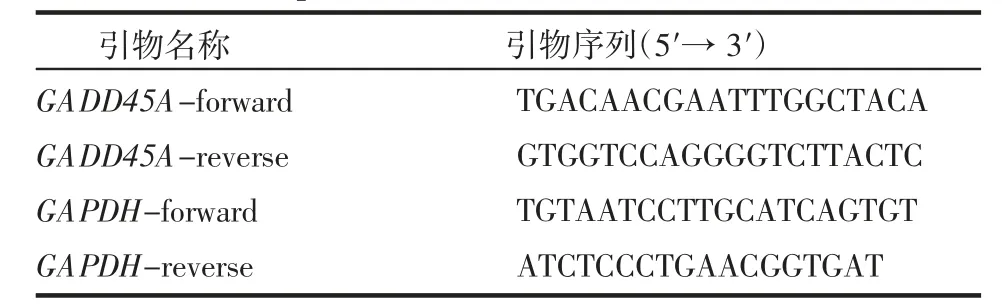
表3 PCR 引物序列Tab 3 Primer sequence for PCR
1.2.5 CCK-8 增殖实验 牛鲍汁计数板计数U2OS细胞,96 孔板每孔接种1 000 个细胞,每个处理组设置6 组重复。分别测量转染后第1、3、5、7 天的450 nm 处吸光度值。
1.2.6 克隆形成实验 牛鲍汁计数板计数U2OS 细胞,6 cm 皿接种5 000 个细胞,每3 天换1 次液,第7 天收取培养皿。吸弃培养基并用超纯水润洗,然后加4%组织固定液固定20 min。洗净固定液后加入0.5%结晶紫染液,染色20 min。洗净多余染液,在吸水纸上倒扣沥干水分,拍照保存用于后续分析。
1.2.7 细胞中期分裂相-荧光原位杂交(Metaphase-FISH) 直接接种稳定敲低细胞或将U2OS 接种于6 cm 培养皿,进行siRNA 转染,收取细胞前10 h更换含秋水仙素的DMEM 培养基(秋水仙素∶培养基=1∶100)。细胞沉淀加入PBS 重悬,边震荡边加入10 mL 37℃预热的0.075 mol/L Kcl,37℃水浴孵育30 min,然后加入5 滴预冷固定液(甲醇∶冰乙酸=3∶1),室温静置5 min,900 r/min 离心8 min。吸弃上清液,边震荡边加入10 mL 预冷固定液,室温静置30 min,900 r/min 离心8 min。吸弃上清液,加1 mL 固定液重悬并取50 μL 滴片,静置1 晚。第2 天用4%多聚甲醛固定细胞,脱水后用TelC-FITC PNA 探针CY3 杂交端粒3 h,洗涤封片,-20℃保存用于后续拍摄统计。
1.2.8 免疫荧光-荧光原位杂交(IF-FISH) 将无菌盖玻片放入六孔板中,直接接种稳定敲低细胞或接种U2OS 细胞并进行siRNA 转染。收取盖玻片洗涤固定,脱水后用TelC-FITC PNA 探针488 杂交端粒3 h,PBG 封闭1 h(PBS∶BSA∶Gelatin=1∶1∶100),加入一抗室温孵育1 h(PML∶PBG=1∶1 000,γH2AX∶PBG=1∶1 000),洗涤后二抗室温孵育30 min(Alexa 555 goat anti-Mouse∶PBG=1∶1 000),DAPI 封片,荧光显微镜拍摄并进行统计。
1.2.9 C-circle 实验 收取细胞提取DNA,测浓度后稀释至30 ng/μL 并按DNA template 1 μL、BSA 0.4 μL、dNTP Mix 2 μL、Phi 29 DNA Polymerase 0.5 μL、Phi 29 buffer 0.4 μL、无核酸酶水14.1 μL的体系进行PCR 反应扩增,反应程序为30℃,8 h;65℃,20 min。将扩增产物进行斑点杂交,紫外交联固定后杂交过夜。第2 天回收杂交液并洗膜、封闭,孵育DIG 抗体8~10 h。孵育结束后洗膜最后用CDStar 显色液曝光。
1.3 统计学处理 采用GraphPad Prism6 和Image J 软件进行统计学分析和作图,所有实验数据为重复3 次实验结果。统计结果采用t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 GADD45A 对骨肉瘤细胞生长增殖的影响 实时荧光定量PCR 检测siRNA 和shRNA 对GADD45A的敲低效率。与对照组相比,siRNA 敲低GADD45A后mRNA 水平显著降低(t=25.96,P<0.000 1);与shscramble 组相比,shGADD45A-1 和shGADD45A-2两细胞系GADD45A 的mRNA 水平下降(t=21.12、18.37,均P<0.000 1)(图1)。CCK-8 增殖实验结果表明,在siRNA 敲低GADD45A 后或稳定敲低细胞系shGADD45A-1 和shGADD45A-2 中,与对照组相比,骨肉瘤细胞存活率明显下降(t=5.051、6.192、3.775、14.86、22.93、3.013、14.61、20.93,均P<0.05)(图2A、2B)。克隆形成实验结果表明,在siRNA 敲低GADD45A 后以及shGADD45A-1 和shGADD45A-2两组稳定敲低细胞系中,骨肉瘤细胞增殖能力受到明显抑制,克隆形成减少(t=46.68、23.73、24.98,均P<0.000 1),见图2C~2D。
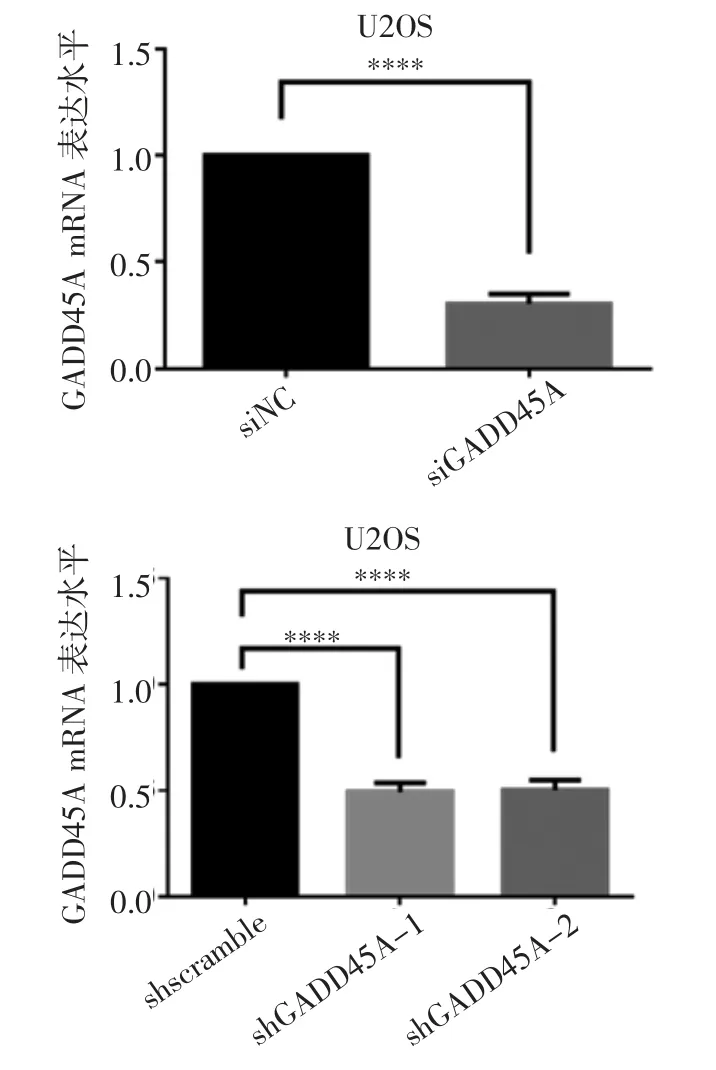
图1 实时荧光定量PCR 检测GADD45A mRNA 水平Fig 1 Expression of GADD45A mRNA detected by real-time fluorescence quantitative PCR
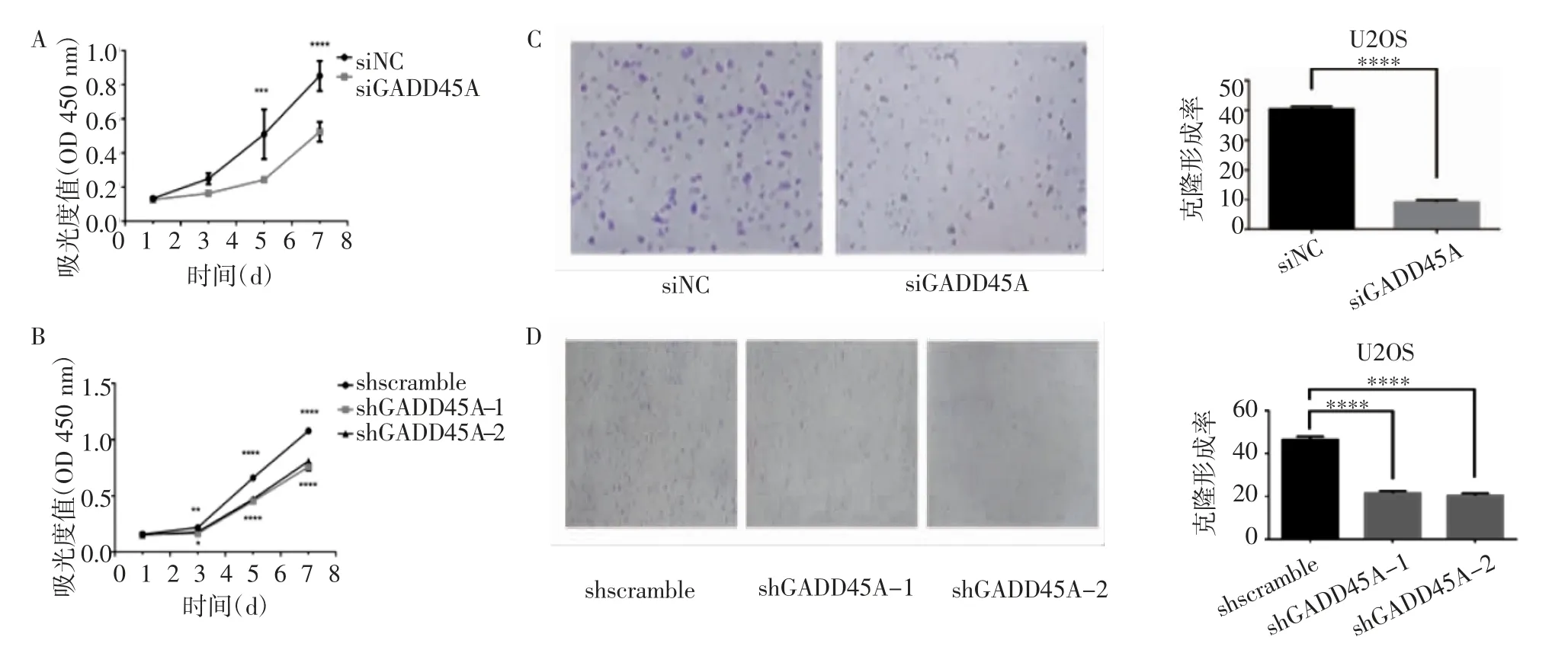
图2 GADD45A 对骨肉瘤细胞增殖的影响Fig 2 The effect of GAD45A on the proliferation of osteosarcoma cells
2.2 GADD45A 对骨肉瘤端粒功能的影响 细胞中期分裂相-荧光原位杂交实验显示,siRNA 敲低GADD45A 与shGADD45A-1 和shGADD45A-2 稳定敲低处理后结果相同,染色体末端多端粒信号(Multiple Telomere Signals,MTSs)比例明显升高(t=24.04、7.243、27.93,均P<0.01),端粒信号丢失(Telomere Signal Free Ends,SFEs)频率也相应增加(t=8.222、16.61、6.781,均P<0.01)(图3)。
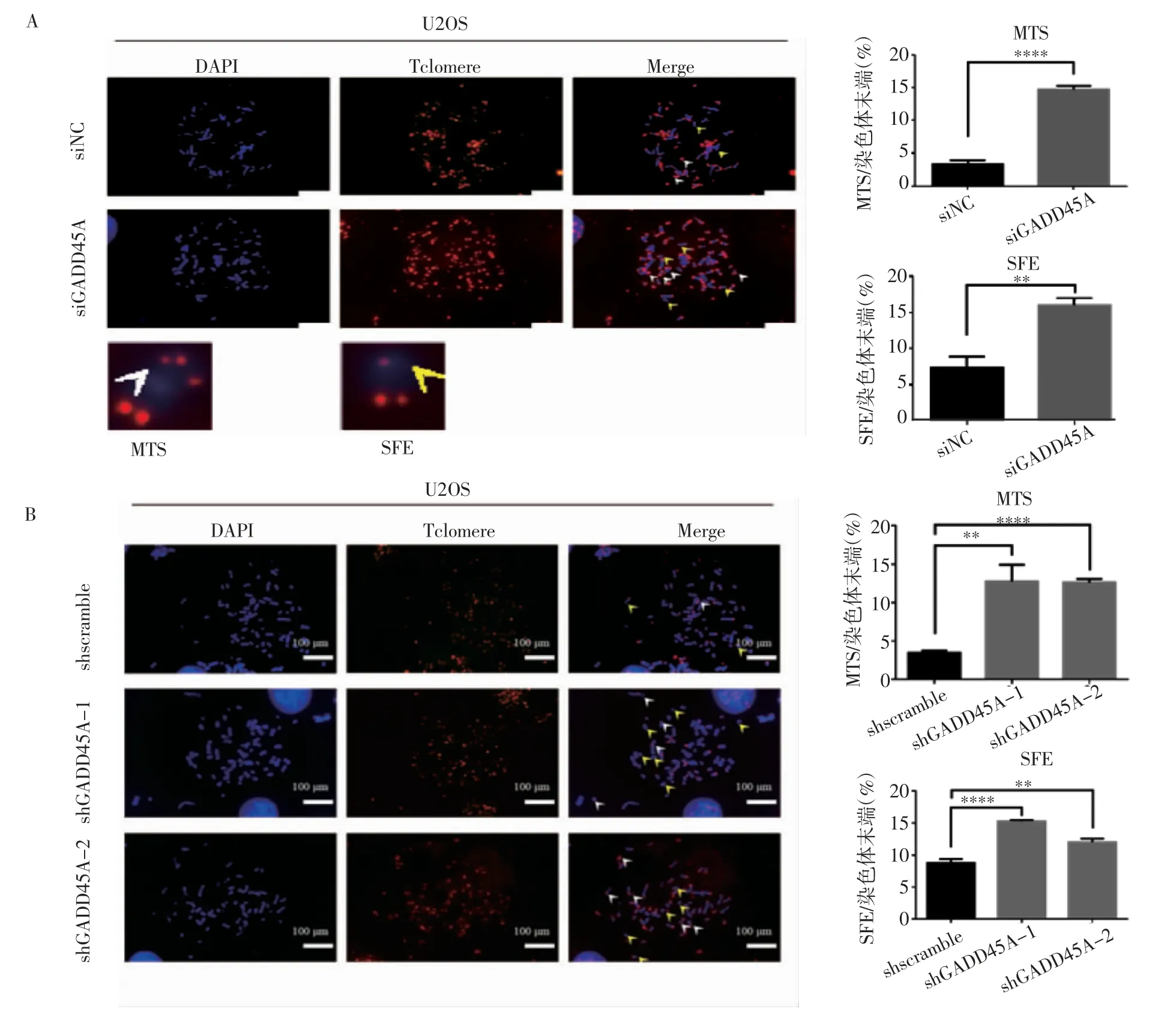
图3 GADD45A 对骨肉瘤细胞端粒功能的影响Fig 3 The effect of GADD45A on the telomere function of osteosarcoma cells
2.3 GADD45A 对骨肉瘤端粒损伤造成的影响 免疫荧光-荧光原位杂交实验结果显示,在使用siRNA敲低GADD45A 和shGADD45A-1、shGADD45A-2 两细胞系中,DNA 损伤指标γ-H2AX 与端粒共定位均上调(t=19.16、14.71、24.03,均P<0.000 1)(图4)。
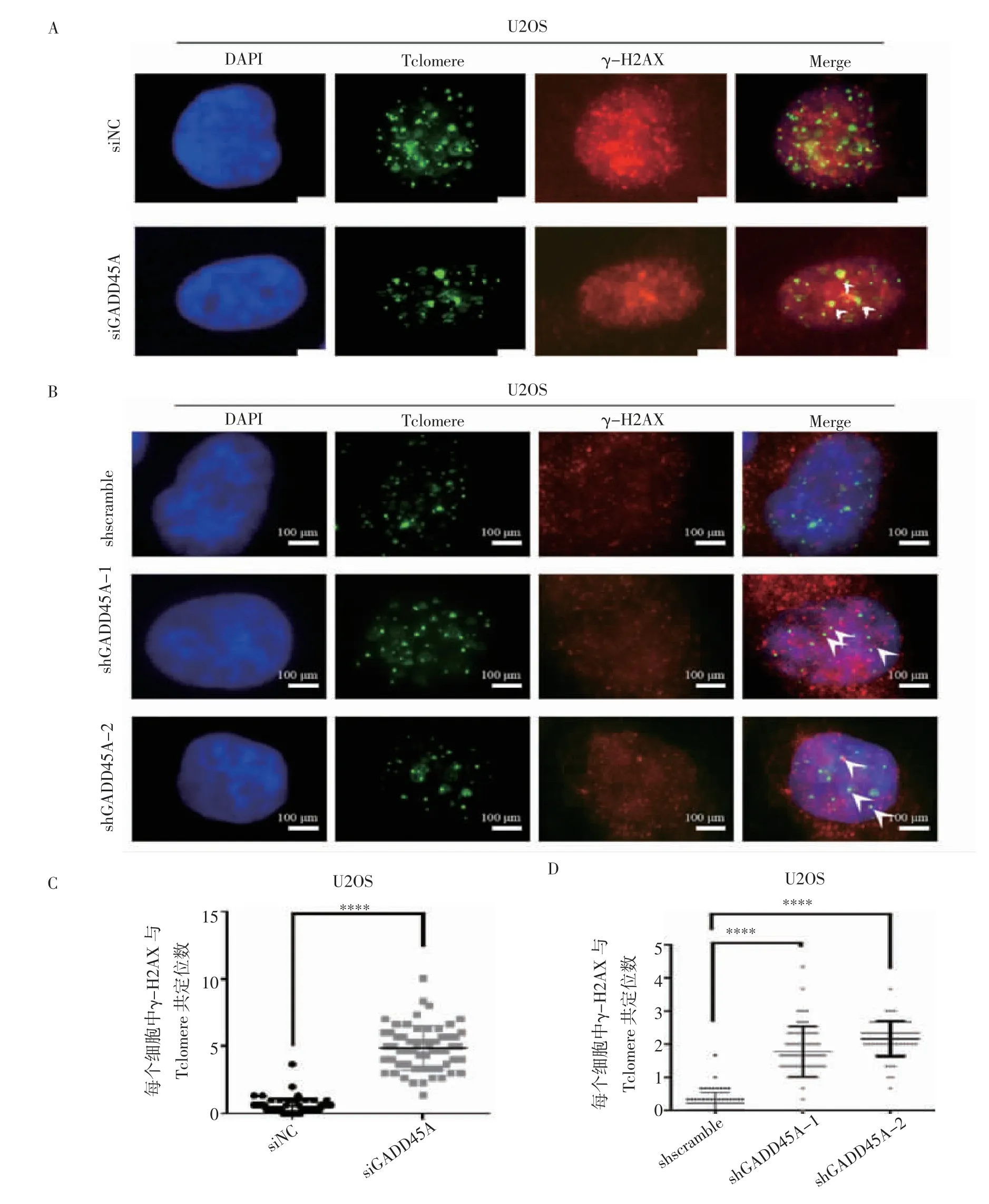
图4 GADD45A 对骨肉瘤端粒损伤造成的影响Fig 4 The effect of GADD45A on the telomere damage of osteosarcoma cells
2.4 GADD45A 对骨肉瘤细胞ALT 活性的影响 C-circle 实验结果表明,使用siRNA 敲低GADD45A 时,骨肉瘤细胞中C-circle 水平明显上升(t=41.27,P<0.000 1)(图5A)。采用shGADD45A-1 和shGADD45A-2 两细胞系也显示C-circle 水平升高(t=14.06、4.539,均P<0.05)(图5B)。另一方面,通过免疫荧光-荧光原位杂交实验,siRNA 和shRNA 的处理均导致PML 与端粒共定位显著增多(t=10.65、16.69、18.10,均P<0.000 1),见图5C~5D。

图5 GADD45A 对骨肉瘤细胞ALT 活性的影响Fig 5 The effect of GADD45A on the ALT activity of osteosarcoma cells
3 讨论
本研究发现敲低GADD45A 后抑制了骨肉瘤细胞的增殖,导致骨肉瘤细胞存活率下降。而端粒延长是肿瘤细胞维持增殖所必需的关键特征[9]。与端粒酶阳性肿瘤不同,ALT 阳性肿瘤端粒存在频繁的DNA损伤。并且已有文献报道GADD45A 参与了造血干细胞的DNA 损伤反应[10]。因此,本文通过H2AX 组蛋白变体(γ-H2AX)与端粒的定位来表征端粒损伤信号,首次发现敲低GADD45A 会引起骨肉瘤端粒损伤加剧。另一方面,本研究首次发现敲低GADD45A 会引起骨肉瘤细胞MTS 和SFE 显著升高,表明GADD45A缺失会导致骨肉瘤端粒功能紊乱和复制性衰老并且引起端粒不稳定,加重脆性端粒的产生。
目前已有的研究表明,在间充质来源的肿瘤中,如中枢神经系统肿瘤和多种亚型的肉瘤,往往存在更高比例、更高水平的ALT 表型,这之中又以骨肉瘤最为突出[11]。APBs 是由早幼粒细胞白血病体(PML)、成簇聚集的端粒和一系列与DNA 复制、重组等功能相关的蛋白形成的复合体,是ALT 途径延长端粒的场所。PML 是ALT 细胞形成APBs 并进一步维持端粒长度,造成端粒长度异质性的必要组分[12]。为了探究GADD45A 对ALT 的影响,笔者通过免疫荧光观察PML 与端粒的共定位,发现在敲低GADD45A后,PML 与端粒的共定位明显增多,说明GADD45A抑制了端粒到PML 的聚集,在ALT 途径中发挥了负向调控作用。除此之外,C-circle 作为ALT 阳性肿瘤中的一种特异性且可定量的指标,可以更清晰地反映ALT 活性的变化。C-circle 是染色体外的CCCTAA 重复序列,来自于端粒的后随链,与端粒TTAGGG 重复序列相对应[4]。本研究首次发现在敲低GADD45A 后,C-circle 水平显著升高,与前面结果一致,说明GADD45A 抑制骨肉瘤细胞C-circle形成,限制了ALT 途径发生。有文献报道,ALT 途径的过度激活会抑制ALT 细胞的生长[13-14]。本研究结果发现,敲低GADD45A 后,ALT 表型明显增加,ALT 活性增加,细胞增殖受到抑制,有可能是因为GADD45A 的缺失导致ALT 被过度激活,这也会导致ALT 细胞的死亡。
目前研究认为,ALT 是一种以类似于同源重组的断裂诱导复制(BIR)的方式进行端粒延长的途径[15]。在端粒DNA 损伤断裂后会激活RFC-PCNAPol δ 轴来促进APB 的组装,开始后续RAD52 依赖和不依赖的两种BIR 通路,整个过程还涉及BRCA1、RAD51 等多个同源重组相关蛋白[16-18]。本文已经证实GADD45A 确实参与了骨肉瘤的ALT 进程,结合以往文献报道GADD45A 与PCNA 存在相互作用,提示其可能影响了DNA 损伤反应进而抑制骨肉瘤ALT 活性[19]。此外,已有研究表明GADD45A 可以与R-loop 结合介导CpG 岛的局部去甲基化[20]。亚端粒区丰富的CG 含量提示这一过程在亚端粒位置同样有可能实现[21]。GADD45A 介导的去甲基化过程可能抑制端粒区的异染色质化,使染色质收缩,从而阻碍ALT 相关蛋白与端粒的结合。这与过往研究中提到的ALT 端粒处松弛的染色质结构这一特点有所呼应[22]。另一方面,笔者推测GADD45A 与BRCA1的相互作用也有助于GADD45A 与R-loop 的结合,R-loop 进一步刺激同源重组过程也是引起ALT 相关表型变化的原因[19,23],后续笔者会对GADD45A 如何调控ALT 进行深入的探究。
综上所述,GADD45A 缺失能够抑制骨肉瘤增殖,并通过参与骨肉瘤ALT 径影响端粒功能,造成端粒功能紊乱,加剧端粒DNA 损伤。

