帕金森病伴发抑郁患者自发脑电信号α 节律不对称性研究
刘玲凤,张贝贝,王曙光,杨倩,张莹,姜楠,张美云
(1.天津医科大学人民医院临床学院,天津 300070;2.天津市人民医院神经内科,天津 300121;3.天津大学机械工程学院,天津 300354)
帕金森病(Parkinson′s disease,PD)是一种常见的神经系统退行性疾病。近年来PD 的非运动症状引发广泛关注[1]。抑郁是帕金森病常见的非运动症状,帕金森伴抑郁(depressive disturbances in Parkinson′s disease,dPD)的患者通常表现出更差的预后,严重影响患者的生活质量,PD 伴发抑郁的风险是正常人的2 倍,大约35%有明显的临床抑郁症状[2]。dPD的早期识别至关重要。目前抑郁的诊断多依赖于临床量表检测及精神心理科医生的临床访谈,缺乏客观评价指标。因此,寻找客观的生物学标志物辅助dPD 的识别尤为重要。
大脑半球定量脑电偏侧化理论,为抑郁症的研究提供了有力的依据[8]。关于PD 伴发抑郁患者的研究大多集中在神经影像学上,定量脑电特征尚不清楚,本研究拟采用连续子波变换的方法对PD 患者静息态脑电信号进行定量分析,提取α 频带相对功率,观察伴或不伴抑郁的PD 患者α 频带功率的空间分布模式,比较α 功率分布的不对称性,探索有助于dPD 评估和识别的脑电特征。
1 对象与方法
1.1 研究对象 本研究共纳入PD 患者68 例,来源于天津市人民医院门诊及住院部,其中男性36例,女性32 例,平均年龄(67.93±8.15)岁。PD 纳入标准:(1)所有患者均符合英国帕金森病协会脑库临床诊断标准的PD 相关标准[9]。(2)均能配合完成神经心理评估。其中23 例符合美国《精神障碍疾病诊断与统计手册第4 版》[10]抑郁诊断标准,为dPD组,45 例为帕金森病不伴抑郁(non-depressive disturbances in Parkinson′s disease,ndPD)组。排除标准:(1)继发性PD 及帕金森叠加综合征。(2)严重认知功能障碍、痴呆,精神异常不能配合完成量表及脑电信号采集。(3)严重心、脑、肺、肝、肾器质性慢性疾病等病史。
采集患者的病史:主要症状,病程年限、用药情况、受教育程度等情况,根据Hoehn 和Yahr(HY)量表进行PD 的严重程度分级。采用汉密尔顿抑郁量表(Hamilton depression scale-17item,HAMD-17)评分评估抑郁症状,得分越高表示抑郁越严重。采用PD评分量表(unified Parkinson disease rating scale,UPDRS)进行运动功能评分,分值越高,症状越严重。
本研究获天津市人民医院伦理委员会审批通过(伦理批准号:2021-B24)。均签署知情同意书。
1.2 方法
1.2.1 脑电信号采集 采用意大利EBNeuro Light36 EEG 记录仪,电极安放按照国际标准导联10/20 系统,以双耳为参考电极,采集16 导联脑电信号,导联设置如下:FP1-A1、FP2-A2;F3-A1、F4-A2;C3-A1、C4-A2;P3-A1、P4-A2;O1-A1、O2-A2;F7-A1、F8-A2;T3-A1、T4-A2;T5-A1、T6-A2,采样频率为512 Hz,电阻抗<5 KΩ。所有受试者均在干净整洁、安静、隔音效果好的脑电图室内完成脑电图数据采集,描记清醒、安静、闭目状态下的脑电信号至少20 min。检查前一天及当天禁用兴奋剂(如酒精、咖啡等)、药物(如睡眠、抗焦虑抑郁药物),检查前后常规应用帕金森药物。所有患者病情信息、脑电电极位置安放及脑电信号采集均由神经内科专科医师完成。
1.2.2 脑电信号提取 从采集的背景脑电中选取视觉脑电波形平稳、没有明显伪差的20 s 数据为一个数据模块,每个模块10 240 个数据,对16 导联数据进行定量分析。
1.2.3 子波分析 子波分析是一种通过特定频率分辨率和时间分辨率的数学方法将多尺度成分复杂信号进行子波解析,根据子波在频域和时域的能量分布,确定子波的最小和最大尺度,将各尺度与局部特定位置的时间、空间信号相对应,是一种将一维信号在频域变换为二维矩阵的常用数字分析方法之一,它适合于复杂的非线性脑电信号的分析。
Ⅰ类海风锋7个典型个例的500 hPa层上海岸地区为副热带高压(588 dagpm线)的控制范围内。天气形势较为稳定,低层环境风场较弱,故地面海风锋系统清晰。
本研究采用Gauss 连续子波变换(continuous wavelet transform,CWT),公式:
子波母函数Ψ(t)经过平移参数y 个单位,伸缩参数x 个窗宽,得到子波函数族Ψxy(t):
通过Gauss 连续子波变换的方法对PD 受试者脑电信号进行定量分析,共30 个尺度,α 节律对应第9 尺度,频率中心为10.28 Hz。
1.2.4 分尺度相对功率 各尺度信号能量强弱,可以根据子波系数Ws(x,y),算出分尺度相对功率来表示脑电信号S(t)在各尺度的强弱:
本研究对dPD 组和ndPD 组患者的脑电信号行Gauss 连续子波变换,提取不同导联脑电信号α 频带对应第9 尺度的相对功率。比较Fp1-Fp2、F3-F4、C3-C4、P3-P4、O1-O2 导联之间α 相对功率之差,正值表示左侧α 相对功率>右侧,负值表示右侧α相对功率>左侧。
1.3 统计学处理 应用SPSS24.0 统计软件对两组PD 患者临床资料及脑电数据进行统计学分析。描述性统计分析以±s 或中位数(四分位间距)表示。采用Shapiro-Wilk′s检验方法检查数据分布的正态性假设,对于符合正态分布的数据采用独立样本t 进行组间比较,不符合正态分布的数据进行非参数Mann-Whitney 检验。采用Spearman 相关分析研究双侧α 相对功率之差与抑郁评分之间的相关性。P<0.05 表示差异有统计学意义。
2 结果
2.1 临床资料分析 dPD 组23 例,ndPD 组45 例,dPD 发生率为33.82%。两组患者在性别、年龄、受教育年限、病程及口服PD 药物种类、HY 分期、UPDRS-Ⅲ、MMSE 等方面差异均无统计学意义(均P>0.05)。两组HAMD-17、UPDRS-Ⅱ评分差异均有显著统计学意义(均P<0.01),并且dPD 组患者UPDRS-Ⅱ、HAMD-17 量表上的得分明显高于ndPD 组患者,见表1。
表1 dPD 组与ndPD 组人口统计学和临床资料[n(%),±s,M(P25,P7)5]Tab 1 Demographic and clinical data of dPD group and ndPD group[n(%),±s,M(P25,P7)5]
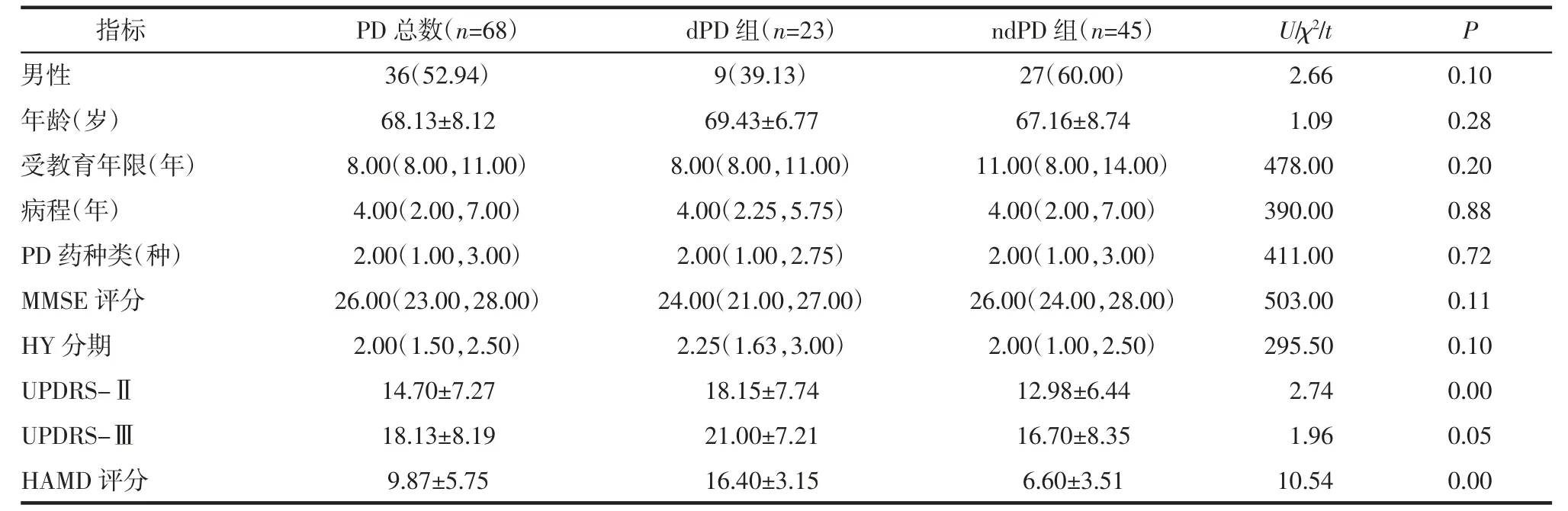
表1 dPD 组与ndPD 组人口统计学和临床资料[n(%),±s,M(P25,P7)5]Tab 1 Demographic and clinical data of dPD group and ndPD group[n(%),±s,M(P25,P7)5]
注:PD:帕金森病;dPD:帕金森病伴发抑郁症状;ndPD:帕金森病不伴抑郁;MMSE:简易智能状态检查表;HY 分期、UPDRS-Ⅱ、UPDRS-Ⅲ:帕金森运动功能评分量表;HAMD:汉密尔顿抑郁量表
指标PD 总数(n=68)dPD 组(n=23)ndPD 组(n=45)U/χ2/tP男性36(52.94)9(39.13)27(60.00)2.660.10年龄(岁)68.13±8.1269.43±6.7767.16±8.741.090.28受教育年限(年)8.00(8.00,11.00)8.00(8.00,11.00)11.00(8.00,14.00)478.000.20病程(年)4.00(2.00,7.00)4.00(2.25,5.75)4.00(2.00,7.00)390.000.88 PD 药种类(种)2.00(1.00,3.00)2.00(1.00,2.75)2.00(1.00,3.00)411.000.72 MMSE 评分26.00(23.00,28.00)24.00(21.00,27.00)26.00(24.00,28.00)503.000.11 HY 分期2.00(1.50,2.50)2.25(1.63,3.00)2.00(1.00,2.50)295.500.10 UPDRS-Ⅱ14.70±7.2718.15±7.7412.98±6.442.740.00 UPDRS-Ⅲ18.13±8.1921.00±7.2116.70±8.351.960.05 HAMD 评分9.87±5.7516.40±3.156.60±3.5110.540.00
2.2 原始脑电波形特征及功率 如图1 所示为性别相同、年龄相仿的ndPD 组和dPD 组两名典型受试者不同脑区α 活动波形,选择信号平稳的2 s 数据展示在图中。比较观察了左右额极(Fp1、Fp2)、额(F3、F4)、中央(C3、C4)、顶(P3、P4)、枕(O1、O2)的α 脑电波形特征,ndPD 组受试者左侧导联的子波系数低于右侧对应导联;而dPD 组受试者左侧导联的子波系数高于右侧对应导联。为进一步比较左右两侧对应导联之间α 活动的差异,本研究采用子波功率谱分析的方法对上述两组患者的脑电信号进行定量分析,观察各导联脑电活动在不同频率上的分布特征,图2 为上述典型ndPD 受试者和dPD 受试者左右额极(Fp1、Fp2)、额(F3、F4)、中央(C3、C4)、顶(P3、P4)、枕(O1、O2)的脑电功率谱分布对比图,从图中可以看出ndPD 组受试者左侧导联的α 相对功率均低于右侧;而dPD 组受试者左侧Fp1、F3 导联的α 相对功率低于对侧,C3、P3、O1 导联的α 相对功率明显高于对侧。

图1 ndPD 受试者和dPD 受试者α 振荡脑电波形特征Fig 1 Characteristics of α oscillatory EEG waveforms in ndPD subject and dPD subject
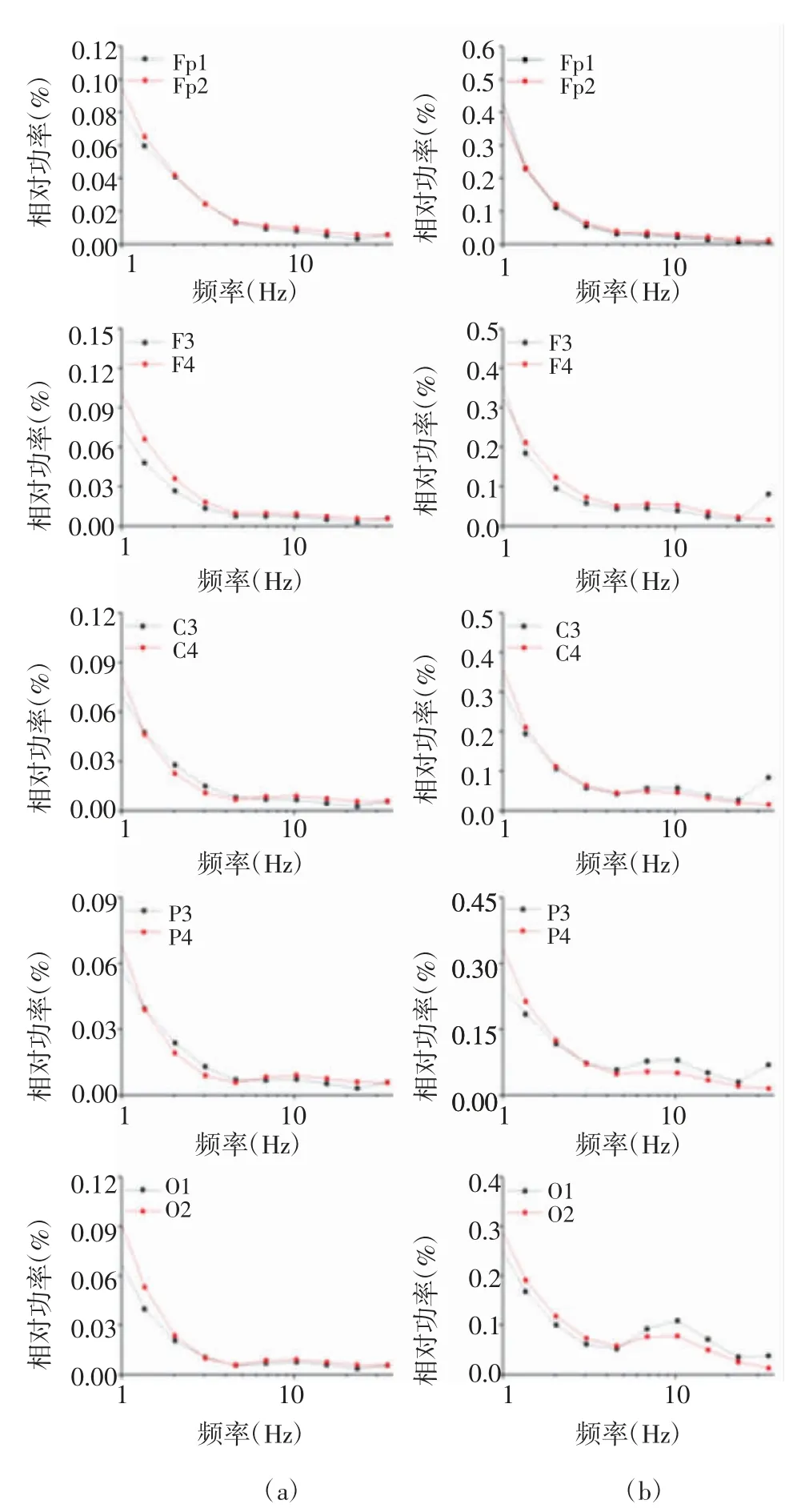
图2 ndPD 受试者和dPD 受试者不同脑区的功率谱分布图Fig 2 Power spectrum distribution of different brain regions in nd-PD subject and dPD subject
2.3 脑电α 相对功率空间分布 通过对所有受试者各脑区功率分布差异情况观察,绘制总体dPD 组和ndPD 组患者α 相对功率在不同脑区的空间分布特征图。结果如图3 所示,ndPD 组(3a)较高功率值主要位于中央、顶部,左右基本对称,右侧稍高于左侧。dPD 组(3b)在顶、枕区有较高的功率值,左侧高于右侧,其他脑区双侧基本对称。图4 为dPD 组和ndPD 组α 相对功率在不同导联左右大脑半球分布柱状图,dPD 组患者中较高α 功率值主要分布在O1;Fp1、Fp2,F3、F4 两组导联左右脑α 功率基本相当,双侧差异较小;C3、P3、O1 导联α 功率高于C4、P4、O2,且枕区差异最大。ndPD 组患者较高α 功率值主要分布在C4、P4 和O1;而Fp1、Fp2 导联左右脑α 功率也基本相当,差异不明显;F3、C3、P3 导联α 功率低于F4、C4、P4,且顶区差异最大;O1 导联α 功率高于O2。

图3 两组α 相对功率脑电地形图空间分布特征Fig 3 Spatial distribution characteristics of EEG topographic maps of alpha relative power in both groups

图4 ndPD 组和dPD 组不同导联α 相对功率Fig 4 Relative power of α in different leads in ndPD group and dPD group
2.4 双侧大脑半球α 相对功率不对称性分析 比较ndPD 组和dPD 组α 相对功率不对称性之间的差异,如图5 所示,发现额极(Fp1-Fp2)功率差值差异较小,未表现出明显的不对性;额区(F3-F4)两组均表现出右不对称性(左<右);中央(C3-C4)、顶区(P3-P4)表现出相反的不对称性,ndPD 组表现出右不对性(左<右),dPD 组左不对称性(左>右);枕区(O1-O2)两组均表现出左不对称性(左>右)。为比较描述dPD 与ndPD 两组静息态EEG 活动α 相对功率不对称的差异,对两组之间左右脑对应导联α功率之差行Mann-Whitney 检验。统计学分析结果显示,额极(U=527.5,P=0.897),额区(U=479.5,P=0.622),中央(U=418.5,P=0.199),顶区(U=361.5,P<0.05),枕区(U=329.5,P<0.05)。

图5 额极、额、中央、顶、枕α 相对功率不对称性Fig 5 The α relative power asymmetry of frontal pole,frontal,central,parietal and occipital
2.5 脑电信号α 相对功率不对称性与抑郁的相关性 绘制PD 患者各脑区α 相对功率不对称性与HAMD-17 评分关系的散点图,由图6 所示,额极(Fp1-Fp2)和额区(F3-F4)α 相对功率不对称性与抑郁分数无明显相关性;中央(C3-C4)、顶区(P3-P4)、枕区(O1-O2)不对称性随着抑郁分数的增加呈现出从右不对称性向左不对称性转化的趋势,二者呈正相关;Spearman 相关性分析结果显示,中央区无统计学意义(P>0.05);顶区、枕区半球不对称性与抑郁评分均呈正相关(P<0.05)。
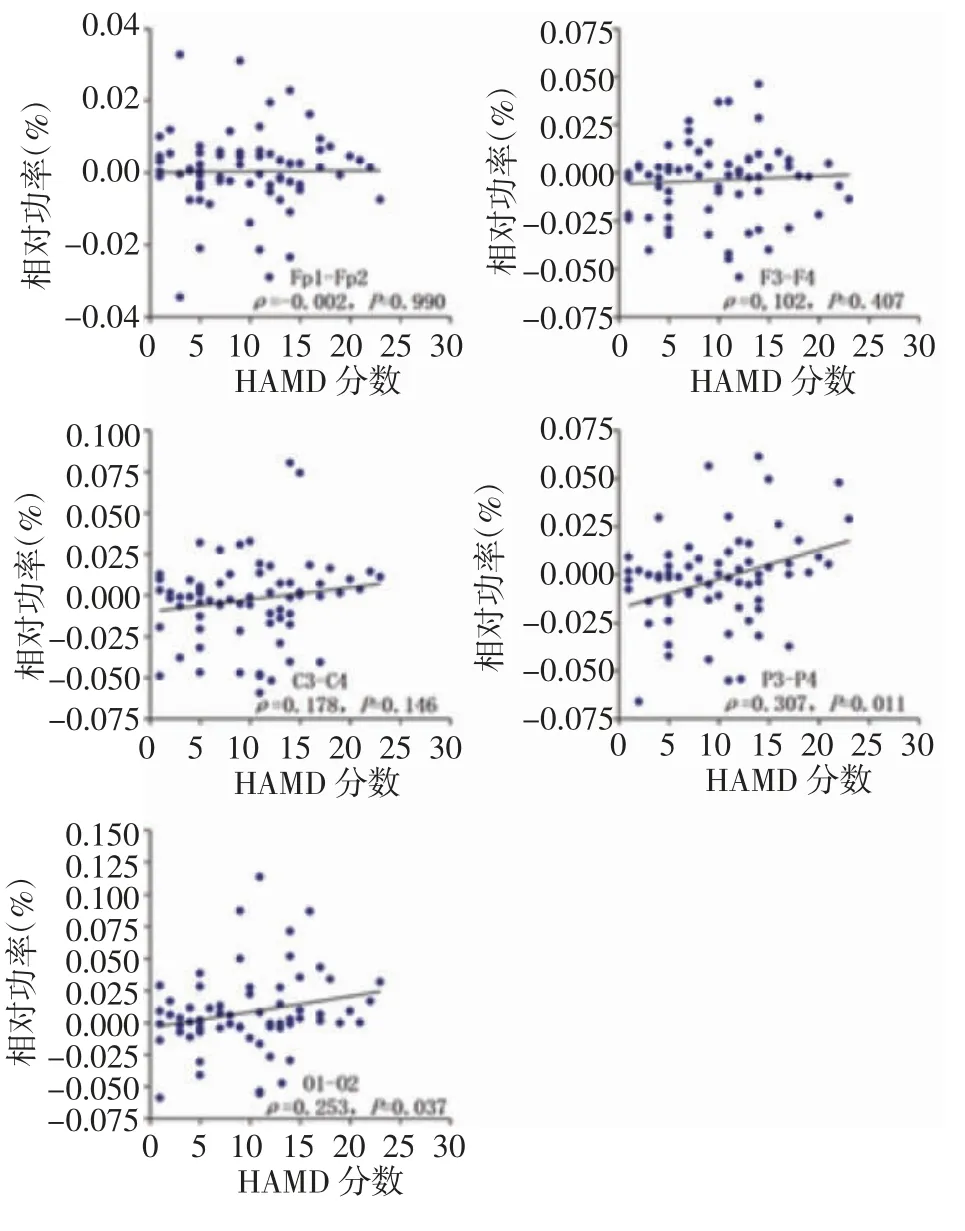
图6 PD 受试者左右脑额极、额、中央、顶、枕α 相对功率不对称性与HAMD-17 评分相关性Fig 6 Correlation between the asymmetry of α relative power in bilateral frontal pole,frontal,central,parietal and occipital and HAMD-17 score in PD subjects
3 讨论
本文采用CWT 分析方法将PD 患者脑电信号分解在不同尺度上,观察不同尺度波形特征的同时可以关注时频信息,具有强的自适应性和灵活的分辨率等优势。而传统的傅里叶变换不能同时精确估计时间分辨率和频率分辨率,只能精准估计其中一项,另一项则会被粗略估计。
通过比较临床资料发现,dPD 组UPDRS-Ⅱ(日常活动)得分明显高于ndPD 组,可能因为UPDRS-Ⅱ得分不是对运动症状严重程度的直接量化,而是来自于患者自身对其症状严重程度的主观的评价。UPDRS-Ⅱ得分可能是PD 患者出现抑郁症状的一个潜在危险因素[11]。
以往多数研究表明单纯抑郁症患者表现出左额α 节律不对称性,但抑郁情绪对脑电信号α 节律活动的影响机制尚不十分清楚。通常认为α 活动被认为是皮质失活的指标,其中较大的α 功率或振幅反映了皮质抑制状态。α 节律起源于丘脑,正常状态下,额叶皮层可以将这种源于丘脑的α 节律调节为θ、β 等节律,参与正常脑电活动的形成[12]。抑郁症患者兴奋性神经递质分泌减少和失调,导致与积极进取情绪相关的左额叶皮质活跃度减低和与消极退缩情绪相关的右额叶皮质活跃度增强有关[13]。脑电图则多表现为左额叶较右额叶有更高的α 功率,呈现脑电额叶α 节律不对称这一特征[6-7]。相对较大的左前额叶活跃度(即较小的α 功率)可能是一个情感的保护因素[4]。
本次研究结果未发现PD 抑郁患者存在与上述单纯抑郁相同的额叶α 节律不对称特性。结果可能与dPD 患者不仅存在兴奋性神经递质分泌异常,PD本身引起的多巴胺能神经元退行性变[14-15]和大脑结构功能改变都对dPD 患者α 节律产生影响相关[16]。PD 早期抑郁,中脑多巴胺能、5-羟色胺能、去甲肾上腺素能递质改变;PD 中期抑郁,边缘结构、海马和杏仁核等重要的情感结构受损;PD 后期抑郁,额叶皮质的灰质厚度逐渐下降及白质纤维束受损,额叶与边缘系统之间的功能连通性降低,皮质与皮质下通讯减少[16-18]。本研究纳入的PD 患者平均病程年限约为5 年,可能多数患者为PD 后期抑郁。后期抑郁额叶皮层和皮层下连通性的改变可能影响了额叶α 节律的表达,从而导致dPD 患者头皮脑电上记录到的额叶α 功率值本身太小,组间左右半球差值相比无显著差异。
与ndPD 组相比,dPD 组α 节律左不对称性的差异主要在顶、枕区。这种PD 抑郁与单纯抑郁前后头部的差异可能与不同情绪的PD 患者表现出不同的大脑灌注相关:dPD 患者存在左枕部高灌注和额颞叶、边缘系统低灌注[19],以至于楔前叶及其周围区域呈现葡萄糖代谢增加[20],这些区域的脑血流量和脑代谢不对称性增加加速了脑电波的活动,支持了dPD患者脑电节律变化在后头部而非前头部。
据报道在不伴抑郁情绪的正常受试者中左侧大脑半球额、顶、枕部的α 功率通常略低于右侧大脑半球,这与大脑半球之间存在“α 功率调制”有关,右侧半球的α 功率同时受到线索导向的左向和右向注意转移调节,而左侧半球只表现出空间注意右向转移调节[3]。本研究发现不伴抑郁的PD 患者表现出左侧α 功率略低于右侧,左右分布基本对称,结果与上述关于正常人α 活动表现一致。
通过相关性分析比较还发现PD 患者顶、枕区的α 不对称程度与HAMA 评分呈正相关关系。提示PD 患者随着抑郁程度加重,大脑半球活动会呈现出从左侧α 相对功率逐渐增高和右侧α 相对功率逐渐降低的不对称性趋势,因此似乎α 不对称性对于dPD 早期识别有重要意义。
定量脑电图α 节律不对称理论研究不仅用于抑郁的辅助诊断,还用于疾病预后的评估。Tsai 等[7]发现半球间不对称性正常化,与抗抑郁药疗效相关,抑郁症症状缓解患者治疗后脑电α 复杂性显著降低和双侧额复杂性偏侧化逆转,而无缓解患者治疗前后脑电复杂性无明显差异。这种α 不对称性在抑郁症治疗前后的变化情况,一方面可以帮助判断抑郁患者对药物的敏感性,从而确定个体化治疗方案,另一方面也反向验证了抑郁症半球不对称性理论。上述研究结果提示,未来对于dPD 患者脑电的研究,不单局限于探索对dPD 患者的诊断方面,还可以扩展到dPD 患者治疗前后脑电生物变化,从而指导判断预后,确定治疗方案。
本研究结果显示dPD 患者与单纯的抑郁患者脑电生物标志方面,有相似之处,也有差异。共同点是存在抑郁情绪的患者,阳性结果脑区多数表现为左侧脑电α 功率大于右侧,不伴抑郁情绪的PD 患者及正常受试者则表现为左侧脑电α 功率小于右侧或左右半球相当。不同点是PD 患者伴发抑郁脑电的α 功率不对称主要在顶、枕区,而单纯抑郁患者α 功率不对性主要部位在额区。二者之间差异的机制有待进一步研究。本研究存在样本量相对较小的缺点,未来的研究应进一步扩大样本量,将脑电多种定量特征与其他诊断方法结合,提高PD 患者伴发抑郁的识别率,为PD 伴发抑郁的诊断和评估提供客观有效的方法。
本研究采用子波变换方法对PD 患者的自发脑电信号进行定量分析,提取不同导联脑电信号α 频带相对功率。PD 伴抑郁患者顶、枕区导联α 功率不对称,左侧>右侧;顶、枕区α 功率不对称有可能成为识别PD 伴发抑郁的潜在生物标志物;α 功率不对称产生的机制有待于进一步研究。

