老年髋部骨折术后低磷血症的发生及对预后的影响
白颖 于淼淼 周宁

[摘要] 目的 观察重症医学科(ICU)内老年髋部骨折术后病人低磷血症的发生情况,探讨低磷血症对预后的预测价值。
方法 纳入2021年7月—2022年8月北京积水潭医院ICU收治的老年髋部骨折术后病人110例,将入ICU即刻血磷<0.8 mmol/L者归为低磷组,血磷≥0.8 mmol/L者归为正常组。比较两组术中情况(手术方式、术中失血量)、主要血化验检查(白细胞、血红蛋白、清蛋白、肌酐、脑利钠肽、心肌肌钙蛋白I、乳酸)、主要并发症(急性心功能不全、心房颤动、谵妄、术后呼吸衰竭、脑梗死)及临床预后指标(ICU住院时间、住院病死率、术后住院时间)。
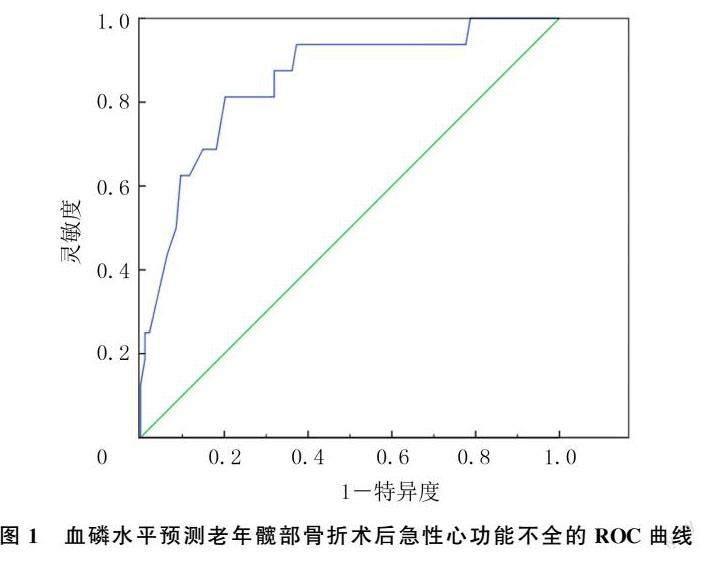
结果 在老年髋部骨折术后进入ICU病人中,低磷血症发生率为37.2%(41/110)。低磷组病人急性心功能不全的发生率显著高于正常组(χ2=4.875,P=0.025),两组其他指标差异均无统计学意义。血磷水平预测ICU内老年髋部骨折术后病人发生急性心功能不全的受试者工作特征曲线曲线下面积为0.851,95%置信区间为0.747~0.955;血磷最佳截断值为0.795 mmol/L,此时其诊断灵敏度为81.3%,特异度为70.2%。
结论 重症老年髋部骨折病人术后低磷血症发生率较高,且低磷血症与病人新发急性心功能不全有相关性。低磷血症可能对该病人群体术后急性心功能不全有一定预测作用。
[关键词] 低磷血症;髋骨折;老年人;重症监护病房;心力衰竭;预后
[中图分类号] R681.6;R589.5
[文献标志码] A
[文章编号] 2096-5532(2023)02-0278-04
doi:10.11712/jms.2096-5532.2023.59.057
[开放科学(资源服务)标识码(OSID)]
老年髋部骨折是骨质疏松性骨折的一种常见类型。预计至2050年,我国髋部骨折数量为107.9万/年。髋部骨折对老年人的危害要远高于其他部位骨折,由于老年髋部骨折病人的基础疾病复杂,围手术期并发症较多,术后常需要转入重症医学科(ICU)进行监护及治疗。ICU中的重症病人常出现低磷血症,其患病率高达30%~50%。术后转入ICU的老年髋部骨折病人具有众多可能导致低磷血症的危险因素,低磷血症常在脓毒症、重症慢性阻塞性肺疾病、重大创伤手术、酮症酸中毒、呼吸性及代谢性碱中毒等多种重症疾病中出现。但是,由于低磷血症无特异性的临床症状,常常不被临床医生所重视,不常规给予监测或治疗。有研究显示,重症病人低磷血症与机械通气时间延长、ICU治疗和住院时间延长、低血压、心律失常等不良预后相关。目前,转入ICU监护的老年髋部骨折病人术后低磷血症的发生率尚不清楚,低磷血症与该群体病人不良预后的相关性也不明确。本研究拟前瞻性观察ICU内老年髋部骨折病人低磷血症的发生情况,探讨低磷血症与预后之间的关系。现将结果报告如下。
1 资料与方法
1.1 研究对象
本研究为前瞻性队列研究,研究对象来源于2021年7月—2022年8月入住北京积水潭医院ICU的老年髋部骨折术后病人。纳入标准:年龄>65岁;经临床症状、体征和影像学检查诊断为单侧股骨颈骨折或股骨粗隆间(转子间)骨折并行手术治疗的病人;术后进入ICU监护治疗;创伤因素为轻度暴力(如摔倒、身体扭转、负重起身等),麻醉方式为腰麻联合局部神经阻滞。排除标准:合并多处骨折病人;病历资料缺失病人;急/慢性肾衰竭病人;行二次手术及髋关节翻修病人。本研究符合医学伦理学标准,经北京积水潭医院伦理委员会批准实施(伦理批件号202007-09),所有入选病人均签署了知情同意书。
1.2 分组方法
病人术前常规采血测量血磷,转入ICU后即刻及第2、3日清晨6:00分别采血测量1次血磷。参考既往文献,将入ICU即刻血磷<0.8 mmol/L者归为低磷组,血磷≥0.8 mmol/L者归为正常组。
1.3 观察指标
一般情况:年龄、性别、基础疾病、美国麻醉医师协会(ASA)评分以及急性生理与慢性健康评分表(APACHE Ⅱ)评分;术中情况:手术方式、术中失血量;血化验检查:白细胞、血红蛋白、清蛋白、肌酐、脑利钠肽、心肌肌钙蛋白Ⅰ以及乳酸;主要并发症:急性心功能不全(定义为NYHA Ⅱ~Ⅳ级)、心房颤动(房颤)、术后呼吸衰竭、脑梗死;临床结局指标:ICU住院时间、住院病死率、术后住院时间。
1.4 统计学分析
采用SPSS 18.0软件对数据进行统计分析。符合正态分布且方差齐的计量资料用±s描述,组间比较采用独立样本t检验;不符合正态分布的计量资料用中位数(M)和上下四分位数(Q1,Q3)描述,组间比较采用秩合检验;使用χ2检验对计数资料进行组间比较;建立血磷水平预测急性心功能不全的受试者工作特征(ROC)曲线,评价低磷血症对老年髋部骨折术后急性心功能不全的预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 低磷血症的发生率
本研究共评估了131例病人,最终110例病人被纳入本研究,排除病人包括急/慢性肾衰竭17例、多發骨折4例。纳入研究的110例病人,男21例,女89例;年龄68~96岁,平均(84.3±7.1)岁;手术方式包括全髋关节置换术15例,半髋关节置换术31例,髓内针内固定术64例。110例病人中,发生低磷血症者41例,低磷血症发生率为37.2%。
2.2 两组病人一般情况及术中情况比较
低磷组和正常组病人年龄、性别、ASA分级、APACHE Ⅱ评分、术中失血量、手术方式以及基础疾病比较差异均无统计学意义(P>0.05)。见表1。
2.3 两组病人血化验检查指标比较
低磷组与正常组白细胞、血红蛋白、清蛋白、肌酐、脑利钠肽、心肌肌钙蛋白I、乳酸等血化验检查指标比较差异均无统计学意义(P>0.05)。见表2。
2.4 两组病人预后指标的比较
低磷组病人急性心功能不全发生率为22.0%(9/41),正常组为7.2%(5/69),低磷组病人急性心功能不全发生率显著高于正常组(χ2=4.875,P=0.025)。两组房颤、术后呼吸衰竭、谵妄、脑梗死等并发症发生率以及ICU住院时间、术后住院时间、30 d病死率比较差异均无统计学意义(P>0.05)。见表3。
2.5 低磷血症对老年髋部骨折术后急性心功能不全的预测价值
血磷水平预测术后急性心功能不全的ROC曲线分析结果显示,曲线下面积为0.851,95%置信区间为0.747~0.955;血磷最佳截断值为0.795 mmol/L,此时其诊断急性心功能不全的灵敏度为81.3%,特异度为70.2%。见图1。
3 讨论
磷在机体中的主要作用是参与能量的产生,维持核酸功能及酶的活性。磷是细胞膜及骨骼的主要结构元素,体内的磷在骨骼和牙齿(85%)、软组织(14%)、细胞外液(1%)等部位以磷酸肌酸、单磷酸腺苷和三磷酸腺苷(ATP)的形式存在。成人正常的血清磷酸盐浓度为27~45 mg/L,儿童为40~70 mg/L,约85%的磷酸盐以磷酸二氢盐和磷酸一氢盐的形式存在。
人体内血磷的正常值为0.9~1.6 mmol/L。人体通过口服摄入、肠道吸收、肾脏排泄和细胞内转移来平衡和维持血磷水平。低磷血症可以见于多种疾病,且与临床不良预后相关。有临床研究显示,45%以上的低磷血症发生在ICU。术后转入ICU的老年髋部骨折病人出现低磷血症,存在多种可能机制:①摄入绝对及相对不足,老年髋部骨折病人常存在经口摄入不足及基础营养状态较差的情况;②在骨折及手术后机体合成代谢增加,对磷的需求增加;③重症病人持续血液净化治疗可以增加磷的丢失;④重症病人术后感染、应激导致机体炎性递质的释放,以及术后应用葡萄糖及胰岛素等多种因素,增加了血清中磷由细胞外向细胞内的转移。
低磷血症与重症病人心功能不全及心律失常有一定关系,如低磷血症被认为是导致可逆性心肌病的原因之一。此外,脓毒症病人早期低磷血症也与新发房颤等心律失常有着显著关系。在临床表现方面,低磷血症病人可以表现为无症状也可以表现为严重症状,甚至出现心脏停搏,这种差异可能与低磷血症程度有关。有研究者认为,当血清磷酸盐浓度下降至10 mg/L时,可能出现心肌无力及心律失常等严重临床症状。在急性心肌梗死时,低磷血症病人出现室性心律失常的比例明显增高;而纠正低磷血症可以显著逆转脓毒症早期低磷血症相关的心律失常。
本文研究结果显示,低磷组重症老年髋部骨折病人急性心功能不全的发生率较正常组明显增高,ROC曲线分析结果表明,以血磷水平0.795 mmol/L为最佳截断值,低磷血症对急性心功能不全有较好的预测价值(灵敏度为81.3%,特异度为70.2%)。
本文研究结果表明,低磷血症与病人急性心功能不全有着显著关系,低磷血症引起心功能异常有其可能的病理生理学机制。磷参与了糖酵解途径、ATP高能磷酸键的生成以及2,3-二磷酸甘油(2,3-DPG)的生成。心肌病与低磷血症具有相关性被认为和心肌细胞中ATP的消耗以及红细胞中2,3-DPG的减少有关。ATP是大多数细胞功能的能量来源。心脏对ATP有很高的需求,每个心室肌细胞有1/4~1/3被线粒体占据,其功能主要是以ATP的形式产生能量,以维持心脏的收缩力。因此,ATP的消耗理论上可导致心脏收缩功能障碍。由于ATP和2,3-DPG的产生减少,低磷血症也会导致向组织的氧输送受损。
本研究存在一定的局限性。首先,由于病例数量有限,现有低磷血症病人没有进一步按照严重程度分组,未来还需要进一步扩大样本量深入研究。其次,本研究只纳入了术后转入ICU的老年髋部骨折病人,未纳入转入普通病房的老年髋部骨折病人,可能使病人整体病情有更危重的倾向,后续研究应扩大此类病人的样本量以得到更加全面的结果。最后,本研究为观察性研究,未对病人进行干预,在今后的研究中需要进一步对病人行补磷治疗,并进行对照研究。
综上,ICU内老年髋部骨折术后病人低磷血症的发生率较高,且低磷血症与病人急性心功能不全有相关性。低磷血症可能对该病人群体术后急性心功能不全有一定预测作用,而老年髋部骨折病人低磷血症需要临床给予充分重视并积极给予纠正。
[参考文獻]
MCDONOUGH C M, HARRIS-HAYES M, KRISTENSEN M T, et al. Physical therapy management of older adults with hip fracture. The Journal of Orthopaedic and Sports Physical Therapy, 2021,51(2):CPG1-CPG81.
ZHANG J, YANG M, ZHANG X, et al. The effectiveness of a co-management care model on older hip fracture patients in China-A multicentre non-randomised controlled study. The Lancet Regional Health-Western Pacific, 2022,19:100348.
BERGER M M, APPELBERG O, REINTAM-BLASER A, et al. Prevalence of hypophosphatemia in the ICU-results of an international one-day point prevalence survey. Clinical Nutrition (Edinburgh, Scotland), 2021,40(5):3615-3621.
BEX S, MOLLARD F, STIRNEMANN J. Diagnosis and treatment of hypophosphatemia. Revue Medicale Suisse, 2019,15(667):1871-1875.
ESSA A, KOUSA O, AWAD D. The association of hypophosphatemia with resistant lactic acidosis in critical care illness. Journal of Investigative Medicine High Impact Case Reports, 2020,8:2324709620934963.
VETTERLI M, WAEBER G, FRASCAROLO S. Strategy diagnostic and therapeutic of an hypophosphatemia. Revue Medicale Suisse, 2021,17(760):2028-2032.
STATLENDER L, RAPHAELI O, BENDAVID I, et al. Correlations between first 72 h hypophosphatemia, energy deficit, length of ventilation, and mortality-a retrospective cohort study. Nutrients, 2022,14(7):1332.
BROMAN M, HANSSON F, KLARIN B. Analysis of hypo- and hyperphosphatemia in an intensive care unit cohort. Acta Anaesthesiologica Scandinavica, 2018,62(5):1897.
MORIMOTO Y, ISHIGURO T, UOZUMI R, et al. Significance of hypophosphatemia in patients with pneumonia. Internal Medicine (Tokyo, Japan), 2022,61(7):979-988.
REINTAM BLASER A, GUNST J, ICHAI C, et al. Hypophosphatemia in critically ill adults and children-A systema-tic review. Clinical Nutrition (Edinburgh, Scotland), 2021,40(4):1744-1754.
YOSHIDA T, TAKEMOTO M. Impaired cardiac and neurological function with mild hypophosphatemia during insulin therapy for diabetic ketoacidosis and marked improvement with phosphate supplementation: a case report. Journal of Diabetes Investigation, 2021,12(3):454-458.
CHRISTOPOULOU E C, FILIPPATOS T D, MEGAPA-NOU E, et al. Phosphate imbalance in patients with heart fai-lure. Heart Failure Reviews, 2017,22(3):349-356.
HU C Y, LEE B J, CHENG H F, et al. Acetazolamide-rela-ted life-threatening hypophosphatemia in a glaucoma patient. Journal of Glaucoma, 2015,24(4):e31-e33.
DAVIS S V, OLICHWIER K K, CHAKKO S C. Reversible depression of myocardial performance in hypophosphatemia. The American Journal of the Medical Sciences,1988,295(3):183-187.
SCHWARTZ A, BROTFAIN E, KOYFMAN L, et al. Association between hypophosphatemia and cardiac arrhythmias in the early stage of sepsis: could phosphorus replacement treatment reduce the incidence of arrhythmias Electrolyte & Blood Pressure: E & BP, 2014,12(1):19-25.
ARIYOSHI N, NOGI M, ANDO A, et al. Hypophosphatemia-induced cardiomyopathy. The American Journal of the Medical Sciences, 2016,352(3):317-323.
(本文編辑 马伟平)

