医院获得性铜绿假单胞菌肺炎病人CypA及其受体CD147表达与意义
李永伟 王嘉艺 刘冬梅 胡玥 刘玉春 刘心伟


[摘要] 目的 探讨亲环素A(CypA)及其受体CD147在医院获得性铜绿假单胞菌(PA)肺炎病人中的表达及意义。
方法 收集2021年1—12月在河南省中医院住院的罹患PA肺炎和肺炎克雷伯菌(KP)肺炎病人的临床资料。将病人分為PA组和KP组,对两组EDTA抗凝血进行血常规、降钙素原和C-反应蛋白分析,并测定两组血清和支气管肺泡灌洗液中CypA和CD147水平。
结果 PA组住院时长和抗菌药物使用时长显著高于KP组(t=7.332、9.919,P<0.05),而两组发病年龄和性别差异无显著性(P>0.05)。与KP组相比,PA组白细胞总数、中性粒细胞和C-反应蛋白水平显著降低(t=4.438、3.982,Z=4.010,P<0.05),而两组降钙素原水平差异无显著性(P>0.05)。与KP组相比,PA组支气管肺泡灌洗液中CypA水平显著降低(Z=2.818,P<0.05),而两组血清CypA和CD147及支气管肺泡灌洗液CD147水平差异无显著性(P>0.05)。
结论 PA肺炎病人支气管肺泡灌洗液中CypA相对低表达,与该菌感染慢性化存在关联,可能是其实现免疫逃逸的重要机制。
[关键词] 医疗相关肺炎;铜绿假单胞菌;亲环素A;basigin
[中图分类号] R563.19
[文献标志码] A
[文章编号] 2096-5532(2023)02-0250-04
doi:10.11712/jms.2096-5532.2023.59.060
[开放科学(资源服务)标识码(OSID)]
医院获得性肺炎是指病人入院时未发生、亦不处在潜伏感染期,在入院48 h后发生,无论是否存在机械通气或插管,由细菌、真菌、病毒或支原体等病原体引起的各种类型的肺实质炎症。在重症监护病房中,医院获得性肺炎是最为常见的院内感染类型,占比高达65%。而铜绿假单胞菌(PA)位列此类感染病原菌首位,具有耐药性强、发病率和死亡率高及预后差等特点。PA在新陈代谢方面的灵活性,为该菌造成慢性感染奠定了基础。本课题组前期研究发现,CD147可通过MAPK信号通路增强宿主对PA感染的抵抗力,而胞外亲环素A(CypA)是CD147最为重要的配体,在多种病原微生物感染和宿主免疫调节过程中扮演着重要的角色。近期有研究发现,胞外CypA是通气相关性肺炎发病过程中的重要炎症递质。本研究旨在通过比较PA和肺炎克雷伯菌(KP)导致的医院获得性肺炎病人体内胞外CypA和CD147及相关炎症指标的差异,初步探讨胞外CypA和CD147在PA感染过程中的作用和意义。
1 对象与方法
1.1 研究对象
2021年1—12月,选取河南省中医院收治的由PA或KP导致的医院获得性肺炎病人56例作为研究对象。科室分布:重症医学科16例,神经外科18例,脑病科10例,急诊科5例,肺病科4例,老年医学科3例。入院诊断分布:吸入性肺炎5例,重度颅脑损伤12例,高血压性脑出血8例,慢性阻塞性肺疾病发作期11例,支气管扩张3例,恶性肿瘤晚期9例,白血病粒细胞缺乏4例,呼吸心跳骤停4例。本文56例病人临床诊断均符合医院获得性肺炎诊断标准。根据支气管肺泡灌洗液细菌培养结果将56例病人分为2组,其中PA组26例,KP组30例。本研究经河南省中医院(河南中医药大学第二附属医院)医学伦理委员会批准。
1.2 观察指标及检测方法
利用医院信息管理系统收集血常规、C-反应蛋白(CRP)和降钙素原(PCT)检测结果,其中血常规测定使用日本Sysmex XN-3000细胞计数仪及其配套试剂,CRP测定使用上海基恩科技QuikRead go CRP及其配套试剂,PCT的测定使用法国梅里埃mini-VIDAS全自动免疫荧光分析仪及B.R.A.H.M.S PCT原装试剂。常规收集两组病人的血清和支气管肺泡灌洗液,-80 ℃冻存备用。使用酶联免疫吸附测定试剂盒对血清和支气管肺泡灌洗液的CypA、CD147和白细胞介素6(IL-6)水平进行检测,人胞外CypA试剂盒购自上海酶联生物科技有限公司,人EMMPRIN/CD147试剂盒购自深圳欣博盛生物科技有限公司,人IL-6试剂盒购自上海BBI生命科学有限公司。
1.3 统计学分析
应用SPSS 25.0统计学软件处理数据,使用GraphPad Prism 9.0软件输出统计图表。正态性检验采用独立样本Kolmogorov-Smironv检验。正态分布计量资料以±s表示,两组间比较采用独立样本t检验;非正态分布计量资料以P50(P25~P75)表示,两组间比较采用Wilcoxon秩和检验;计数资料组间比较采用χ2检验。P<0.05认为差异有统计学意义。
2 结果
2.1 两组病人基线资料比较
PA组住院时长和抗菌药物使用时长显著高于KP组(t=7.332、9.919,P<0.05),而两组性别和年龄差异无显著性(P>0.05)。见表1。
2.2 两组病人感染指标比较
与KP组相比,PA组白细胞总数、中性粒细胞和CRP水平显著降低(t=4.438、3.982,Z=4.010,P<0.05),而两组血清PCT水平差异无显著意义(Z=0.288,P>0.05)。见表2。
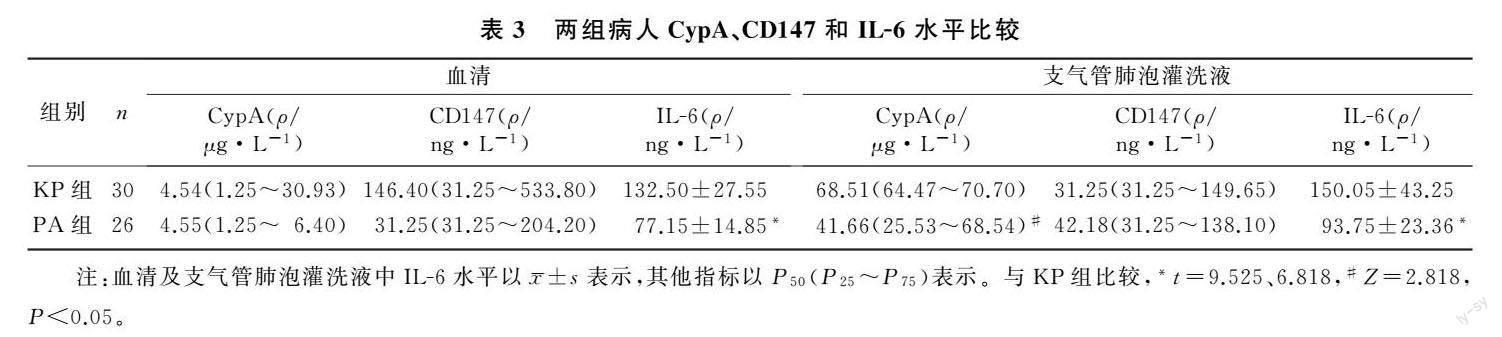
2.3 两组病人CypA、CD147和IL-6水平比较
与KP组相比较,PA组支气管肺泡灌洗液中CypA水平显著降低(Z=2.818,P<0.05),而两组血清CypA和CD147及支气管肺泡灌洗液CD147水平差异无显著性(Z=0.424~1.576,P>0.05)。PA组病人血清及支气管肺泡灌洗液中IL-6水平均显著低于KP组(t=9.525、6.818,P<0.05)。见表3。
3 讨论
PA作为医院获得性细菌性肺炎的重要病原菌,表现出对多种抗菌药物的耐药性,已经被WHO列为了亟待研发新型抗菌药物来治疗的ESKAPE(Enterococcus faecium,Staphylococcus aureus,Klebsiella pneumonia,Acinetobacter baumannii, Pseudomonas aeruginosa,Enterobacter species)菌群因而備受关注。医院获得性PA肺炎的最显著特征是肺部感染易慢性化、迁延不愈,导致病人抗感染治疗周期和住院时间延长,从而给病人造成沉重的生理负担和经济负担。PA的上述致病特征,一方面与该菌存在固有耐药性和易产生获得性耐药导致抗感染治疗失败有关,另一方面则与其损害宿主天然免疫功能、逃避宿主免疫反应密切相关。因此,深入探究PA逃避宿主免疫反应的分子机制,寻找新的治疗靶点,对于PA相关感染的临床治疗具有重要意义。
细菌性肺炎时,病人白细胞总数、中性粒细胞、CRP和PCT水平显著升高。本文研究结果显示,两组细菌性肺炎病人的上述指标均出现一定程度的升高,符合细菌性肺炎的感染指标特征,但两组肺炎病人感染指标的升高幅度并不相同。从白细胞总数、中性粒细胞和CRP来看,PA组显著低于KP组,感染程度相对较轻。然而两组病人抗感染治疗周期和住院时长差异均具有显著性,我们认为这可能与两种病原菌导致肺炎的致病特征差别有关,即PA为了维持自身在宿主中持续存在,会降低其毒力因子表达而弱化致病性,表现出相对较轻的感染症状,但会导致持续性、反复性感染。本文两组病人血清PCT水平差异无显著性,可能与肺炎得到及时有效干预,未进一步向脓毒症发展有关。
CypA是免疫亲环素家族的关键成员之一,是目前已知的18种人类亲环素中表达最为丰富的同工酶。在感染、氧化应激和低氧的情况下,CypA自发分泌到细胞外成为胞外CypA,并在一些生理或者病理过程中发挥重要的作用,例如炎症、病原体感染和复制、动脉粥样硬化、糖尿病、癌细胞增殖和转移等。我们的前期研究结果显示,在PA刺激下,作为胞外CypA重要受体的CD147表达显著上调,但对胞外CypA的表达情况未进行深入探究。本研究结果显示,两组病人血清和支气管肺泡灌洗液中CD147水平的升高差异无显著性,说明细菌性肺炎时,无论外周血还是局部组织中游离CD147水平均会出现无差别升高,不具有病原菌种属特异性。两组病人外周血中CypA水平差异也无显著性,这可能与感染局限在肺部尚未波及全身有关。大量研究证明,在感染性疾病过程中,胞外CypA会与跨膜受体CD147结合激活核因子κB,促进炎性细胞因子IL-6的表达。IL-6是最重要的炎症细胞因子,在宿主防御过程中发挥重要作用。IL-6可诱导CRP合成,促进中性粒细胞从骨髓释放,增强其杀伤病原体能力,加快病原菌的清除。本研究中两组病人胞外CypA和IL-6、CRP、中性粒细胞均出现同步升高,表明胞外CypA在宿主抗细菌感染中具有重要作用,与上述结论一致。
人体针对病原菌的炎症反应有利于病原菌的快速清除,保护机体正常生理功能。而PA为了维持其在宿主体内的持续生存,会形成生物被膜,降低其毒力因子的表达,逃避宿主免疫反应,诱发低水平炎症反应。本研究中,与KP组相比,PA组白细胞总数、中性粒细胞、CRP、胞外CypA和IL-6均出现同步的相对低水平表达,而住院时长和抗菌药物使用时长则呈现相反趋势。推测这可能与PA通过某种途径降低胞外CypA的表达,诱发低水平炎症反应,实现免疫逃逸有关,而确切机制有待于进一步深入研究。
综上所述,本研究初步揭示了胞外CypA及其受体CD147在宿主抗PA感染中的重要作用,胞外CypA在医院获得性PA肺炎病人支气管肺泡灌洗液中的相对低表达,可能与PA弱化其毒力从而逃避宿主免疫反应有关。但鉴于病原菌与宿主相互作用的复杂性,这一结论仍需要动物实验等相关研究进一步加以验证。
[参考文献]
MODI A R, KOVACS C S. Hospital-acquired and ventilator-associated pneumonia: diagnosis, management, and prevention. Cleveland Clinic Journal of Medicine, 2020,87(10):633-639.
ZARAGOZA R, VIDAL-CORTS P, AGUILAR G, et al. Update of the treatment of nosocomial pneumonia in the ICU. Critical Care (London, England), 2020,24(1):383.
RIBEIROC D S, CROZATTI M T L, SILVA A A D, et al. Pseudomonas aeruginosa in the ICU: prevalence, resistance profile, and antimicrobial consumption. Revista Da Sociedade Brasileira De Medicina Tropical, 2019,53:e20180498.
郑永珍,李慧伟. 35株下呼吸道感染患者中铜绿假单孢菌的分布及其对抗菌药物的耐药性分析. 抗感染药学, 2019,16(8):1328-1330.
REYNOLDS D, KOLLEF M. The epidemiology and pathogenesis and treatment of Pseudomonas aeruginosa infections: an update. Drugs, 2021,81(18):2117-2131.
JURADO-MARTN I, SAINZ-MEJAS M, MCCLEAN S. Pseudomonas aeruginosa: an audacious pathogen with an adaptable arsenal of virulence factors. International Journal of Molecular Sciences, 2021,22(6):3128.
LI Y W, CHEN L, WANG C X, et al. Extracellular matrix metalloproteinase inducer enhances host resistance against Pseudomonas aeruginosa infection through MAPK signaling pathway. American Journal of Translational Research, 2016,8(12):5619-5627.
季胜强,戚基萍. eCyPA与受体CD147信号通路在多系统疾病中的研究进展. 临床与病理杂志, 2020,40(10):2734-2740.
LIAO Y T, LUO D, PENG K L, et al. Cyclophilin A: a key player for etiological agent infection. Applied Microbiology and Biotechnology, 2021,105(4):1365-1377.
LI L L, LUO D, LIAO Y T, et al. Mycoplasma genitalium protein of adhesion induces inflammatory cytokines via cyclophilin A-CD147 activating the ERK-NF-κB pathway in human urothelial cells. Frontiers in Immunology, 2020,11:2052.
李玲玲. 生殖支原体MgPa经CypA-CD147-ERK诱导人尿道上皮细胞分泌促炎症因子. 衡阳:南华大学, 2019.
廖雅婷. 生殖支原体黏附蛋白MgPa通过CypA-CD147调控PI3K/Akt/NF-κB途径抑制尿道上皮细胞凋亡. 衡阳:南华大学, 2021.
KOH M W, BALDI R F, SONI S, et al. Secreted extracellular cyclophilin A is a novel mediator of ventilator-induced lung injury. American Journal of Respiratory and Critical Care Medicine, 2021,204(4):421-430.
KOULENTI D, ZHANG Y C, FRAGKOU P C. Nosocomial pneumonia diagnosis revisited. Current Opinion in Critical Care, 2020,26(5):442-449.
中華医学会呼吸病学分会感染学组. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版). 中华结核和呼吸杂志, 2018,41(4):255-280.
瞿介明,施毅. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)的更新与解读. 中华结核和呼吸杂志, 2018,41(4):244-246.
MUNTEAN M M, MUNTEAN A A, PREDA M, et al. Phenotypic and genotypic detection methods for antimicrobial resistance in ESKAPE pathogens (Review). Experimental and Therapeutic Medicine, 2022,24(2):508.
SHIMADA T, MATSUMURA I. Immune evasion of Pseudomonas aeruginosa. Nihon Rinsho Meneki Gakkai Kaishi, 2014,37(1):33-41.
王佳宁. CRP和WBC检测对细菌性肺炎与支原体肺炎的鉴别价值. 当代医学, 2021,27(4):119-120.
倪宏伟,吴莹,王振宇. WBC、CRP、PCT在重症肺炎中的检测意义分析. 中国实用医药, 2020,15(34):74-76.
ALAMU J, KAKITHAKARA VAJRAVELU L, VENKATESAN B, et al. Correlation of phenotypic and genotypic virulence markers, antimicrobial susceptibility pattern, and outcome of Pseudomonas aeruginosa sepsis infection. Microbial Pathogenesis, 2022,170:105716.
LIAO C B, HUANG X, WANG Q X, et al. Virulence factors of Pseudomonas aeruginosa and antivirulence strategies to combat its drug resistance. Frontiers in Cellular and Infection Microbiology, 2022,12:926758.
赵莉. 亲环素A在牙周炎进程中的表达及其作用机制研究. 济南:山东大学, 2018.
李文博,刘薇,陈璨,等. 胞外亲环素A对炎症发生的影响及其抗体在抑制炎症反应中的作用. 生物工程学报, 2018,34(1):90-101.
张利宏,应德美,宁琳洪,等. 亲环素A与细胞信号传导. 免疫学杂志, 2018,34(9):823-828.
LIU J Q, GUO M, LV Z M, et al. A cyclophilin A (CypA) from Apostichopus japonicus modulates NF-κB translocation as a cofactor. Fish & Shellfish Immunology, 2020,98:728-737.
SUN S, GUO M, ZHANG J B, et al. Cyclophilin A (CypA) interacts with NF-κB subunit, p65/RelA, and contributes to NF-κB activation signaling. PLoS One, 2014,9(8):e96211.
安娜,鲜于剑波,俸家富. 细胞因子风暴的研究进展. 中华预防医学杂志, 2020,54(11):1300-1304.
WANG K T, XU D, WANG Y L, et al. Current research trends in cytokine storm: a scientometric study. Current Drug Targets, 2022,23(12):1136-1154.
FAJGENBAUM D, JUNE C. Cytokine storm. The New England Journal of Medicine, 2020,383:2255-2273.
(本文编辑 马伟平)

