直肠癌患者血清TEM1、Sema3A水平与临床病理特征和预后的关系分析*
岳 峰,江旗琳,陈 淼,徐媛媛
邯郸市中心医院胃肠外科,河北邯郸 056001
直肠癌是胃肠道常见的恶性肿瘤,全球范围内每年新发病例达180万例,死亡病例达88万例[1]。根治性手术是直肠癌最为有效的治疗方式,但部分患者术后可发生肿瘤复发或转移。因此,寻找能够预测直肠癌患者术后预后的标志物具有重要意义。内皮唾液酸蛋白(TEM1)又称CD248,能够与细胞外基质蛋白结合,参与调节细胞迁移、淋巴结发育和内皮细胞凋亡等过程[2]。研究发现,TEM1在恶性肉瘤、脉管系统肿瘤等恶性肿瘤中水平较高,其能够通过结合C型凝集素,参与肿瘤血管生成,促进肿瘤恶性进展[2-3]。有研究发现,胃癌中TEM1水平升高,其通过促进肿瘤血管淋巴管侵袭,促进肿瘤转移,导致患者不良预后[4]。信号素3A(Sema3A)是信号素家族的成员,具有C2型免疫球蛋白样结构域,其作为一种分泌型蛋白,可以抑制树突的生长,参与促进神经元发育等生理过程[5-6]。研究表明,Sema3A在尿路上皮癌[5]、胃癌[6]等恶性肿瘤中水平上调或下调,其通过促进肿瘤细胞的增殖、迁移及耐药性的形成,导致患者不良预后。本研究通过检测直肠癌患者血清TEM1、Sema3A水平,分析二者与直肠癌临床病理特征的关系,探讨二者的临床预后价值,现报道如下。
1 资料与方法
1.1一般资料 选取2018年2月至2019年2月于本院行直肠癌根治术的104例直肠癌患者作为研究组。纳入标准:(1)患者年龄≥18岁;(2)术后经病理组织学检查明确诊断为直肠癌;(3)初次诊治;(4)临床病历资料完整,患者及家属对本研究知情同意并签署知情同意书。排除标准:(1)合并其他恶性肿瘤;(2)TNM分期为Ⅳ期;(3)伴有心、肝、肾等脏器功能严重障碍,不能耐受手术;(4)合并急性肺炎等感染性疾病;(5)术前发生淋巴结远处转移。研究组中男60例,女44例;年龄28~76岁,平均(57.69±6.17)岁;TNM分期:Ⅰ~Ⅱ期57例,Ⅲ期47例;肿瘤分化程度:低分化38例,中高分化66例;病理类型:管状腺癌68例,黏液腺癌36例;淋巴结转移46例;神经侵犯20例;癌胚抗原(CEA)>3.54 ng/mL者70例,≤3.54 ng/mL者34例。选取同期于本院体检的60例体检健康者为对照组,其中男34例,女26例;年龄26~78 岁,平均(56.76±4.57)岁。两组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本院医学伦理委员会已批准本研究。
1.2方法
1.2.1标本采集及检测 研究组入院后即刻、对照组体检时,均采集空腹静脉血5 mL,3 000 r/min离心10 min,留取上层血清进行检测。采用酶联免疫吸附试验检测患者血清TEM1、Sema3A水平。TEM1酶联免疫吸附试验试剂盒购自武汉菲恩生物科技公司(货号EH-12892),Sema3A酶联免疫吸附试验试剂盒购自广州奥瑞达生物公司(货号ARD200271),实验操作严格按照试剂盒说明书进行。根据血清TEM1、Sema3A水平中位数2.42 ng/mL、6.44 ng/mL,分为TEM1高表达组(n=51)和低表达组(n=53),Sema3A高表达组(n=50)和低表达组(n=54)。采用罗氏公司cobas8000生化免疫分析仪检测血清CEA水平,试剂盒购于罗氏公司,以所有研究对象的检测指标水平均值为临界值。
1.2.2随访与分组 出院后对所有直肠癌患者进行为期3年的随访,随访方式:电话或门诊方式,术后第1年每3个月随访一次,术后第2年、第3年每半年随访1次,记录患者肿瘤复发转移情况及生存情况,随访截止时间2022年3月1日,随访终点为患者死亡或随访时间结束。

2 结 果
2.1两组血清TEM1、Sema3A水平比较 研究组血清TEM1、Sema3A水平明显高于对照组,差异有统计学意义(P<0.05),见表1。
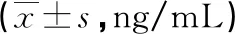
表1 两组血清TEM1、Sema3A水平比较
2.2血清TEM1、Sema3A水平与直肠癌患者临床病理特征的关系 直肠癌患者术前血清TEM1、Sema3A水平与肿瘤分化程度、TNM分期及淋巴结转移有关(P<0.05),与性别、年龄、肿瘤最大径、病理类型、神经侵犯及CEA水平无关(P>0.05),见表2。
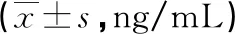
表2 血清TEM1、Sema3A水平与直肠癌患者临床病理特征的关系
2.3血清TEM1、Sema3A水平对直肠癌患者预后的影响 104例直肠癌患者随访4~36月,平均随访(25.7±6.2)个月,死亡48例。Kaplan-Meier生存曲线分析结果显示,TEM1高表达组患者的中位生存时间为26个月,低于TEM1低表达组患者的中位生存时间(35个月),差异有统计学意义(χ2=9.227,P<0.05);Sema3A高表达组患者的中位生存时间为27个月,低于Sema3A低表达组的中位生存时间(35个月),差异有统计学意义(χ2=4.427,P<0.05)。见图1。
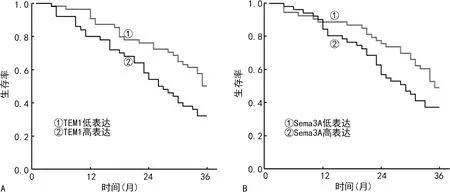
注:A为不同TEM1水平的直肠癌患者的生存曲线图;B为不同Sema3A水平的直肠癌患者的生存曲线图。
2.4单因素及多因素Cox回归分析直肠癌患者预后的影响因素 建立Cox比例风险回归模型,因变量为直肠癌患者预后。单因素分析的自变量为年龄、性别、肿瘤最大径、肿瘤分化程度、TNM分期、病理类型、CEA、神经侵犯、淋巴结转移、TEM1、Sema3A等。赋值情况见表3。
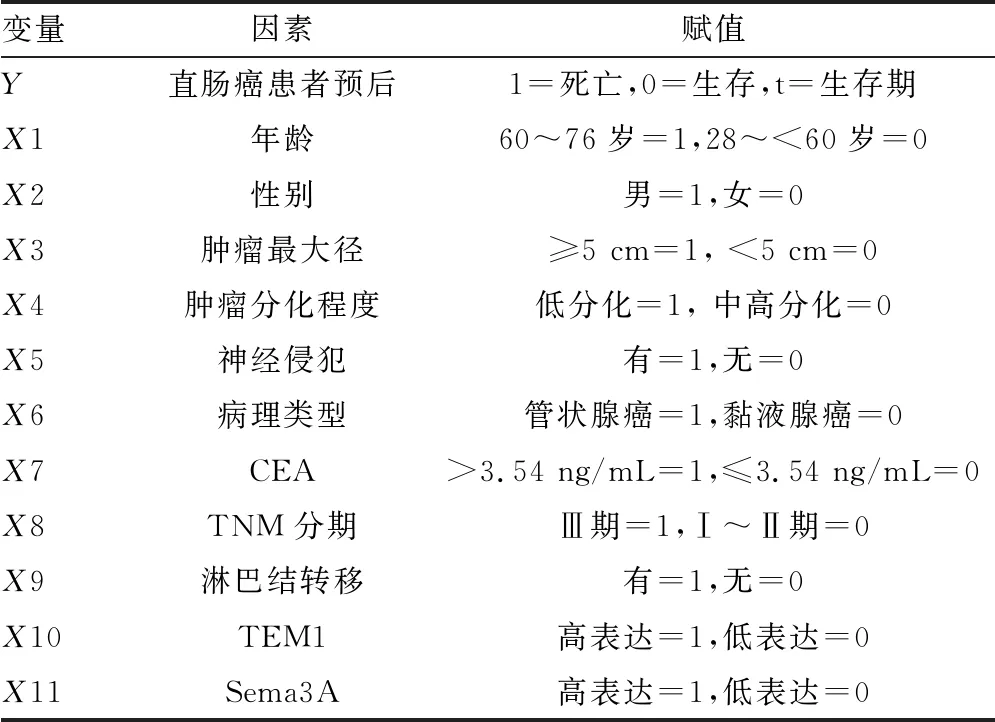
表3 赋值表
单因素Cox回归分析结果显示,肿瘤TNM分期Ⅲ期、肿瘤低分化、淋巴结转移、TEM1高表达、Sema3A高表达均是影响直肠癌患者预后的独立危险因素(P<0.05),见表4。多因素Cox回归分析结果显示,肿瘤TNM分期Ⅲ期、肿瘤低分化、淋巴结转移、TEM1高表达、Sema3A高表达是影响直肠癌患者预后的独立危险因素(P<0.05),见表5。
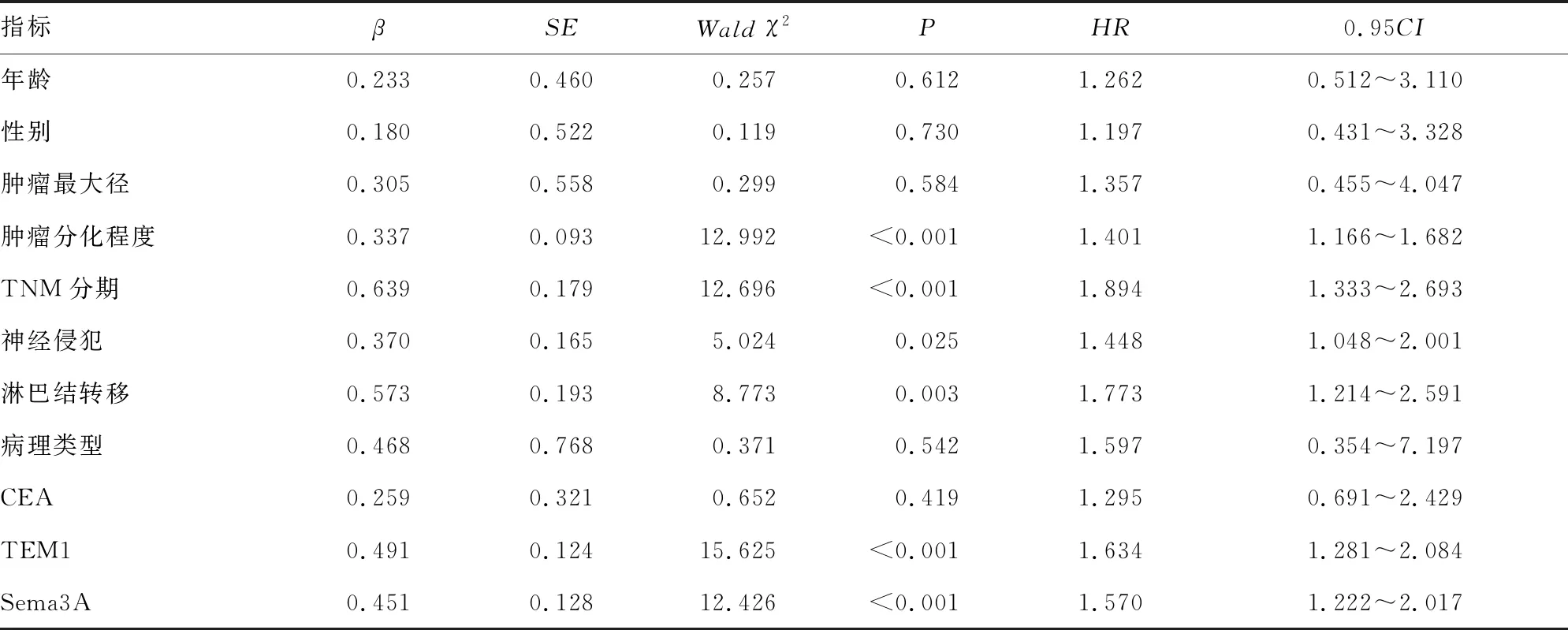
表4 影响直肠癌患者预后的单因素Cox回归分析结果
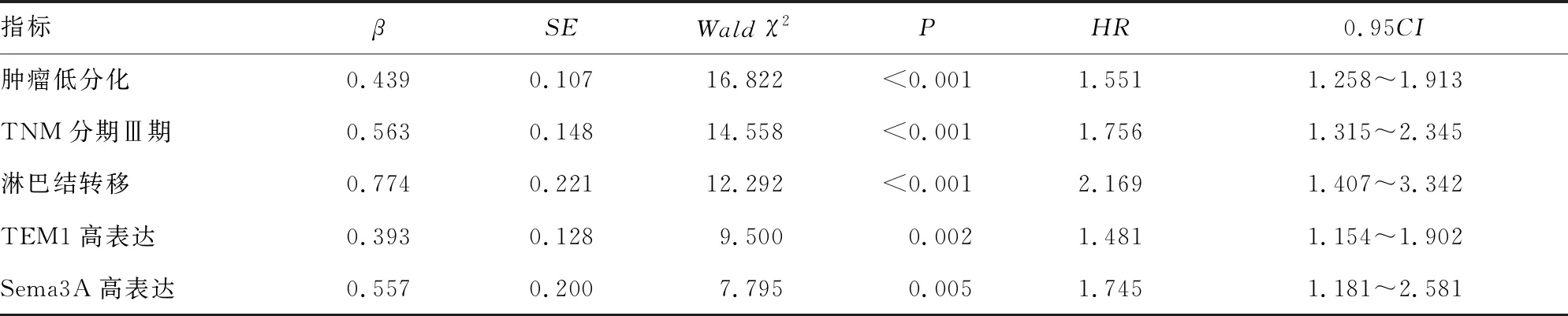
表5 影响直肠癌患者预后的多因素Cox回归分析结果
3 讨 论
直肠癌发病较为隐匿,早期缺乏典型症状及体征,部分患者确诊时已处于中晚期,即使积极进行手术治疗,术后也易发生肿瘤复发及转移,导致患者不良预后[7]。近年来随着分子生物学的发展,高通量基因检测有助于判断患者治疗的敏感性及预后,但由于费用昂贵、检测较为复杂,难以在临床上被广泛应用[8]。CEA、糖类抗原19-9等血清肿瘤标志物有助于直肠癌患者的诊断及随访评估,其水平升高往往提示存在肿瘤复发或转移的风险,但难以及时对直肠癌根治术后患者预后进行有效评估[9]。因此,寻找有效判断直肠癌患者预后的血清肿瘤标志物,对临床直肠癌根治术后患者预后的防治具有积极意义。
TEM1属于C型凝集素样跨膜受体,位于活化间充质细胞的质膜上,能与纤连蛋白结合[10]。在健康成人组织中TEM1的水平较低,但在肿瘤患者中水平升高,其能够将肿瘤细胞束缚在基质上,介导肿瘤细胞迁移至血管基底膜,促进肿瘤进展和转移[11]。本研究中,研究组患者血清TEM1水平明显高于对照组,表明TEM1可能参与促进直肠癌的发生进程。分析其原因可能与微小RNA的表达调控有关。研究发现,miR-125b-5p能够靶向结合细胞中TEM1的mRNA,调控TEM1的表达,直肠癌细胞中miR-125b-5p的水平下调导致TEM1水平异常升高,增强肿瘤细胞的侵袭能力[12]。本研究中,TEM1水平与肿瘤分化程度、TNM分期及淋巴结转移有关,表明TEM1的水平升高可能参与促进直肠癌的肿瘤进展。TEM1能够重塑肿瘤微环境中免疫细胞功能,发挥肿瘤促进作用。研究表明,肿瘤相关成纤维细胞中TEM1水平升高,TEM1通过结合巨噬细胞表面的CD68,募集并活化巨噬细胞,促进巨噬细胞由M1型向M2型极化,进而促进肿瘤细胞免疫逃逸,导致肿瘤进展[13]。此外,有研究表明,TEM1能够通过激活Wnt信号通路,促进肿瘤血管及淋巴管新生,促进肿瘤的增殖及血管淋巴管的转移[14]。本研究中,术前血清TEM1水平较高的直肠癌患者预后较差,并且是影响患者预后的独立危险因素,提示检测直肠癌患者术前血清TEM1水平有助于评估患者临床预后,可能是新的预后相关肿瘤标志物。既往研究表明,直肠癌细胞中TEM1的水平升高能够促进肿瘤细胞发生上皮间质转化,进而增强肿瘤细胞对奥沙利铂、5-氟尿嘧啶等化疗药物的耐药性,导致患者不良预后[12]。
信号素是一类分泌型或膜结合型信号蛋白家族,结构上具有特征性的N端Sema结构域,包含信号蛋白二聚化和受体结合位点,参与调节血管生成、肿瘤发生、炎症、细胞凋亡和免疫反应等多种病理生理过程[15]。Sema3A是脊椎动物信号蛋白中的分泌型蛋白,能够结合细胞表面受体蛋白激活下游信号级联反应,在调节免疫系统、血管生成、癌症转移等方面发挥重要作用[15]。本研究中,研究组患者血清Sema3A水平明显高于对照组,提示Sema3A可能参与直肠癌的发生。Sema3A的表达受转录水平调节。研究发现,肿瘤中miR-145的水平升高能够促进RNA聚合酶Ⅱ结合到Sema3A启动子上,并诱导Sema3A启动子的激活,在转录水平上促进Sema3A基因的表达[16]。本研究中,直肠癌患者血清的Sema3A水平与肿瘤分化程度、TNM分期及淋巴结转移有关,提示Sema3A促进直肠癌的恶性进展。研究表明,缺氧条件下能够诱导肿瘤细胞Sema3A的表达,Sema3A作为一种巨噬细胞招募诱导因子,能够与巨噬细胞表面神经纤毛蛋白-1受体结合,促进血管内皮生长因子受体1磷酸化,使巨噬细胞向M2型转化,从而促进肿瘤细胞的增殖和迁移[17]。有学者利用产生靶向神经纤毛蛋白-1受体的纳米抗体阻断其与Sema3A的相互作用,增加了结直肠癌肿瘤微环境中促炎症M1型巨噬细胞和肿瘤特异性CD8+T细胞的百分比,从而增强机体的抗肿瘤免疫能力[18]。此外,Sema3A属核基质蛋白,能够将肿瘤蛋白富集在核基质上,可为肿瘤DNA的复制提供支架,进而促进肿瘤细胞的恶性增殖[19]。本研究中,术前血清Sema3A水平较高的患者预后较差,是影响直肠癌患者预后的独立危险因素,提示Sema3A可能是一种新的评估直肠癌患者临床预后的肿瘤标志物。其机制可能与Sema3A能够增强靶向治疗药物的耐药性有关。研究表明,Sema3A的水平升高能够诱导Met酪氨酸激酶受体及缺氧依赖性信号通路的激活,抑制小分子酪氨酸抑制剂舒尼替尼的抗肿瘤作用,促进肿瘤细胞的侵袭和转移[20]。此外,本研究中,TNM分期Ⅲ期、肿瘤低分化、淋巴结转移也是影响直肠癌根治术患者预后的独立危险因素[21]。以上3项为危险因素的原因可能是因为TNM分期Ⅲ期、肿瘤低分化、淋巴结转移的患者病情程度更严重,往往导致不良预后的发生。因此,临床上对于直肠癌患者术后应明确肿瘤TNM分期,肿瘤分化程度及淋巴结转移状态,对于TNM分期Ⅲ期,肿瘤低分化及有淋巴结转移的患者,应密切监测患者术后肿瘤复发转移情况,制订全面的治疗方案,以改善患者的临床预后。
综上所述,直肠癌患者血清TEM1、Sema3A水平升高,二者水平与肿瘤分化程度、TNM分期及淋巴结转移有关。血清高TEM1、Sema3A水平的直肠癌患者预后较差,是影响直肠癌预后的独立危险因素。临床上可根据血清TEM1、Sema3A水平对直肠癌患者临床预后进行评估,指导临床诊治及随访。但本研究尚存在一定不足,一方面由于样本量较少,研究可能存在一定的偏倚,另一方面随访时间较短,有待今后扩大样本量,并延长随访时间进行深入研究。

