血清肿瘤标志物联合检测在非小细胞肺癌诊断和预后评估中的价值
张念伦,孔芹,薄丽英,姜冰雪
肺癌是最常见的恶性肿瘤,据世界卫生组织统计[1]目前肺癌的发病率和死亡率均居所有恶性肿瘤之首,给人类健康带来严重威胁。肺癌组织学类型分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)两类,其中85%~90%为NSCLC[2]。早期肺癌并无特异性临床症状,一旦出现如咳血、脊背放射疼、恶病质等典型临床症状来医院就诊时已处于晚期,即使经过治疗预后也极差,病死率高。统计数字显示[3]原位肺癌治愈率接近100%,早期肺癌经根治性手术5年生存率可达60%~90%,而晚期肺癌5年生存率仅为5%~20%。因此肺癌早期诊断、早期根治性手术尤为重要,能极大提高生存率,改善预后[4-5]。肺穿刺组织活检病理学检查是诊断肺癌的金标准,但作为有创检查不适合高危人群筛查及预后随访,低剂量多层螺旋CT检查在高危人群肺癌的筛查中得到了推广应用,但对于一些小病灶容易误诊和漏诊[6]。血清肿瘤标志物检测是一种体外无创非侵入式液体活检诊断技术,能检测到多种与恶性肿瘤相关的生物学标志物,它在恶性肿瘤的诊断中越来越受到临床重视,也是对影像学诊断的有效补充,它适合高危人群筛查及预后随访。微小RNA-21(miRNA-21)、癌胚抗原(CEA)、鳞状细胞癌抗原(SCCAg)是与肺癌发生发展密切相关的标志物。本研究欲选取血清miRNA-21、CEA、SCCAg联合检测诊断肺癌,以期为肺癌的早期诊断提供实验室依据。
1 一般资料与方法
1.1 一般资料 资料收集于2015年6月至2016年12月在日照市人民医院初次确诊的118例NSCLC患者(恶性肿瘤组)为研究对象,男71例,女47例;年龄38~82岁,平均年龄(62.53±15.69)岁;临床分期:Ⅰ期28例、Ⅱ期38例、Ⅲ期37例、IV期15例;组织类型:鳞癌53例、腺癌65例;分化程度:高分化32例,中分化45例,低分化41例。选取同期来医院就诊的50例肺部良性病变患者为良性对照组,均经病理学、影像学及血清学等排除癌变,包括肺良性结节、肺结核、肺炎等,其中男28例,女22例;年龄35~83岁,平均年龄(63.16±16.23)岁。另选取50例健康志愿者为正常对照组,男31例,女19例;年龄34~81岁,平均年龄(62.98±15.67)岁。三组人群性别、年龄等基线资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 选取标准 纳入标准:118例NSCLC患者均经病理组织学确诊;确诊前均未接受任何抗肿瘤治疗;均有血清miRNA-21、CEA、SCCAg检查资料及随访资料。排除标准:排除伴其他系统恶性肿瘤患者;排除严重肝肾功能不全者;排除研究资料不全者。
1.3 方法 清晨06:00—09:00抽取恶性肿瘤组及良性对照组和正常对照组空腹静脉血5 mL,静置自凝后分离血清待检。
血清miRNA-21采用实时荧光定量PCR法检测。血清总RNA 提取试剂盒购于美国Applied Biosyste公司,反转录试剂盒购于日本TaKaRa 公司,引物由上海生工生物工程公司设计和合成,PCR试剂盒购于北京艾德莱生物科技有限公司,ABI-7300型PCR仪购于美国Applied Biosyste公司。各反应步骤严格按照操作说明进行。以U6为内参,采用2-△△Ct的方法计算血清miRNA-21相对表达量。
血清CEA、SCCAg采用免疫电化学发光法检测,仪器为德国罗氏e-801,试剂为罗氏配套试剂。
1.4 结果判断 单项检测结果判断:血清miRNA-21、CEA、SCCAg单项检测超过截断值即判断诊断NSCLC阳性,等于或低于截断值即判断诊断NSCLC 阴性;联合检测结果判断:血清miRNA-21、CEA、SCCAg联合检测组合中,有一项或一项以上超过截断值即判断诊断NSCLC阳性,均等于或低于截断值即判断诊断NSCLC阴性。
1.5 预后评价 治疗结束后随访5年,每3个月来医院复查一次,复查项目包括影像学和血清miRNA-21、CEA、SCCAg检查,记录每次复查结果。在随访过程中发现复发、新的转移灶或死亡为发生事件,停止随访;随访过程中未发现复发、未出现新的转移灶或未出现死亡为无发生事件。
1.6 统计学方法 所得数据采用SPSS 20.0统计软件处理,计量数据以均数±标准差(±s)表示,两组间数据比较采用独立样本t检验,多组间计量数据比较采用方差(F)分析;以率[n(%)]表示计数资料,组间比较行χ2检验。绘制ROC曲线求取血清miRNA-21、CEA、SCCAg 诊 断NSCLC 最 佳 截 断值,采用Logistic多元回归进行多因素分析,利用Kaplan-Meier法及Log-rank检验生存分析。以病理诊断为金标准,用四格表法统计计算血清miRNA-21、CEA、SCCAg 单 项 及 联 合 检 查 诊 断NSCLC的价值。
2 结果
2.1 三组人群血清miRNA-21、CEA、SCCAg表达水平比较 恶性肿瘤组血清miRNA-21、CEA、SCCAg表达水平明显高于良性对照组和正常对照组(P<0.01);良性对照组和正常对照组血清miRNA-21、CEA、SCCAg水平比较差异无统计学意义(t=0.665、1.558、1.894,P=0.506、0.123、0.061),P>0.05,见表1。
表1 三组人群血清miRNA-21、CEA、SCCAg表达水平比较(±s)

表1 三组人群血清miRNA-21、CEA、SCCAg表达水平比较(±s)
注:miRNA-21=微小RNA-21,CEA=癌胚抗原,SCCAg=鳞状细胞癌抗原,下同;与两个对照组比较,aP<0.01。
组别 例数 miRNA-21 CEA/(ng·mL-1) SCCAg/(ng·mL-1)恶性肿瘤组 118 4.93±1.22a 121.36±33.56a 86.37±21.03a良性对照组 50 1.32±0.40 3.69±0.92 2.03±0.49正常对照组 50 1.17±0.35 3.42±0.81 1.85±0.46 F值 344.796 460.598 498.929 P值 <0.01 <0.01 <0.01
2.2 恶性肿瘤组患者血清miRNA-21、CEA、SCCAg表达水平与不同临床病理因素关系 恶性肿瘤组患者血清miRNA-21、CEA、SCCAg水平与患者年龄、性别无相关性(P>0.05),肿瘤直径>3 cm、临床高分期、低分化、复发、转移及治疗前患者血清miRNA-21、CEA、SCCAg水平明显高于肿瘤直径≤3 cm、临床低分期、高中分化、无复发、无转移及治疗后血清水平(P<0.05),miRNA-21 在鳞癌和腺癌血清表达水平比较差异无统计学意义(P>0.05),CEA在腺癌血清表达水平高于鳞癌(P<0.01),SCCAg在鳞癌血清表达水平高于腺癌(P<0.01),见表2。
表2 恶性肿瘤组血清miRNA-21、CEA、SCCAg表达水平与不同临床病理因素关系(±s)

表2 恶性肿瘤组血清miRNA-21、CEA、SCCAg表达水平与不同临床病理因素关系(±s)
注:组内分别比较,bP<0.05。
?项目 例数 miRNA-21 t值 P值 CEA/(ng·mL-1) t值 P值 SCCAg/(ng·mL-1) t值 P值年龄/岁 1.605 >0.05 1.840 >0.05 1.848 >0.05≤60 49 4.74±1.21 130.12±35.26 95.28±27.35>60 69 5.11±1.25 114.97±49.35 80.04±22.31性别 1.076 >0.05 1.630 >0.05 1.000 >0.05男71 4.77±1.18 125.34±34.26 88.25±25.14女47 5.06±1.75 115.35±29.87 83.53±25.01肿瘤直径/cm 5.959 <0.01 5.252 <0.01 6.675 <0.01≤3 51 3.93±1.10 102.97±28.64 65.51±19.47>3 67 5.67±1.85b 135.36±36.25b 102.25±35.42b组织类型 0.671 >0.05 7.363 <0.01 13.190 <0.01腺癌 65 4.86±1.23 140.23±37.52b 54.33±20.51鳞癌 53 5.01±1.18 98.22±19.68 125.67±37.26b临床分期 11.170 <0.01 6.822 <0.01 15.470 <0.01Ⅰ~Ⅱ期 66 3.50±1.03 102.43±26.89 45.49±15.32Ⅲ~Ⅳ期 52 6.75±2.06b 145.39±41.25b 138.26±45.61b分化程度 11.061 <0.01 8.130 <0.01 11.900 <0.01高、中分化 77 3.81±1.15 104.85±27.64 62.99±24.36低分化 41 7.03±2.14b 152.37±38.76b 130.26±39.81b淋巴结转移 2.569 <0.05 5.647 <0.01 5.744 <0.01无45 4.40±1.19 98.82±30.17 67.09±24.10有73 5.26±2.04b 135.26±36.21b 98.26±27.65b远处转移 9.290 <0.01 9.294 <0.01 11.940 <0.01无103 4.45±1.17 110.10±32.15 72.92±27.11有15 8.25±2.86b 201.43±54.27b 178.62±56.13b复发 9.316 <0.01 11.030 <0.01 11.470 <0.01无79 4.02±1.20 97.97±27.06 64.55±23.59有39 6.82±2.06b 168.74±42.15b 130.56±38.67b治疗 26.580 <0.01 36.990 <0.01 37.860 <0.01前118 4.93±1.22b 121.36±33.56b 86.37±21.03b后118 1.57±0.63 6.78±2.42 4.35±1.98
2.3 Logistic多因素回归分析 以血清miRNA-21、CEA、SCCAg表达水平为自变量,以是否发生NSCLC为因变量,进行多因素Logistic多元回归分析,结果显示血清miRNA-21、CEA、SCCAg水平均是影响发生NSCLC的独立危险因素,见表3。

表3 Logistic多因素回归分析
2.4 预后评价 治疗后随访5年,血清miRNA-21、CEA、SCCAg高水平表达组(miRNA-21>6.12、CEA>156.43 ng/mL、SCCAg>134.26 ng/mL)5年无事件生存率明显低于低水平表达组(miRNA-21≤6.12、CEA≤156.43 ng/mL、SCCAg ≤134.26 ng/mL),P<0.01,见图1~3。

图1 血清miRNA-21水平与NSCLC患者5年生存关系
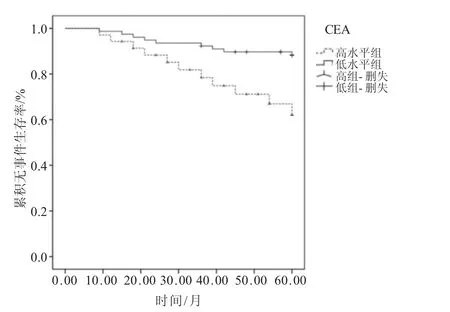
图2 血清CEA水平与NSCLC患者5年生存关系

图3 血清SCCAg水平与NSCLC患者5年生存关系
2.5 血清miRNA-21、CEA、SCCAg单项及联合检测诊断NSCLC的价值比较 以恶性肿瘤组、良性对照组血清miRNA-21、CEA、SCCAg表达水平绘制诊断NSCLC的ROC曲线,求取其诊断NSCLC的最佳截断值。ROC曲线显示血清miRNA-21、CEA、SCCAg诊断NSCLC的曲线下面积(AUC)分别为0.826(95%CI:0.775,0.896)、0.798(95%CI:0.729,0.873)、0.787(95%CI:0.715,0.862);最大约登指数分别为0.779、0.665、0.653,对应诊断NSCLC最佳截断值分别为miRNA-21:2.51,CEA:5.79 ng/mL,SCCAg:3.12 ng/mL。
以病理诊断为金标准,血清miRNA-21、CEA、SCCAg单项及联合检测诊断NSCLC价值,见表4。血清miRNA-21、CEA、SCCAg三项联合检测诊断NSCLC的敏感性、准确性、阴性预测值与各单项比较明显提高(P<0.01)。

表4 血清miRNA-21、CEA、SCCAg单项及联合检测诊断NSCLC的价值比较 单位:%
3 讨论
恶性肿瘤是在多种致癌因素相互作用下细胞增殖、分化失控而致癌变,在这个发生发展过程中机体会产生多种肿瘤相关物质,俗称肿瘤标志物[7]。肿瘤标志物可以是肿瘤细胞自身分泌产生的,也可以是肿瘤与机体相互作用产生的,它们可以存在于肿瘤组织内,也可以分泌到体液包括外周血液循环中[8]。肿瘤标志物表达异常,提示体内恶性肿瘤可能存在。由于癌基因的复杂性,一种恶性肿瘤可以产生多种标志物,同时一种标志物可以存在于多种恶性肿瘤中,它们的敏感性、特异性不尽相同,单项检测价值有限,根据每种恶性肿瘤的性质有选择的数种肿瘤标志物联合检测是提高诊断符合率的有效方法[9]。
miRNA是一类单链非编码的小分子RNA,以反转录后的方式通过调控不同基因的表达,参与了细胞分化、增殖、黏附、凋亡等多种重要的生物学活动[10]。miRNA在恶性肿瘤的发生发展过程中发挥癌基因或抑癌基因作用,促进或抑制恶性肿瘤的生成[11]。miRNA-21是miRNA家族中的一员,研究表明[12]miRNA-21在肺癌组织或血清中表达上调,作为癌基因促进癌细胞的增殖、转移及抑制癌细胞凋亡,与肺癌的发生发展密切相关。相关报道显示[13]miRNA-21在NSCLC血浆表达水平显著高于对照组,可以作为诊断NSCLC的相关性指标。本研究miRNA-21诊断肺癌的敏感性为72.88%,与报道基本一致;NSCLC外周血miRNA-21表达水平与肿瘤临床分期呈明显正相关,复发转移者外周血miRNA-21表达水平升高更明显[14]。miRNA-21可以作为一种新型标志物用于NSCLC 诊断及预后判断。
CEA是来自于胚胎发育时期一种抗原物质,出生后正常健康人群外周血含量很低,一般小于5.00 ng/mL。恶性肿瘤细胞尤其腺癌细胞可以分泌大量CEA,从而使血清CEA表达水平升高[15]。CEA在肺癌患者血清有不同程度表达,尤其NSCLC中的腺癌患者血清有高表达。刘小燕[16]研究表明NSCLC组中CEA在腺癌患者血清表达水平高于鳞癌,我们的研究与此一致。研究发现[17]肺癌临床高分期、低分化、复发转移患者血清CEA水平明显高于临床低分期、高中分化、无复发转移患者血清水平,治疗有效后血清CEA水平明显降低,因此CEA是判断肿瘤复发转移与评估预后较好的血清学指标。
SCCAg是一种糖蛋白,是鳞状上皮癌的相关标志物。当上皮细胞发生恶变时,恶性细胞增殖产生大量SCCAg,释放入血而引起外周血SCCAg异常增高,SCCAg是最早用于诊断宫颈癌的相关标志物[18]。近几年研究发现[19]SCCAg也是肺癌发生发展过程中的一种相关标志物。李文明等[20]研究表明,SCCAg对NSCLC的诊断敏感性高于SCLC,鳞癌又高于腺癌,其对肺鳞癌、肺腺癌、小细胞肺癌诊断敏感性依次为65.00%、52.10%、12.50%,说明SCCAg对NSCLC尤其鳞癌诊断价值较高。不过一些肺部良性疾病如个别良性肺结节、肺结核也有一过性升高现象,因此对待检验结果要注意鉴别[21]。
本研究结果显示,恶性肿瘤组患者血清miRNA-21、CEA、SCCAg水平明显高于对照组,恶性肿瘤组患者肿瘤直径>3 cm、临床高分期、低分化、复发、转移及治疗前患者血清miRNA-21、CEA、SCCAg水平明显高于肿瘤直径≤3 cm、临床低分期、高中分化、无复发、无转移及治疗后患者血清水平,miRNA-21水平与NSCLC组织类型无相关性(P>0.05),CEA在腺癌血清表达水平高于鳞癌(P<0.01),SCCAg在鳞癌血清表达水平高于腺癌(P<0.01);血清miRNA-21、CEA、SCCAg水平是发生NSCLC的独立危险因素;依据生存曲线可评估预后。
血清miRNA-21、CEA、SCCAg三项联合检测诊断NSCLC的敏感性和准确性明显高于单项检测,联合检测可以相互补充相互印证,减少误漏诊,有利于肺癌早期诊断。

