膝关节镜清理联合PRP 治疗膝关节骨性关节炎疗效分析
曾瑜瑜 饶 东 侯 南 彭 聪
( 兴宁市人民医院, 广东 兴宁 514555 )
膝关节骨性关节炎(KOA)是以关节积液、膝关节肿胀和疼痛、功能受限为典型症状的慢性退行性关节疾病[1],病理基础主要是软骨退行性变,由于疾病发展具有不可逆性,容易丧失下肢功能,严重影响生活质量[2]。 现阶段临床治疗KOA 时重在消除炎症、减轻疼痛感,治疗方法包括关节内注射药物、口服药物、手术等,其中关节内注射玻璃酸钠(HA)虽然能够润滑关节[3],缓解疼痛,但无有力证据表明其能促进关节软骨再生、延缓病情进展;口服药物通常适用于疾病早期,且长期使用非甾体抗炎药容易诱发肠道反应等不适症状[4];手术费用高昂,容易加重患者经济负担。 因此,尚需寻求促进软骨修复、延缓KOA 进展的治疗手段。 有报道指出[5],富血小板血浆(PRP)含有转化生长因子(TGF -β)、血小板衍化生长因子(PDGF)等生长因子,既能消除炎症,也能促进组织修复,适用于治疗KOA。 基于此,本文以我院2020 年1 月—2022 年4 月收治的60 例KOA 患者为例,就膝关节镜清理+PRP 对KOA 患者的疗效展开分析。 现报告如下。
1 临床资料
1.1 一般资料
纳入我院2020 年1 月—2022 年4 月收治的60例KOA 患者,遵循随机数字表法将病例分配至对照组(30 例)、观察组(30 例)。 对照组:男/女为13 例(43.33%)/17 例(56.67%);年龄50—71 岁,平均年龄为(60.6 ±2.3)岁;病程10—83 个月,平均病程为(46.4 ± 5.0) 个月;体质量指数(BMI) 22—26 kg/m2,平均BMI 为(24.3 ±0.4)kg/m2。 观察组:男/女为12 例(40.00%)/18 例(60.00%);年龄49—72 岁,平均年龄为(60.9 ±2.4)岁;病程11—82个月,平均病程为(46.3 ±5.4)个月;BMI 为21—26 kg/m2,平均BMI 为(24.1 ±0.3)kg/m2。 (1)纳入标准:①基于《骨关节炎诊疗指南(2018 年版)》[6]、临床检查(如膝关节X 线检查)等确诊;②单侧病变;③患者充分了解研究方法、目的,自愿作为受试者。 (2)排除标准:①既往膝关节手术史、外伤史者;②近1 年接受相关治疗者;③伴类风湿性关节炎者;④感染性关节炎者;⑤膝关节融合或严重畸形者;⑥系统性红斑狼疮者;⑦服用抗凝血剂、免疫抑制剂者;⑧依从性差者;⑨因各种原因失访者;⑩出现严重不良事件者。 基本病例资料(DKD 分期、病程等)无差异,P>0.05。
1.2 方法
对照组行膝关节镜清理。 取仰卧位,采用硬膜外麻醉,从髌下内外侧入路,之后在关节镜辅助下探查膝关节,结合病变情况实施切除多余滑膜、软骨成形术、半月板修整成型、骨赘摘取等治疗,最后冲洗关节腔,吸出关节腔内液体,术后引流、抗感染处理。观察组行膝关节镜清理+PRP。 以自体PRP 制备套装/一次性使用离心管50 mL(江苏康健医疗用品有限公司)、医用离心机(山东百欧医疗科技有限公司),2 次离心法制备PRP。 方法为:(1)制备前准备。 每周定时消毒2 次超净工作台、操作间,每次1小时,同时每次操作前依据治疗需要,在超净工作台上消毒无菌采血管1 小时以上,且离心机内温度降至4 ℃。 (2)制备方法。 无菌环境下单侧取30 mL肘静脉血,将其置于PRP 专用抗凝套管,离心(转速800 r/min ×6 min),将全血分为3 层(下层血细胞、中间层PRP、上层血清),弃上层血清再次离心(转速1 400 r/min ×5 min),取中间层约1—2 mL,即为PRP。 (3)注射方法。 于关节镜清理术后关节腔内注射PRP,进针点为髌骨下髌韧带外侧关节间隙,以一次性注射器吸取PRP 且缓慢注射于关节腔内,之后被动屈伸膝关节,促使PRP 均匀扩散,每周注射1次,总共注射3 次。 (4)术后处理。 无菌包扎,嘱咐患者勿剧烈活动、过度负重行走,注意休息。 全部患者随访3 个月,评价疗效。
1.3 观察指标
将膝关节评分量表(Lysholm)、膝关节骨性关节炎严重性指数(ISOA)、视觉模拟评分法(VAS)、血清炎症因子、健康调查简表(SF -36)、治疗有效率、并发症情况作为观察指标。 (1)Lysholm:包括使用支撑物、肿胀度、跛行、蹲姿等,共100 分,膝关节功能好者分值高[7]。 (2)ISOA:共14 分,病情重者分值高[8]。 (3)VAS:在10 cm 的直线上标注自身疼痛程度,10 分最痛、0 分无痛[9]。 (4)血清炎症因子:取空腹静脉血,以酶联免疫吸附法检测白细胞介素-6(IL-6)、白细胞介素-1β(IL -1β),以免疫比浊法测定超敏C 反应蛋白(hs -CRP)[10]。 (5)SF -36:从精神健康(MH)、生理职能(RP)、社会功能(SF)评估,每项100 分,生活质量高者分值高。 (6)治疗有效率:①无效。 膝关节疼痛等症状无好转。 ②有效。膝关节活动度有所好转,疼痛感减轻,能够上下楼梯、下蹲等。 ③缓解。 膝关节活动度略微受限,疼痛感明显减轻,能够维持基本工作与生活。 ④显效。膝关节活动自如,疼痛感消失,能够正常工作、生活。⑤计算总有效率(有效率+ 缓解率+ 显效率)[11]。(7)并发症情况:统计且记录。
1.4 统计学分析
以SPSS23.0 处理数据,Lysholm、ISOA、VAS、血清炎症因子、SF -36 为计量型数据,表示为(±s),组间比较行t 检验;治疗有效率、并发症情况为计数型数据, 表示为(n,%), 组间比较行x2检验。P<0.05代表数据差异有统计学意义。
2 结果
2.1 2 组Lysholm、ISOA、VAS 对比
治疗前, 组 间Lysholm、 ISOA、 VAS 无 差 异,P>0.05;治疗后3 个月,观察组Lysholm 较对照组明显增高,ISOA、VAS 较低,P<0.05。 见表1。
表1 2 组Lysholm、ISOA、VAS 对比( ±s,分)
组别 时间 Lysholm ISOA VAS对照组 治疗前 53.38±3.66 11.34±1.48 6.74±0.87(n=30) 治疗后 69.73±3.39 8.63±1.12 3.36±0.44观察组 治疗前 52.99±3.74 11.43±1.65 6.80±0.79(n=30) 治疗后 75.28±3.27 7.46±1.09 2.10±0.31 t(组间治疗前/后) 0.408/6.454 0.222/4.100 0.279/12.822 P(组间治疗前/后) 0.685/0.000 0.825/0.000 0.781/0.000
2.2 2 组血清炎症因子对比
治疗前,组间IL -6、IL -1β、hs -CRP 无差异,P>0.05;治疗后3 个月,观察组IL-6、IL -1β、hs -CRP 较对照组降低更明显,P<0.05。 见表2。
表2 2 组血清炎症因子对比( ±s)
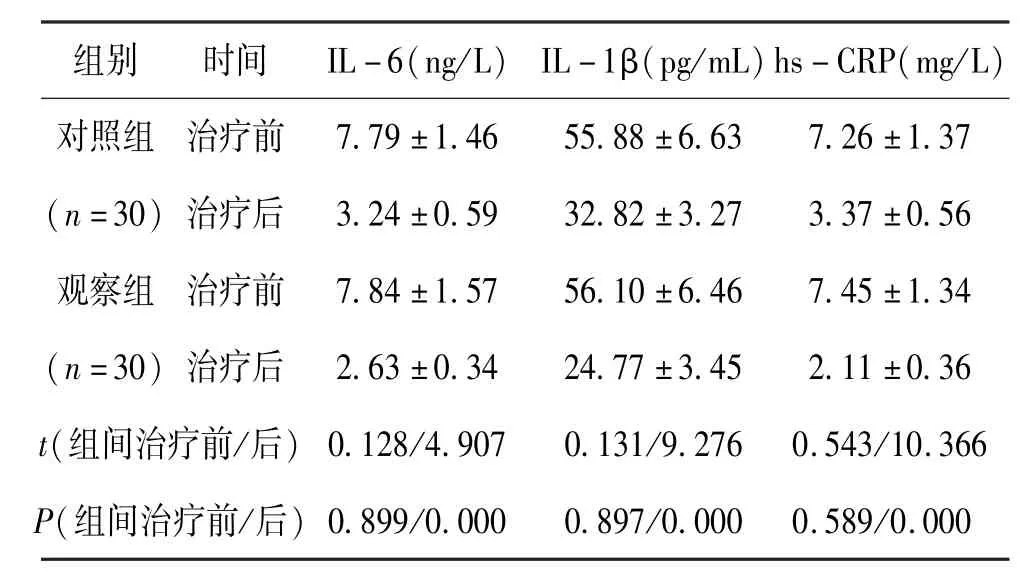
表2 2 组血清炎症因子对比( ±s)
组别 时间 IL-6(ng/L) IL-1β(pg/mL)hs-CRP(mg/L)对照组 治疗前 7.79±1.46 55.88±6.63 7.26±1.37(n=30) 治疗后 3.24±0.59 32.82±3.27 3.37±0.56观察组 治疗前 7.84±1.57 56.10±6.46 7.45±1.34(n=30) 治疗后 2.63±0.34 24.77±3.45 2.11±0.36 t(组间治疗前/后) 0.128/4.907 0.131/9.276 0.543/10.366 P(组间治疗前/后) 0.899/0.000 0.897/0.000 0.589/0.000
2.3 2 组SF-36 对比
治疗前,组间MH、RP、SF 无差异,P>0.05;治疗后3 个月,观察组MH、RP、SF 较对照组明显增高,P<0.05。 见表3。
表3 2 组SF-36 对比( ±s,分)
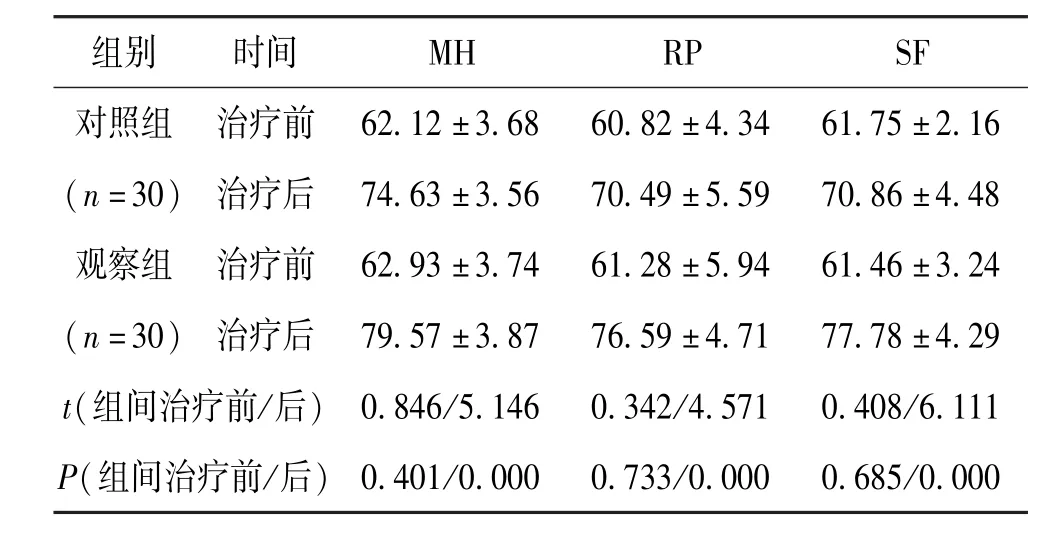
表3 2 组SF-36 对比( ±s,分)
组别 时间 MH RP SF对照组 治疗前 62.12±3.68 60.82±4.34 61.75±2.16(n=30) 治疗后 74.63±3.56 70.49±5.59 70.86±4.48观察组 治疗前 62.93±3.74 61.28±5.94 61.46±3.24(n=30) 治疗后 79.57±3.87 76.59±4.71 77.78±4.29 t(组间治疗前/后) 0.846/5.146 0.342/4.571 0.408/6.111 P(组间治疗前/后) 0.401/0.000 0.733/0.000 0.685/0.000
2.4 2 组治疗有效率对比
经症状观察及数据统计,在治疗有效率方面,观察组为96.67%,高于对照组的76.67%,P<0.05。见表4。
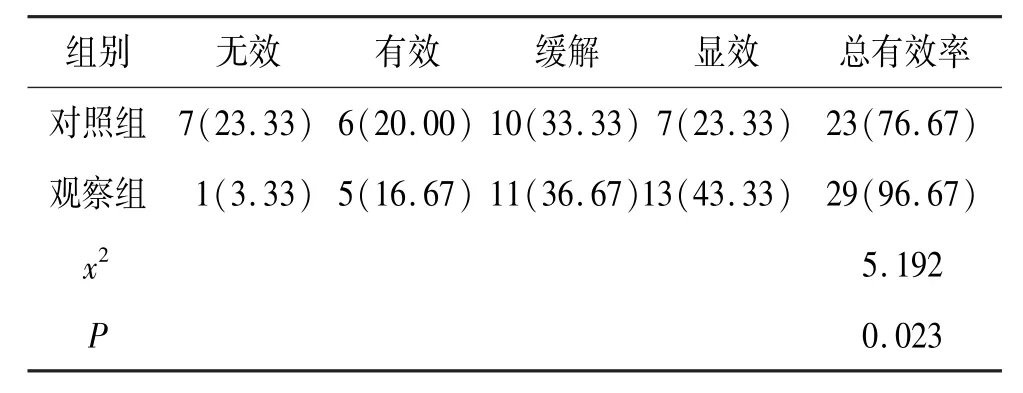
表4 2 组治疗有效率对比(n,%,n=30)
2.5 2 组并发症情况对比
2 组均无明显并发症,仅观察组有2 例穿刺点疼痛,未经处理自然消失。
3 讨论
3.1 关于KOA 及其治疗现状
3.1.1 关于KOA
KOA 与细胞因子、体力活动、年龄及性别等因素有关。 体力活动:较之脑力劳动者,重体力劳动者更易罹患KOA,例如矿工、码头工人、农民等因长期负重状态下反复进行跪姿、蹲姿等工作姿态,容易增加膝关节磨损,同时脑力劳动者因知识程度较高,普遍膝关节养护知识,能够更充分地保护膝关节,防止膝关节过快退变。 年龄:一是年龄增长后伴有软骨细胞磷酸化、线粒体氧化的异常,使得软骨细胞无法完成能量代谢,出现增殖,造成关节软骨退变;二是膝关节长期劳损会不断降解、破坏软骨细胞,加之其再生能力弱,所以最终会使得软骨层变薄,出现一系列症状。 性别:女性患者多于男性患者,考虑与女性体内内源性雌激素水平较高,其能阻止破骨细胞破坏骨质、促进成骨细胞功能,造成成骨量增加、关节周围骨质增生有关。 上述因素综合作用下介导的慢性炎症反应会造成软骨下骨质、细胞外基质、软骨细胞的合成与降解失衡,最终导致KOA。
3.1.2 KOA 治疗现状
KOA 治疗现状包括:(1)物理治疗:如电疗、红外线疗法、热敷、蜡疗等,能够改善软骨下骨结构,加速膝关节软骨代谢,改善关节功能。 (2)药物治疗:例如采用非甾体类抗炎药物(简称“NSAIDs”),如美洛昔康、塞来昔布等,能够阻断前列腺素,抑制环氧化酶活性,减轻疼痛感,但是容易出现消化道功能紊乱等毒副作用;关节腔注射药物,如糖皮质激素、PRP、玻璃酸钠;镇痛药物,如乙氨基酚。 (3)手术治疗:如膝关节镜清理术,其兼具效果确切、恢复快、创伤小等优势,通过清理剥脱的滑膜与软骨、切除骨赘等,能够避免膝关节活动时破坏、刺激膝关节,减轻膝关节疼痛感,而通过修复半月板与取出游离体等操作,则能减轻关节面创伤,避免因膝关节面损伤而引起深部疼痛,不过随着膝关节逐渐退变,同时关节液分泌减少,膝关节腔内软骨面难以得到有效营养与润滑,再次疼痛发生率较高,甚至疼痛程度会加重。 近年来,PRP 因富含多种生长因子,能够促进组织、软骨修复,以及使用方便、制备简便、成本低等,逐渐成为治疗KOA 的热点。 卢庆峰[12]等学者的报道指出,膝关节镜清理+PRP 能够促进KOA 患者早日康复。
3.2 关于PRP
3.2.1 PRP 介绍
PRP 最早起源于80 年代,此时有学者发现纤维蛋白胶密封性较好,适用于颌面、口腔外科手术时能够促进组织修复,之后Marx 在1986 年时在颌面外科植骨手术中首次使用了PRP,正式基于上述研究,PRP 逐渐兴起,且逐渐被用于妇科、整形外科、神经科学、运动医学、骨科等。 PRP 源自自体血液,首先借助外周静脉穿刺得到少量血液,之后离心、浓缩血液样本,再将其注入患者体内,由于含有较高浓度血小板(不低于全血的2 倍),能够在调节凝血反应及炎症、维持组织稳态等方面发挥重要作用,例如能够抑制骨与血管重构、胶原合成、软骨细胞凋亡、炎症调节等,而正是因为PRP 具备上述特性,使得其能用于治疗KOA。 另外,血小板源自巨核细胞,其细胞质包括3 种颗粒(致密颗粒、α 颗粒、噬菌体)、细胞器,其中α 颗粒在组织修复方面发挥着重要作用,主要是因为其中存在生长因子(GF),一旦血小板活化,这些生长因子便会被释放,且在小范围内产生反应,同时这些生长因子与细胞因子、凝血因子、血小板内其他蛋白等均能刺激软骨细胞增殖,减少促炎细胞因子代谢、分解,加速软骨细胞软骨基质分泌,例如源自PRP 的生长因子及其家族包括:一是血管内皮生长因子(VEGF),其对血管结构再生、形成有一定影响,且在重建养分流动中至关重要;二是组织生长因子β(TGF -β),其因能够促进软骨细胞分化、增殖,而被认为在软骨再生中不可或缺,同时TGF -β也能拮抗白细胞介素-1(IL -1),IL -1 是促炎因子,能够加速囊内结构降解。
3.2.2 PRP 获取
一方面而言,PRP 能够经由血液离心获得,属于血小板浓缩物,但是浓度高于血小板基础浓度的3—5倍;另一方面而言,PRP 也能借助单采成分血机器,从血液中分离出来需要的细胞成分,再将其他成分输回给献血者。 另外,为了防止血液样本凝血,尚需借助枸橼酸葡萄糖、枸橼酸钠等抗凝剂避免血小板活化。 此外,在离心操作期间,可以采用双次离心(最常用)、单次离心,而离心后,受密度效应影响,血液成分将会被划分为白系、贫血小板血浆、红系、富血小板血浆。
3.2.3 PRP 在KOA 中的机制
PRP 在KOA 中的机制包括:(1)促软骨修复:PRP 因获取自患者静脉血,所以具有无毒、制备简便、取材方便、无免疫原性反应等优势,自1998 年被证实富含大量生长因子且适用于临床后,发现这些生长因子能够抑制破骨细胞,促进成骨细胞增殖,诱导骨基质、软骨的合成,进而缩短软组织愈合时间;当在关节腔内注入PRP 且经激活剂激活后,借助血小板脱颗粒作用,能够缓慢释放α 颗粒中生长因子,分泌二型胶原、蛋白聚糖等特异性基质,使其参与软骨修复,同时借助细胞因子机制能够激活多形软骨细胞,使其参与软骨修复,而在软骨损伤早期便进行相关干预,能够控制软骨退行性病变;另外,组织损伤后会出现血小板衍化生长因子(PDGF),其借助促进中性粒细胞、巨噬细胞趋化,以及刺激软骨细胞、间充质干细胞有丝分裂,且调控胶原酶分泌、胶原合成,能够促进软骨代谢,逐渐修复软骨;此外,TGF -β、胰岛素样生长因子(IGFs)能够促进软骨细胞增殖,VEGF 结合内皮细胞表面受体后则能刺激血管生成,加速有丝分裂、内皮细胞迁移,且在局部血管再生后能够改变局部血运,从而促进炎症因子消散、组织修复。 因此,总结膝关节受损后软骨再生修复包括:一是借助软骨下骨、软骨膜下细胞生长分化完成软骨外修复;二是软骨细胞分裂增殖后进行软骨内修复,而PRP 则能在多种细胞因子共同作用下完成上述修复过程。 (2)缓解局部无菌性炎症:KOA 除软骨破坏外,还涉及炎症因子介导的软组织重塑,而PRP 则能抑制无菌性炎症,主要是因为:一是活化后PRP 能够分泌肝细胞生长因子(HGF),抑制核转录因子信号通道,起到抗炎效果;二是将PRP 注入膝关节腔内后,能够使关节腔内充满大量白细胞,能够诱导炎症调节因子聚集在损伤部位,调节局部炎症反应,发挥抗炎、修复组织效果等。
3.3 关于膝关节镜清理+ PRP 在本研究中的有效性
本次研究表明,较之单纯行膝关节镜清理,膝关节镜清理+ PRP 对KOA 患者有较好效果,具体而言:(1)膝关节镜清理术能够彻底清除患者关节软骨磨损后碎屑、关节腔内软骨降解颗粒等致病因子,从而改善膝关节内物理环境,而术后在关节腔内注射PRP,可以更好地发挥生长因子再生修复作用[13],分化、增殖软骨细胞,促使软骨基质合成,抑制破骨细胞,保护关节,修复软骨,改善膝关节内化学环境,所以二者能够从多途径发挥协同作用,尽快减轻疼痛症状,改善膝关节功能,故观察组Lysholm、ISOA、VAS、治疗有效率更佳,P<0.05。 (2)KOA 与环境、患者自身身体原因等因素有关,往往伴有进行性关节软骨磨损、骨赘,以及关节部位微环境改变、膝关节退行性病变,而关节部位微环境出现改变后,容易提升炎症因子水平,减少生长因子合成与分裂,影响关节软骨修复,本次监测2 组IL -6(抑制骨糖蛋白合成,加速纤维细胞合成,加重软骨关节破坏)、IL-1β(破坏关节软骨细胞)、hs -CRP(重要的促炎因子),结果显示观察组IL -6、IL -1β、hs -CRP 较低,P<0.05。 可能是因为:观察组加用PRP 后,由于其能抑制金黄色葡萄球菌、大肠杆菌的生长,以及能够释放大量胰岛素生长因子、血管内皮生长因子等[14],有助于降低促分解代谢基因表达,改善金属基质蛋白酶-2、环氧化酶-2 表达,所以能够抑制KOA 病理炎症反应,减轻炎症级联反应。 (3)KOA患者受治疗效果、病程绵长、治疗费用、功能受限等因素的影响,生活质量欠佳,本次采用膝关节镜清理+PRP,由于疗效显著、PRP 成本低,能够迅速缓解疼痛感及病情,可以提高生活质量,故观察组SF -36更佳,P<0.05。 (4)研究结果显示2 组均无明显并发症,可能是因为PRP 源自患者自身,无免疫排斥[15],安全性高。
综上所述,由于膝关节镜清理+PRP 能够有效治疗KOA 患者,且并发症少,能够缓解疼痛感,减轻炎性状态,提高膝关节功能、生活质量,具有推广价值。

