仙鹤草正丁醇提取部位抗炎作用及其化学成分研究
唐当柱 徐娅玲 杨琼英 杨艳 孟庆婷
摘要:目的 考察仙鶴草正丁醇提取部位抗炎的活性部位,并探讨其作用机制和物质基础。方法 采用花生四烯酸、角叉菜胶复制大鼠足趾肿胀模型,蛋白质印迹法检测大鼠足部组织中COX-1、COX-2、5-LO的含量,探讨仙鹤草正丁醇提取部位的抗炎作用;采用大孔树脂对仙鹤草正丁醇提取部位进行分离,采用二甲苯致小鼠耳肿胀实验对仙鹤草正丁醇提取部位的不同洗脱部位(水洗脱部位、30%乙醇洗脱部位、60%乙醇洗脱部位、90%乙醇洗脱部位)进行抗炎有效部位筛选;采用花生四烯酸、角叉菜胶复制小鼠足趾肿胀模型,ELISA法检测小鼠血液IL-1β、PGE2、LTB4、TNF-a、IL-10的含量,对仙鹤草正丁醇提取部位的90%乙醇洗脱部位进行抗炎机制研究并进行化学成分分离。结果 仙鹤草正丁醇提取部位能够减少AA、角叉菜胶诱导的大鼠足趾肿胀度,降低AA、角叉菜胶诱导的大鼠足趾组织中COX-1、COX-2、5-LO的表达;仙鹤草90%乙醇洗脱部位能抑制小鼠耳肿胀度以及足趾肿胀度,降低IL-1β、TNF-a、PGE2的表达,升高IL-10的表达,但对LTB4的表达未见明显抑制作用;分离得到8个化合物,鉴定了5个化合物的结构,分别为:科罗索酸、槲皮素、芦丁、胡萝卜苷、β-谷甾醇。结论 (1)仙鹤草正丁醇提取部位可通过抑制COX和5-LO两条途径发挥抗炎作用。(2)仙鹤草正丁醇提取部位的90%乙醇洗脱部位通过抑制COX途径从而降低致炎因子PGE2、IL-1β、TNF-a的表达、升高抗炎因子IL-10的表达实现抗炎,但对5-LO途径诱导的LTB4未见明显抑制作用。(3)已鉴定的5个化合物中,科罗索酸、槲皮素和芦丁均有文献报道其具备抗炎活性,表明仙鹤草正丁醇提取部位的90%乙醇洗脱部位是由科罗索酸、槲皮素和芦丁等共同发挥抗炎作用。
关键词:仙鹤草;正丁醇提取部位;抗炎;化学成分
中图分类号:R285.5 文献标志码:A 文章编号:1007-2349(2023)04-00086-10
Study on the Anti-inflammatory Effect and Chemical Compositions ofN-butanol Extract from Hairyvein Agrimony
TANG Dang-zhu1,2, XU Ya-ling2, YANG Qiong-ying2, YANG Yan2, MENG Qing-ting2
(1. Yunnan University of Traditional Chinese Medicine, Kunming 650500, China;2. Kunming Health Vocational College, Kunming 650101, China)
【Abstract】Objective: To study the anti-inflammatory activity site of n-butanol extract from Hairyvein Agrimony, and to explore its mechanism of action and material basis. Methods: Arachidonic acid and carrageenan were used to duplicate the rat model of toe swelling. The contents of COX-1, COX-2 and 5-LO in the foot tissues of rats were detected by Western Blotting, and the anti-inflammatory effect of n-butanol extract from the herb were studied. The extract sites of n-butanol were separated by macroporous resin. The experiment of ear swelling induced by xylene in mice was conducted to screen the anti-inflammatory effective site from different elution parts (water elution part, 30% ethanol elution part, 60% ethanol elution part, 90% ethanol elution part) of n-butanol extract from Hairyvein Agrimony. Arachidonic acid and carrageenan were used to duplicate a mouse model of toe swelling. The contents of IL-1β, PGE2, LTB4, TNF-a and IL-10 in the blood of mice were determined by ELISA. The anti-inflammatory mechanism of 90% ethanol-eluting part of n-butanol extract was studied and their chemical components were separated. Results: The n-butanol extract from Hairyvein Agrimony could reduce the toe swelling of rats induced by AA and carrageenan, and reduce the expression of COX-1, COX-2 and 5-LO in the toe tissue of the rats induced by AA and carrageenan. The 90% ethanol elution part of Hairyvein Agrimony could inhibit the ear swelling and toe swelling in mice, decrease the expressions of IL-1β, TNF-a and PGE2, and increase the expression of IL-10, but did not significantly inhibit the expression of LTB4. 8 compounds were isolated and 5 compounds were identified: corosolic acid, quercetin, rutin, carotenoside and β-sitosterol. Conclusions: (1) The n-butanol extract can exert anti-inflammatory effect through the inhibition of COX and 5-LO. (2) The 90% ethanol eluting fraction of n-butanol extract can reduce the expressions of inflammatory factors PGE2, IL-1β, TNF-a and increase the expression of anti-inflammatory factor IL-10 through inhibiting COX pathway to achieve anti-inflammatory effect, but does not show significant inhibitory effect on LTB4 induced by 5-LO pathway. (3) Among the 5 identified compounds, corosolic acid, quercetin and rutin have been reported to have anti-inflammatory activities, indicating that 90% of the ethanol-elution parts of n-butanol extract from Hairyvein Agrimony are composed of corosolic acid, quercetin and rutin.
【Key words】Hairyvein Agrimony; N-Butanol Extraction Site; Anti-Inflammatory; Chemical Composition
炎症(inflammation)是指具有血管系统功能的生物活体组织应对各种损伤因子刺激所产生的防御性反应,主要表现为红、肿、热、痛及功能障碍等症状,其参与心脑血管疾病、肿瘤、人体感染变态反应等多种人类重大疾病的发生和发展过程,炎症发生后如果得不到及时治疗,可能引发一系列级联反应[1-2]。临床上常用抗炎药主要为非甾体类抗炎药(non-steroid anti-inflammatory drugs,NSAIDs)和甾体类抗炎药(steroid anti-inflammatory drugs,SAIDs)[3]。NSAIDs通过抑制花生四烯酸(arachidonic acid,AA)代谢的COX途径(COX-1和COX-2)从而减少炎症因子前列腺素(prostaglandins,PGs)的释放而发挥抗炎作用[4-5]。目前认为COX-1为机体所固有,维持机体的一般生理功能;COX-2为诱导形成,在过量表达后会引起炎症反应[6]。由于非选择性COX抑制剂对COX-1抑制作用较强,易引发胃溃疡、胃出血、肝脏不同程度损伤等不良反应,认为选择性COX-2抑制剂具有重要的临床价值[7-8]。但是,近年有服用选择性COX-2抑制剂的人群患心肌梗死、脑卒中、血栓等风险增高的报道而相继撤市[9-10]。SAIDs为激素类药物,此类药物虽抗炎作用强,但易引起糖、蛋白质和脂肪的代谢紊乱,并诱发糖尿病、骨质疏松,加重消化性溃疡,导致伤口难以愈合等不良反应[11]。因此,寻找活性强、不良反应少的抗炎药物成为现代中药抗炎研究的热点。《本草纲目拾遗》就有仙鹤草治疗疔肿、肺痈、乳痈等与炎症相关疾病的记载,临床也常用于滴虫性阴道炎、口腔炎、肠炎、盆腔炎、原发性肾小球肾炎等各类炎症的治疗[12-21]。虽然近年对仙鹤草的化学成分、抗炎作用等开展了广泛的研究,但作用机制、物质基础仍不够明确。本研究以药效学与化学研究相结合的方法,以寻求抗炎活性物质为目标,基于课题组前期发现仙鹤草正丁醇提取部位具有较强的抗炎活性的基础上,从与急性炎症反应密切相关的COX和5-LO两条途径探讨其抗炎作用机制,进行抗炎作用药效及物质基础的研究。
1 材料与方法
1.1 实验动物 昆明种小鼠,SPF级(20±2)g,合格证号:SCXK(川)2020-030;SD大鼠(Sprague Dawley,SD),SPF级、雄性,(200±20)g,合格证号:SCXK(湘)2019-0004。
1.2 药物及试剂 仙鹤草(云南金发药业有限公司,批号为161102,经云南中医药大学张洁副教授鉴定);地塞米松(上海麦克林生化科技有限公司,批號为C10113013);二甲苯(天津化学试剂有限公司,批号为20150301);乙酸乙酯(天津市大茂化学试剂厂,批号为20190301);正丁醇、甲醇(天津市风船化学试剂科技有限公司,批号分别为20180830、20170502);色谱纯甲醇(美国SigmaAldrich公司,批号为I1082407013);色谱纯甲酸(美国Fisher公司,批号为20180901);槲皮素(中国食品药品鉴定所,批号为100081-201610);伊文思蓝、角叉菜胶、花生四烯酸(美国sigma公司,批号分别为MKCB2532V、SLBW8685、BSCV9532);地塞米松(大连美仑生物公司,批号为C11508350);COX-1、COX-2、Beta Actin Rabbit PolyAb、灵敏ECL化学发光检测试剂盒(美国Proteintech公司,批号分别为00058753、00100441、00102209、B21202109);PageRuler Prestained Protein Ladder(Thermo Fisher Scientific公司,批号为01031956);Anti-5 Lipoxygenase(英国abcam公司,批号为GR3313192-6);Goat Anti-Rabbit IgG(H+L)(Affinity公司,批号为56j9958);二硫苏糖醇(DTT)、乙酸钠、三羟甲基氨基甲烷(Tris)、过硫酸铵(APS)、10%SDS、四甲基乙二胺、甘氨酸、吐温-20(生工生物工程(上海)股份有限公司,批号分别为G717BA0007、CB23BA0025、G617BA0002、G603BA 1017、G731KA6476、0503SJ09、E811BA0001、G506BA 0005);十二烷基硫酸钠(SDS)(德国Biofroxx公司,批号为EZ6789B129);溴酚蓝(美国MP Biomedicals公司,批号为MR29664);30%丙烯酰胺、1M Tris-HCL缓冲液、1.5M Tris-HCL缓冲液、高效RIPA组织/细胞快速裂解液(Solarbio公司,批号分别为202111027、20211014、20211011、20210416);脱脂牛奶(美国BD公司,批号为7152571);PMSF(100mM)、BCA蛋白浓度测定试剂盒(碧云天生物技术研究所,批号分别为ST506-2、042820200814);TEMED(北京雷根生物技术有限公司,批号为0412A21);小鼠肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白三烯B4(LTB4)、前列腺素E2(PGE2)、白细胞介素10(IL-10)ELISA试剂盒(江苏酶免实业有限公司,批号均为202111)。
1.3 药物及试剂配置 地塞米松(20 mg/kg):称取地塞米松10 mg加入生理盐水2 mL,完全溶解后用生理盐水定容至20 mL,4 ℃保存。
角叉菜胶:角叉菜胶以生理盐水溶解,浓度为1%,4 ℃冰箱保存备用。
花生四烯酸:将规格为50 mg/支的AA加入浓度为100 mmol/L的Na2CO3溶液10 mL,混合均匀后AA的浓度为5 mg/mL,将其进行分装,保存于-20 ℃的冰箱中,实验当天稀释到1 mg/mL,采用的稀释溶液为100 mmol/L 的Na2CO3。
仙鹤草正丁醇提取部位(1 g/kg):称取仙鹤草正丁醇提取部位适量,用纯化水配置浓度为0.05 g/mL。
仙鹤草90%醇提取部位(0.25 g/kg):称取仙鹤草90%醇提取部适量,用双蒸水配置浓度为0.0125 g/mL。
仙鹤草60%醇提取部位(0.22 g/kg):称取仙鹤草60%醇提取部位适量,用双蒸水配置浓度为0.011 g/mL。
仙鹤草30%醇提取部位(0.07 g/kg):称取仙鹤草仙鹤草30%醇提取部位适量,用双蒸水配置浓度为0.0035 g/mL。
仙鹤草水洗脱部位(0.19 g/kg):称取仙鹤草水洗脱部位适量,用双蒸水配置浓度为0.0095 g/mL。
1.4 实验仪器 RE-501型旋转蒸发仪(山东博科科学仪器有限公司);SCIENTZ-18N型冷冻干燥机(宁波新芝生物科技股份有限公司);Victor Nivo 3S酶标仪(PE公司);1056034型足趾容积测量仪(北京众实迪创科技发展有限责任公司);Mini-PROTEAN Tetr小型垂直电泳槽、通用型电泳仪电源、小型湿转模块(美国伯乐公司);Tanon-5200Multi型凝胶成像分析系统(上海天能科技有限公司);1260 Infinity II型高效液相色谱仪(Agilent公司)。
1.5 实验方法
1.5.1 仙鹤草正丁醇不同提取部位的制备 取仙鹤草5 kg,以10倍量70%乙醇80℃水浴回流提取3次,第一次提取2 h,其余提取1.5 h,將3次提取液合并,用旋转蒸发仪浓缩回收乙醇,水浴挥发成膏状、冷冻干燥得到醇提取部位501.50 g;用水溶解,依次用等体积的乙酸乙酯、正丁醇萃取6次,得到水提取部位243.08 g,正丁醇提取部位124.52 g,乙酸乙酯提取部位126.02 g。
仙鹤草正丁醇提取部位(62.13 g)采用大孔树脂进行初步分离,分别采用纯化水、30%乙醇、60%乙醇、90%乙醇进行梯度洗脱并浓缩,分别得到得仙鹤草正丁醇提取部位水洗脱部位12.22 g,30%乙醇洗脱部位4.51 g,60%乙醇洗脱部位13.75 g,90%乙醇洗脱部位15.70 g。
1.5.2 仙鹤草正丁醇提取部位的抗炎作用研究
1.5.2.1 仙鹤草正丁醇提取部位对AA、角叉菜胶致大鼠足趾肿胀度的影响 取健康SD大鼠,将其随机分成8组,10只/组,依次是模型组(生理盐水组、Na2CO3溶液组、AA组、角叉菜胶组),地塞米松组、仙鹤草正丁醇提取部位(花生四烯酸)组,地塞米松组、仙鹤草正丁醇提取部位(角叉菜胶)组,灌胃给药2 h后,分别用浓度为0.1 mL的AA(1 mg/mL)或浓度为1%的角叉菜胶注射至大鼠足趾中致炎,以大鼠足趾肿胀体积(左后爪体积减右后爪体积)为炎症反应强度的评价指标;在注射后的1 h、2 h、3 h和4 h分别将大鼠鼠爪浸入装好纯化水的足趾容积测量仪中,为提高测量结果的精度,要保证大鼠鼠爪每次浸入液面的深度一致,待测量结束后,取被处死大鼠的足部组织称重备用。药物对鼠爪水肿的抑制率按下面公式计算[22-23]。
抑制率%=[(模型组鼠爪水肿体积-给药组鼠爪水肿体积)/模型组鼠爪水肿体积]×100%
1.5.2.2 蛋白免疫印迹法(Western Blot,WB)测定仙鹤草正丁醇提取部位大鼠足部组织中COX-1、COX-2、5-LO的含量 取2.2.1称重的SD大鼠足部组织,冰上剪碎、裂解、匀浆,4℃下14000 rpm/min离心5 min,上清液用BCA蛋白浓度试剂盒测定蛋白浓度;各组蛋白各15 μg用5%浓缩胶、8%分离胶电泳(70 V电泳30 min、110 V电泳5 0min),以200 mA、45 min将蛋白转至PVDF膜上,5%脱脂牛奶室温封闭1 h,一抗(COX-1 1∶500,COX-2 1∶1000,5-LO 1∶1000)4℃封闭过夜;二抗(Goat Anti-Rabbit 1∶3000)室温孵育1 h,灵敏ELC显色后成像;内参为beta Actin(1∶3000);采用Image J软件对进行图像处理。
1.5.3 仙鹤草正丁醇提取部位不同洗脱部位的抗炎活性筛选
1.5.3.1 仙鹤草正丁醇提取部位不同洗脱部位对二甲苯致小鼠耳肿胀的影响 选择健康昆明种小鼠,雌雄各半,20只/组,随机分为模型组、阳性药组(地塞米松,20 mg/kg)、仙鹤草组(水洗脱部位、30%乙醇洗脱部位、60%乙醇洗脱部位、90%乙醇洗脱部位)。给药1 h后,每只小鼠均立即用移液器精密吸取10 μL二甲苯,并将其均匀涂布于各鼠右耳的上、下两面,左耳不涂作自身对照;于涂耳30 min后,处死小鼠,将两耳沿耳廓基线剪下,于左右耳对称部位采用6 mm直径打孔器分别打下两耳耳片,用十万分之一分析天平称取耳片的质量,并计算小鼠鼠耳肿胀度,肿胀度=(右耳质量-左耳质量)/左耳质量×100%[24]。
1.5.3.2 仙鹤草正丁醇提取部位90%洗脱部位对AA、角叉菜胶致小鼠足趾肿胀的影响 选取健康昆明种小鼠,雌雄各半,随机分为8组,每组20只,分别为模型组(AA、角叉菜胶)、地塞米松组、仙鹤草正丁醇提取部位90%洗脱部位组,于灌胃给药30 min后分别用0.1 mL的AA(1 mg/mL)或1%角叉菜胶注射至小鼠足趾组织中致炎,用游标卡尺精确测定小鼠的足趾厚度,以小鼠足趾肿胀厚度作为炎症反应强度的评估指标,小鼠足趾肿胀厚度以左后爪厚度减右后爪厚度计算;注射后1 h、2 h、3 h和4 h各时间点用游标卡尺测定小鼠鼠爪足趾厚度,保持每次测量位置一致,待测量结束后处死小鼠,取血液待用。根据测量厚度的增加值,作为足趾肿胀度。药物对鼠爪水肿的抑制率按下面公式计算[22-24]。
抑制率(%)=(模型组鼠爪肿胀度-给药组鼠爪肿胀度)/模型组鼠爪肿胀度×100%
1.5.3.3 ELISA检测小鼠血液中PGE2、LTB4、TNF-a、IL-1β、IL-10的含量 各组小鼠在注射AA或角叉菜胶4h后,取血,使用超低温高速离心机在4℃下,以3000 r/min离心10 min,获取血浆上清液,向酶标板中依次加入标准蛋白样品、待测上清液和抗原,按试剂盒使用说明书步骤完成操作,测定OD值,根据OD值绘制标准蛋白标准曲线,按照标准曲线计算上清液中PGE2、LTB4、TNF-a、IL-1β和IL-10的含量[7]。
1.5.4 仙鹤草正丁醇提取部位90%乙醇洗脱部位的分离纯化 取90%乙醇洗脱部位(15.70 g),采用硅胶以干法上样进行分离,氯仿-甲醇梯度洗脱(50∶1至0∶100),经TLC检测,分为Fr.A、Fr.B、Fr.C、Fr.D四个分段。
Fr.A部分经氯仿-甲醇系统梯度洗脱(50∶1至0∶100),得到Fr.A-1和Fr.A-2。Fr.A-1依次采用硅胶以环己烷-乙酸乙酯(30∶1至1∶1)、葡聚糖凝胶LH-20以氯仿-甲醇(1∶1)反复洗脱,重结晶后得化合物1(0.5 mg)和化合物2(0.4 mg)。Fr.A-2经氯仿-甲醇系统梯度洗脱(50∶1至0∶100),分为Fr.A-2-1、Fr.A-2-2两部分,Fr.A-2-1经氯仿-甲醇(100∶1至0∶100)反复洗脱,分离纯化并重结晶得化合物3(0.7 mg);Fr.A-2-2经氯仿-甲醇系统梯度反复洗脱,分离纯化得化合物4(12 mg)和化合物5(8 mg)。
Fr.B部分经氯仿-甲醇系统梯度洗脱,分为Fr.B-1和Fr.B-2两部分。Fr.B-1经氯仿-甲醇系统梯度洗脱(50∶1至0∶100),葡聚糖凝胶LH-20(氯仿∶甲醇=1∶1)反复等度洗脱,分离纯化并重结晶得化合物6(6.3 mg)。
Fr.C部分经氯仿-甲醇系统反复梯度洗脱,分为Fr.C-1、Fr.C-2、Fr.C-3三部分。
Fr.D部分采用硅胶经氯仿-甲醇系统梯度洗脱(50∶1至0∶100),分为Fr.D-1、Fr.D-2、Fr.D-3三部分。Fr.D-1采用硅胶经氯仿-甲醇系统梯度洗脱(50∶1至0∶100),再用葡聚糖凝胶LH-20以50%甲醇-水反复洗脱,得化合物7(0.3 mg)。Fr.D-3部分采用硅胶经氯仿-甲醇系统梯度洗脱,再用葡聚糖凝胶LH-20以50%氯仿-甲醇反复等度洗脱,分离纯化得化合物8(4.1 mg)。
1.6 统计学方法
采用GraphPad prism软件进行统计分析,检测数据以均数±标准差(x?±s)表示,组间比较采用单因素方差分析,P<0.05 表示差异具有统计学意义。
2 实验结果
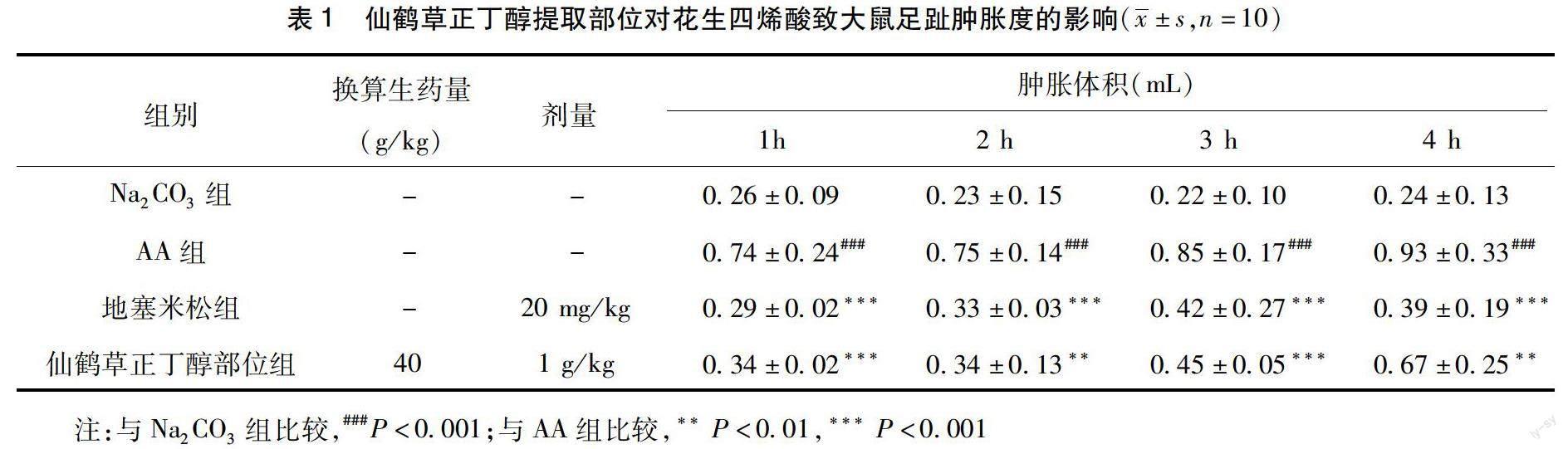
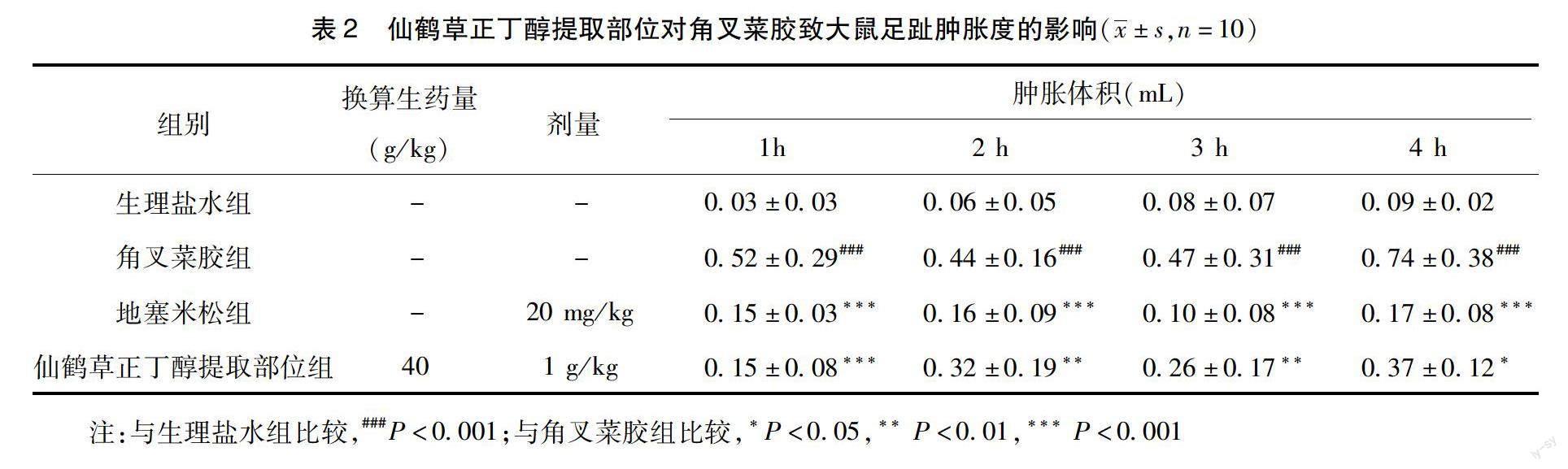
2.1 仙鹤草正丁醇提取部位对花生四烯酸、角叉菜胶致大鼠足趾肿胀度的影响 与AA组、角叉菜胶组比较,地塞米松组、仙鹤草正丁醇提取部位组能够抑制AA、角叉菜胶诱导的大鼠足趾肿胀度,差异有统计学意义(***P<0.001、**P<0.01或*P<0.05)。结果如表1和表2所示。
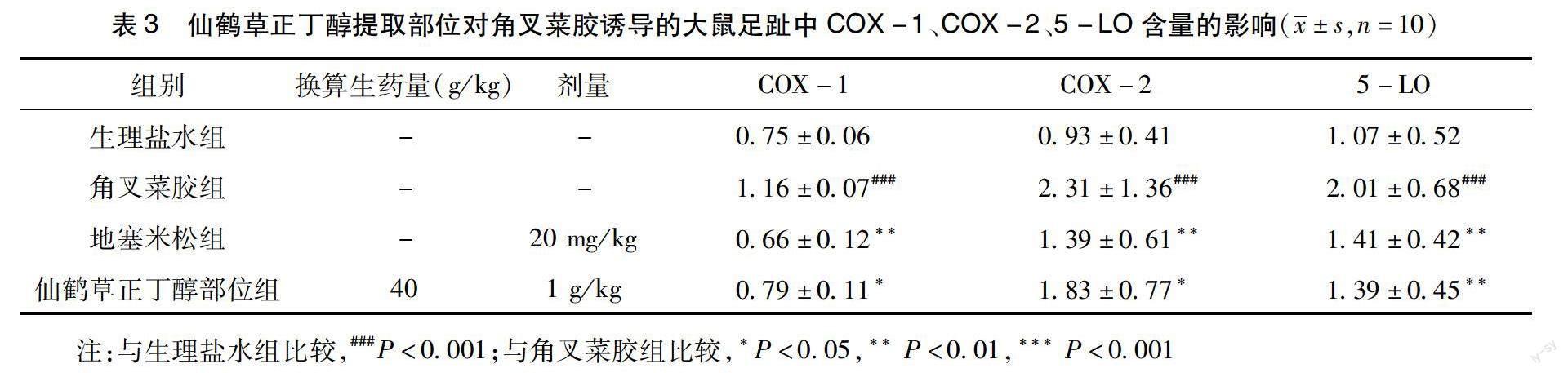
2.2 仙鹤草正丁醇提取部位对大鼠足部组织中COX-1、COX-2、5-LO含量的影响 与AA组、角叉菜胶组比较,地塞米松、仙鹤草正丁醇提取部位能够减少AA、角叉菜胶诱导的大鼠足趾组织中COX-1、COX-2、5-LO 的表达,差异有统计学意义(***P<0.001、**P<0.01或*P<0.05)。結果如表3和表4所示。
注:与Na2CO3组比较,###P<0.001;与AA组比较,**P<0.01
2.3 仙鹤草正丁醇提取部位不同洗脱部位对二甲苯致小鼠耳肿胀度的影响 与模型组比较,地塞米松对照组、仙鹤草90%乙醇洗脱部位组均能抑制小鼠耳肿胀度,差异有统计学意义(P<0.05)。如表5所示。
2.4 仙鹤草正丁醇提取部位90%洗脱部位对角叉菜胶、AA致小鼠足趾肿胀度的影响 与模型组比较,地塞米松、仙鹤草90%乙醇洗脱部位能抑制角叉菜胶、AA小鼠足趾肿胀度,差异有统计学意义(***P<0.001、**P<0.01或*P<0.05)。结果如表6和表7所示。
2.5 仙鹤草正丁醇提取部位90%洗脱部位对小鼠血液中 PGE2、LTB4、TNF-a、IL-1β、IL-10含量的影响 与模型组(角叉菜胶)比较,地塞米松组、仙鹤草90%乙醇洗脱部位组均能抑制角叉菜胶、AA所诱导的小鼠足趾肿胀模型中IL-1β、TNF-a、PGE2的含量,能显著升高IL-10水平,差异有统计学意义(***P<0.001、**P<0.01或*P<0.05);但90%乙醇洗脱部位对LTB4未见抑制作用,如表8所示。
2.6 仙鹤草正丁醇提取部位90%乙醇洗脱部位化合物的结构解析 对仙鹤草正丁醇提取部位90%乙醇洗脱部位的化学成分进行了分离,共分离得到8个化合物,采用薄层色谱法、高效液相色谱法、核磁共振技术对分离得到的化合物进行结构解析,共鉴定5个化合物,分别为β-谷甾醇(β-Sitosterol)、胡萝卜苷(Daucosterol)、科罗索酸(Corosolic acid)、槲皮素(3,3′,4′,5,7-Pentahy-droxyflavone)、芦丁[3,3′,4′,5,7-Pentahydroxy-flavon3-(o-rhamnosylglucoside)]。
化合物1为无色针状结晶,溶于甲醇,mp.136.7~ 136.9 ℃。化合物1与β-谷甾醇经三种TLC展开系统展开、10%硫酸-乙醇溶液显色,于105 ℃烘烤后呈现紫色斑点且Rf值一致。其薄层鉴别与对照品相同,确定为β-谷甾醇(β-Sitosterol)。
化合物2为白色粉末,溶于甲醇,mp.271.1~271.5℃。化合物2与胡萝卜苷经三种TLC展开系统展开、10%硫酸-乙醇溶液显色,于105 ℃烘烤后呈现紫色斑点且Rf值一致。其薄层鉴别与对照品相同,确定为胡萝卜苷(Daucosterol)。
化合物5为白色粉末,溶于甲醇,mp.233.2~234.5℃。10%硫酸-乙醇溶液显色,于105 ℃烘烤后呈现紫红色斑点。1H-NMR(500 MHz,MeOD)中δH1.183(s)、1.157(s)、1.116(s)、1.008(s)、0.960(s)、0.841(s)、0.800(s)七个甲基信号。13C-NMR(500 MHz,MeOD)中有30个碳信号,其中δC181.68提示C-28为羧酸,δC139.76(s)和126.67(d)为C-12(13)位形成双键,δC84.44(d)、69.49(d)提示C-3、C-2位被羟基取代且为3-β-OH、2-α-OH的反式取代模式,1H-NMR谱中δH5.22(1H,dt)、3.61(1H,d),也证实C-2、C-3位是反式羟基取代,故确定化合物5位为2-α,3-β-二羟基,C-12(13)双键,C-28位羧酸的熊果烷型三萜,δC48.26(C-1)、69.49(C-2)、84.44(C-3)、40.80(C-4)、56.65(C-5)、19.52(C-6)、34.21(C-7)、40.00(C-8)、48.10(C-9)、39.18(C-10)、24.43(C-11)、126.67(C-12)、139.76(C-13)、43.29(C-14)、29.15(C-15)、25.29(C-16)、48.10(C-17)、54.34(C-18)、40.40(C-19)、40.49(C-20)、31.76(C-21)、38.09(C-22)、29.31(C-23)、17.80(C-24)、17.20(C-25)、17.63(C-26)、24.08(C-27)、181.68(C-28)、17.50(C-29)、21.56(C-30),经上所述,鉴定为科罗索酸(Corosolic acid),波谱数据与文献[25-27]数据相符合。
化合物6为黄色粉末,溶于甲醇。化合物6与槲皮素对照品经三种TLC展开系统展开、10%硫酸-乙醇溶液显色,于105℃烘烤后呈现黄色斑点且Rf值一致。精密称定槲皮素对照品,甲醇溶解、0.45 μL微孔过滤制成0.533 mg/mL的槲皮素溶液;精密称定化合物6,甲醇溶解、0.45 μL微孔过滤制成每1 mL含0.551 mg的化合物6溶液;采用Agilent Poroshell 120 C18柱(150 mm×6 mm,4 μm)、VWD檢测器进行HPLC比对,以1.0%甲酸-甲醇(85∶15)为流动相、1.0 mL/min的流速等度洗脱,于375 nm波长处检测,其出峰时间、保留时间吻合。其薄层鉴别和HPLC与对照品相同,确定为槲皮素(3,3′,4′,5,7-Pentahy-droxyflavone)。
化合物8为淡黄色粉末,溶于甲醇。化合物8与芦丁对照品经三种TLC展开系统展开、10%硫酸-乙醇溶液显色,于105 ℃烘烤后呈现黄色斑点且Rf值一致。精密称定芦丁对照品,用甲醇溶解,配成0.495 mg/mL的芦丁溶液,摇匀,0.45 μL微孔滤膜过滤,得对照品溶液;精密称定化合物8,甲醇溶解、0.45 μL微孔过滤制成0.501 mg/mL的化合物8溶液;采用Agilent Poroshell 120 C18柱(150 mm×6 mm,4μm)、VWD检测器进行HPLC比对,以1.0%甲酸-甲醇(40∶60)为流动相、1.0mL/min的流速等度洗脱,于320 nm波长处检测,其出峰时间、保留时间吻合;薄层鉴别和HPLC与对照品相同,确定为芦丁[3,3′,4′,5,7-Pentahydroxy-flavon3-(o-rhamnosylglucoside)]。
3 讨论
AA为含二十个碳的不饱和脂肪酸,存在于细胞膜磷脂分子中,当机体受到致炎因子刺激时,机体的细胞膜磷脂会被磷脂酶A2(PhospholipaseA2,PLA2)催化而释放AA,AA会通过以下两种代谢途径启动急性炎症反应:一是通过COX的催化生成PGs,PGs会使血管扩张、增加毛细血管的通透性,从而引起急性炎症;二是通过5-LO催化AA生成LTs;LTs中LTB4作用最强,介导白细胞激活和炎症细胞的迁移,并释放活性氧自由基和溶酶体酶,进而加重炎症反应、引起组织损伤、导致局部组织水肿等[28-32]。AA和角叉菜胶是常用的炎症诱导剂,分别通过AA代谢的5-LO途径和COX途诱导炎症反应[33-34]。在各类炎症进程中,还可见白细胞介素1(Interleukin-1,IL-1)、TNF-a等致炎因子表达升高等,促进抗炎因子IL-10的表达升高;IL-10可抑制单核细胞表面主要组织相容性抗原Ⅱ(ClassⅡmajor histocompatibilitycomplex,MHCⅡ)的表达,抗原呈递作用降低,T淋巴细胞活性减弱,炎性细胞的激活、迁移和粘附及炎症因子的合成与释放均受到抑制[35-37]。
课题前期研究表明,仙鹤草抗炎活性成分主要集中在其正丁醇提取部位,为进一步定位其抗炎活性的物质基础,本部分对正丁醇提取部位进行初步的抗炎机制进行研究,研究结果显示,仙鹤草正丁醇提取部位能够抑制AA和角叉菜胶诱导的大叔足趾肿胀体积,能够降低COX-1、COX-2、5-LO的含量,提示仙鹤草正丁醇提取部位对两条炎症途径均有抑制作用,故采用D101大孔树脂对仙鹤草正丁醇提取部位进行分离,分别得到仙鹤草的水洗脱部位、30%乙醇洗脱部位、60%乙醇洗脱部位和90%乙醇洗脱部位,对上述四个部位采用二甲苯致小鼠耳肿胀模型筛选仙鹤草正丁醇提取部位的抗炎有效部位。结果显示,仙鹤草90%乙醇洗脱部位能抑制小鼠耳肿胀度,提示仙鹤草90%醇洗脱部位可能是仙鹤草正丁醇的抗炎作用的有效部位。因此本部分采用角叉菜胶、AA致小鼠足趾肿胀模型对仙鹤草正丁醇提取部位90%洗脱部位的抗炎活性进行筛选,并测定小鼠血液中PGE2、TLB4、TNF-a、IL-1β、IL-10的水平。结果显示,仙鹤草90%乙醇洗脱部位能抑制小鼠足趾肿胀度;能显著降低小鼠血液中PGE2、TNF-a、IL-1β的表达,升高抗炎因子IL-10的表达,但对TLB4无影响;提示仙鹤草正丁醇提取部位90%醇洗脱部位可抑制COX途径从而降低PGE2的表达,降低致炎因子TNF-a、IL-1β的表达,升高抗炎因子IL-10的表达,而发挥抗炎作用;但对5-LO途径的LTB4未见明显抑制作用。
结合药理实验研究发现,仙鹤草是由多组分协同而发挥抗炎作用,其正丁醇提取部位可同时抑制COX和5-LO途径而发挥抗炎作用;但仙鹤草正丁醇提取部位的90%乙醇洗脱部位主要通过抑制COX途径实现抗炎;表明在对仙鹤草正丁醇提取部位进行组分初分离时,存在具有抗炎活性的组分不在90%洗脱部位,可能与仙鹤草正丁醇提取部位经D101大孔树脂洗脱后,抑制5-LO途径的成分未富集于某一洗脱部位,而导致未显现出对5-LO途径的抑制作用。对仙鹤草正丁醇提取部位90%乙醇洗脱部位进行成分分离并鉴定后,发现仙鹤草正丁醇提取部位90%乙醇洗脱部位含有已被广泛报道具有抗炎活性的科罗索酸、槲皮素和芦丁,表明仙鹤草正丁醇提取部位90%乙醇洗脱部位是由多种化合物共同发挥抗炎作用。
4 小结
仙鹤草正丁醇提取部位可抑制COX和5-LO途径实现抗炎,而仙鹤草正丁醇提取部位的90%醇洗脱部位可抑制COX途径从而减少PGE2的合成,降低TNF-a、IL-1β的表达,升高IL-10的表达,而发挥抗炎作用,但对5-LO途径合成的LTB4未见明显抑制作用。
参考文献:
[1]Yang Luting,Xia Haibin.TRIM Proteins in Inflammation:from Expression to Emerging Regulatory Mechanisms.[J].Inflammation,2021,44:811-820.
[2]Wang Shuxia,Cao Meng,Xu Shuhang,et al.Luteolin Alters Macrophage Polarization to Inhibit Inflammation.[J].Inflammation,2020,43:95-108.
[3]Mikulec CD,Rundhaug J E,Simper M S,et al.The Chemopreventive Efficacies of Nonsteroidal Anti-inflammatory Drugs:The Relationship of Short-term Biomarkers to Long-term Skin Tumor Outcome[J].Cancer Prevention Research,2013,6(7):675-685.
[4]Wang F,Wang H,Liu X,et al.Neuregulin-1 alleviate oxidative stress and mitigate inflammation by suppressing NOX4 and NLRP3/caspase-1 in myocardial ischaemia-reperfusion injury.Journal of Cellular and Molecular Medicine,2021,25(3):1783-1795.
[5]Liu Xianzhi,Wang Lifu,Tan Siwei,et al.Therapeutic Effects of Berberine on Liver Fibrosis are associated With Lipid Metabolism and Intestinal Flora[J].Front Pharmacol,2022,13:814871.
[6]Kigera James W M,Gichangi Peter B,Abdelmalek Adel K M,et al.Age related effects of selective and non-selective COX-2 inhibitors on bone healing.[J].J Clin Orthop Trauma,2022,25:101763.
[7]劉莹,王振洲,李平亚,等.天然药物抗炎成分及作用机制的研究进展[J].特产研究,2017,39(1):69-76.
[8]Kb A,Schmidt A M.Recategorization of Non-Aspirin Nonsteroidal Anti-inflammatory Drugs According to Clinical Relevance:Abandoning the Traditional NSAID Terminology[J].Canadian Journal of Cardiology,2021,37(11):1705-1707.
[9]王金云,張铁松,马帅茹,等.应用塞来昔布减轻唑来膦酸不良反应的临床效果观察[J].感染、炎症、修复,2017,18(4):234-235.
[10]李立新.临床应用阿司匹林致不良反应的分析[J].中西医结合心血管病电子杂志,2018,6(33):183-187.
[11]李伟,赵姝丽.糖皮质激素药理作用及在临床应用过程中的不良反应分析[J].基层医学论坛,2017,21(20):2618-2619.
[12]胡朋月,李永平.仙鹤草液治疗滴虫性阴道炎110例疗效观察[J].佳木斯医学院学报,1996(4):82.
[13]Karlińska Elz·bieta,Romanowska Beata,Kosmala Monika.Agrimonia proceraThe Aerial Parts of Wallr.and L.as a Source of Polyphenols,and Especially Agrimoniin and Flavonoids.[J].Molecules,2021,26(24):7706-7711.
[14]廖敦,黎兰芳.仙鹤草在治疗慢性非细菌性前列腺炎中对卵磷脂小体水平的影响[J].光明中医,2009,24(7):1252-1253.
[15]Kozykeyeva Raushan A,Datkhayev Ubaidilla M,Srivedavyasasri Radhakrishnan,et al.Agrimonia asiaticaIsolation of Chemical Compounds and Essential Oil from Juz.and Their Antimicrobial and Antiplasmodial Activities.[J].ScientificWorldJournal,2020,1-8.
[16]Zhang Jia,Yang Ya-Nan,Jiang Jian-Shuang,et al.New dimeric phloroglucinol derivatives from Agrimonia pilosa and their hepatoprotective activities.[J].Bioorg Chem,2021,116(1):105341-105348.
[17]李俊,王应仙,李家生,等.复方仙鹤草肠炎胶囊的主要有效成分及其治疗肠炎靶点的筛选[J].中国药房,2021,32(8):927-932.
[18]常慧芳.黄芪仙鹤草汤治疗溃疡性结肠炎的临床特点及疗效观察[J].世界最新医学信息文摘,2016,16(51):156-157.
[19]赵功明,冯炀,曹志群.曹志群教授用仙鹤草鹿角霜治疗溃疡性结肠炎的经验[J].世界最新医学信息文摘,2018,18(38):211+214.
[20]陈广文,李建锋,刘礼剑,等.胃病Ⅲ号方组方思路及防治慢性胃炎机理探讨[J].辽宁中医杂志,2018,45(11):2286-2288.
[21]Kojima T,Hirose G,Komatsu Shuuhei,et al.Development of anti-glomerular basement membrane glomerulonephritis during the course of IgA nephropathy:a case report.[J].BMC Nephrol,2019,20(1):25-32.
[22]丘琴,刘玉雯,甄汉深,等.龙利叶抗炎活性部位筛选及其作用机制的研究[J].中华中医药学刊,2020,38(4):37-42.
[23]李晓春,王莉芳,樊宝娟,等.金线草抗炎作用研究[J].江西中医药,2018,49(6):71-73.
[24]谷捷,李鑫,余黄合,等.二甲苯致小鼠耳肿胀急性炎症模型的建立[J].湖南中医药大学学报,2016,36(5):32-35.
[25]Kim DH,Han KM,Chung IS,et al.Triterpenoids from the flower of Campsis grandiflora K.Schum.as human acyl-CoA:cholesterol acyltransferase inhibitors[J].Arch Pharm Res,2005,28(5):550-556.
[26]Thuong PT,Jin W,Lee J,et al.Inhibitory effect on TNF-alpha-induced IL-8 production in the HT29 cell of constituents from the leaf and stem of Weigela subsessilis[J].Arch Pharm Res,2005,28(10):1135-1141.
[27]吕寒,陈剑,李维林,等.枇杷叶中三萜类化学成分的研究[J].中药材,2008(9):1351-1354.
[28]孟庆婷,朱自仙,杨艳,等.仙鹤草不同提取部位的抗炎作用研究[J].云南中医中药杂志,2020,41(1):64-66.
[29]Perkins TN,OczypokE,Dutz R,et al.The Receptor for Advanced Glycation Endproducts Is a Critical Mediator of Type 2 Cytokine Signal Transduction in the Lungs[J].The Journal of Allergy and Clinical Immunology,2019:305-306.
[30]王羽茜,李成檀,王艳芳,等.抗白三烯药物调控炎症反应在中枢和外周疾病中的作用[J].健康研究,2018,38(4):419-422.
[31]敖桂珍,吉念宁,张奕华,等.环氧酶/5-脂氧酶双重抑制剂的定量构效关系研究[J].计算机与应用化学,2003(Z1):6-8.
[32]Zhou Y,Wei E Q,Fang S H,et al.Spatio-temporal properties of 5-lipoxygenase expression and activation in the brain after focal cerebral ischemia in rats[J].Life sci,2006,79(17):1645-1656.
[33]劉珊珊,向彬,郭营营,等.天麻成分对羟基苯甲醛抗炎作用及机制研究[J].中国民族民间医药,2016,25(9):16-17+19.
[34]Sun Qian-Yi,Zhou Hong-Hao,Mao Xiao-Yuan.Emerging Roles of 5-Lipoxygenase Phosphorylation in Inflammation and Cell Death.[J].Oxid Med Cell Longev,2019,9(1):2749173-2749183.
[35]L Ferrero-Miliani,O H Nielsen,P S Andersen,et al.Chronic inflammation:importance of NOD2 and NALP3 in interleukin-1β generation[J].2007,147(2):227-235.
[36]孙明利,王兴河,黄俊,等.恶性肿瘤和炎症性疾病住院患者静脉血栓栓塞症危险因素对比分析[J].中华肿瘤防治杂志,2019,26(2):118-121.
[37]Perkins Timothy N,Oczypok Elizabeth A,Dutz Regina E,et al.The receptor for advanced glycation end products is a critical mediator of type 2 cytokine signaling in the lungs[J].J Allergy Clin Immunol,2019,144(3):796-808.
(收稿日期:2022-07-28)

