达格列净预处理对对比剂肾病大鼠炎症反应及肾小管上皮细胞凋亡的影响▲
李依阳 邝日禹 张 涛 苏晓琳 雷玲艳 覃 凯 谭妍妍
(1 广西壮族自治区民族医院心血管内科,广西南宁市 530001; 2 中国人民解放军联勤保障部队第923医院神经内科,广西南宁市 530021)
对比剂肾病(contrast-induced nephropathy,CIN)是由对比剂引起的急性肾损伤,即应用对比剂后新发生的肾功能障碍或者原有肾功能障碍加重[1],其发病机制涉及对比剂的直接毒性作用、肾脏灌注改变、细胞凋亡、氧化应激、炎症反应等[2]。CIN是冠心病介入治疗的常见并发症,其在高风险人群(如糖尿病、慢性心力衰竭、慢性肾损害、老年)中的发生率可高达 20%~30%[3],是继低容量继发性肾病、药物性肾损伤后的第三大医源性肾病[4]。CIN一般在使用对比剂后24~48 h内发生,目前针对预防CIN的药物研究主要集中在N-乙酰半胱氨酸、抗氧化剂、前列腺素E1、腺苷受体抑制剂、低剂量多巴胺、钙拮抗剂等,但是尚无明确的证据支持这些药物的治疗效果和有效剂量[5],如何有效防治CIN是亟待解决的重要问题。 达格列净属于钠-葡萄糖共转运蛋白2抑制剂,能有效地抑制肾小管钠-葡萄糖共转运蛋白2受体,非胰岛素依赖性地降低血糖水平。除了降低血糖水平,其还可以通过抗感染、抗氧化应激、改善线粒体功能、调节自噬等途径降低心血管事件的发生风险,并具有良好的肾脏保护作用[6-7]。但达格列净对对比剂相关急性肾损伤的作用尚不清楚。本研究前期预实验表明达格列净可以改善CIN大鼠模型的肾功能,本研究主要分析达格列净预处理对CIN大鼠炎症因子及肾小管上皮细胞凋亡的影响,以探讨其改善CIN大鼠肾功能的可能机制。
1 材料与方法
1.1 实验动物 18只无特定病原体级SD雄性大鼠,体重180~220 g,6~8周龄,由斯贝福(北京)生物技术有限公司提供[许可证号:SCXK(京)2019-0010]。动物饲养环境温度为20 ℃~25 ℃,湿度为40%~60%,自由进食饮水。12 h光暗循环。
1.2 药物、仪器与试剂
1.2.1 药物:达格列净(AstraZeneca公司,批号:LP2385),吲哚美辛、左旋硝基精氨酸甲酯(上海麦克林生化科技股份有限公司,批号:c13012144、c11022979),碘海醇注射液(拜耳医药保健有限公司广州分公司,批号:KT6A7S)。
1.2.2 主要试剂:白细胞介素(interleukin,IL)-1β ELISA试剂盒(杭州联科生物技术股份有限公司,批号:A201B11115),髓过氧化物酶(myeloperoxidase,MPO)测定试剂盒(南京建成生物工程研究所,批号:20211123),TUNEL试剂盒(上海碧云天生物技术有限公司,批号:101322230120),DAPI染色液(武汉博士德生物工程有限公司,批号:18c20b77),核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)抗体(Abcam公司,批号:GR3369573-8),cleaved Caspase-3、Caspase-3抗体(Novus Biologicals公司,批号:G-2),β-actin抗体(Affinity BioReagents公司,批号:54O2802),山羊抗鼠二抗、荧光二抗(北京中杉金桥生物技术有限公司,批号:220030406、201811125),ECL试剂盒(Affinity BioReagents公司,批号:7525a27)。
1.2.3 主要仪器:Multiskan Sky型全波长酶标仪(Thermo Fisher Scientific公司),UC90型奥林巴斯成像系统(OLYMPUS公司),BX43型荧光显微镜( OLYMPUS公司),半干转膜仪(ATTO公司),电泳仪(北京六一生物科技有限公司),FluorChem R型多功能成像分析系统(ProteinSimple公司),DS-11 型超微量紫外可见分光光度计(Denovix公司)。
1.3 分组、CIN大鼠模型的建立及干预方法 采用随机数字表法将大鼠分为正常组、模型组、达格列净组,每组6只。在各组大鼠禁水24 h、禁食过夜后,给予模型组、达格列净组尾静脉注射吲哚美辛10 mg/kg(将吲哚美辛溶于二甲基亚砜制成浓度为10 mg/mL的溶液,再用1.25%的碳酸氢钠将其稀释10倍,注射剂量为10 mL/kg),15 min 后尾静脉注射左旋硝基精氨酸甲酯10 mg/kg(将左旋硝基精氨酸甲酯溶于生理盐水,注射剂量为10 mL/kg),15 min 后尾静脉注射碘海醇注射液(1 600 mg/kg)[1],给予正常组尾静脉注射生理盐水(10 mL/kg)3次,每次间隔15 min。血肌酐水平在对比剂暴露后24~48 h增加≥25%或较其基础值升高≥0.5 mg/dL[8-9],则提示造模成功。本研究的模型组、达格列净组大鼠均造模成功。于造模前2 h,给予达格列净组大鼠灌胃达格列净1 mg/kg(生理盐水溶解,给药体积为10 mL/kg),给予正常组、模型组灌胃生理盐水10 mL/kg。
1.4 标本采集 造模后24 h,通过腹腔内注射10%水合氯醛(10 mL/kg)麻醉各组大鼠,将其仰卧固定,开腹后经腹主动脉取血5 mL,待血凝固后在4 ℃下以3 500 r/min离心10 min制备血清。采血后将大鼠冰浴并迅速取出两侧肾脏,一侧用10%福尔马林固定,另一侧用滤纸吸干水分后置于-80 ℃冰箱保存待用。
1.5 血清IL-1β含量及肾组织MPO含量的检测 按ELISA试剂盒说明书步骤检测大鼠血清IL-1β含量。取部分冻存的肾脏组织,按照试剂盒说明书步骤制备肾组织匀浆,检测大鼠肾脏组织MPO含量。
1.6 肾小管上皮细胞凋亡率的检测 将用10%福尔马林固定的肾脏组织依次进行脱水、石蜡包埋、切片、脱蜡至水,按TUNEL试剂盒说明书步骤进行操作,然后在荧光显微镜下观察并拍照,呈绿色的细胞为凋亡阳性细胞,随机选取3个视野(×200),以肾小管上皮凋亡阳性细胞与总细胞数的比值作为肾小管上皮细胞凋亡率。
1.7 肾脏组织NLRP3表达水平的检测 将用10%福尔马林固定的肾脏组织依次进行脱水、石蜡包埋、切片、脱蜡至水,抗原热修复,封闭,孵育NLRP3抗体(稀释比例为1 ∶120,4 ℃孵育过夜)、荧光二抗(稀释比例为1 ∶200,37 ℃孵育30 min),DAPI 染核,封片。在荧光显微镜下观察并照相,使用Image J 软件分析并计算平均光密度值。
1.8 肾脏组织cleaved Caspase-3、Caspase-3蛋白表达水平的检测 取部分冻存的肾脏组织,将肾脏组织称重后加入适量RIPA裂解液,于冰上研磨,4 ℃下以12 000 r/min离心10 min后取上清液,使用超微量紫外可见分光光度计测定蛋白浓度。取适量蛋白样品配成上样缓冲液并加热变性,经10%SDS-PAGE分离蛋白样品并转至PVDF膜,用5%脱脂牛奶封闭后分别放入cleaved Caspase-3(稀释比例为1 ∶2 000)、Caspase-3(稀释比例为1 ∶2 000)和β-actin一抗(稀释比例为1 ∶3 000)工作液中4 ℃反应过夜,将洗涤后的一抗反应膜放入山羊抗鼠二抗(稀释比例为1 ∶3 000)工作液中孵育90 min,洗膜,经ECL液曝光显影,用Image J软件分析各组样品的光密度值,以目的蛋白光密度值/内参蛋白光密度值作为目的蛋白的相对表达水平,然后计算cleaved Caspase-3蛋白表达水平与Caspase-3蛋白表达水平的比值(以下简称cleaved Caspase-3与Caspase-3比值)。
1.9 统计学分析 应用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 3组大鼠血清IL-1β含量和肾脏组织MPO含量的比较 模型组和达格列净组大鼠的血清IL-1β含量均较正常组升高,而达格列净组大鼠的血清IL-1β含量较模型组降低(均P<0.05)。3组大鼠肾脏组织的MPO含量差异无统计学意义(P>0.05)。见表1。
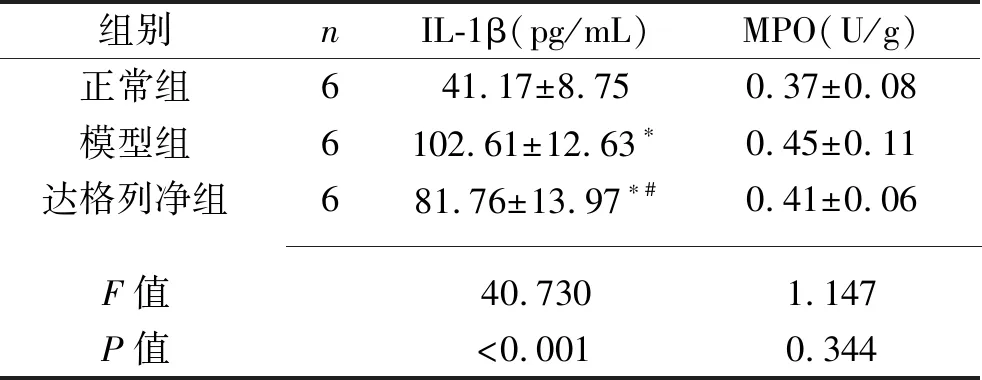
表1 3组大鼠血清IL-1β含量和肾脏组织MPO含量的比较(x±s)
2.2 3组大鼠肾小管上皮细胞凋亡率的比较 模型组和达格列净组大鼠肾小管上皮细胞凋亡率均较正常组升高,而达格列净组大鼠肾小管上皮细胞凋亡率较模型组降低(均P<0.05)。见图1、表2。
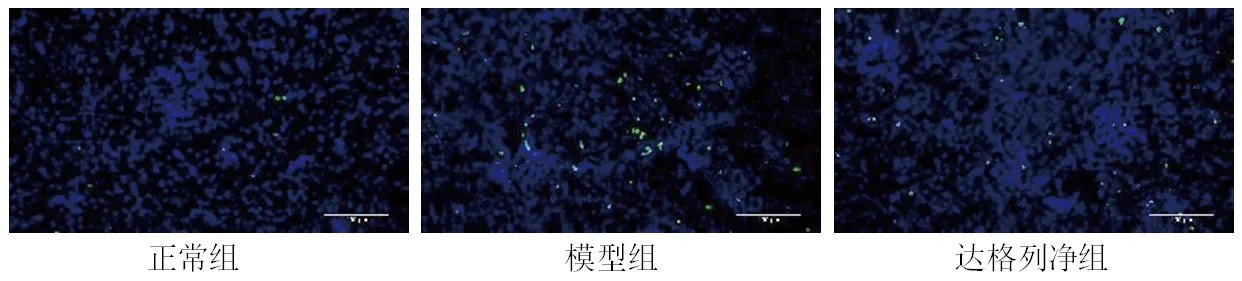
图1 3组大鼠肾小管上皮细胞凋亡情况(TUNEL染色,×200)
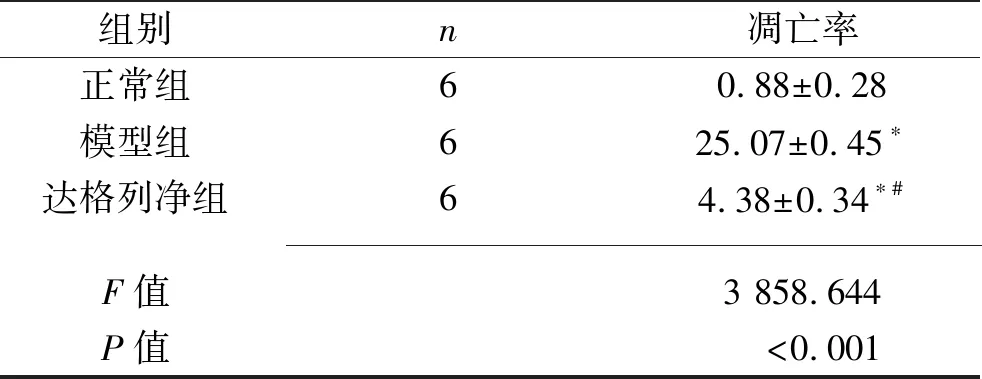
表2 3组大鼠肾小管上皮细胞凋亡率的比较(x±s,%)
2.3 3组大鼠肾脏组织NLRP3表达水平的比较 模型组和达格列净组大鼠肾脏组织的NLRP3表达水平均较正常组升高,而达格列净组大鼠肾脏组织的NLRP3表达水平较模型组降低(均P<0.05)。见图2、表3。
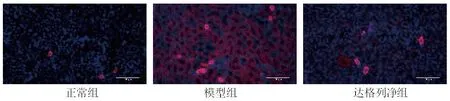
图2 3组大鼠肾脏组织NLRP3表达情况(免疫荧光染色,×200)

表3 3组大鼠肾脏组织NLRP3表达水平的比较(x±s)
2.4 3组大鼠肾脏组织cleaved Caspase-3与Caspase-3比值的比较 模型组和达格列净组大鼠肾脏组织的cleaved Caspase-3与Caspase-3比值均较正常组升高,达格列净组大鼠肾脏组织的cleaved Caspase-3与Caspase-3比值较模型组降低(均P<0.05)。见图3、表4。
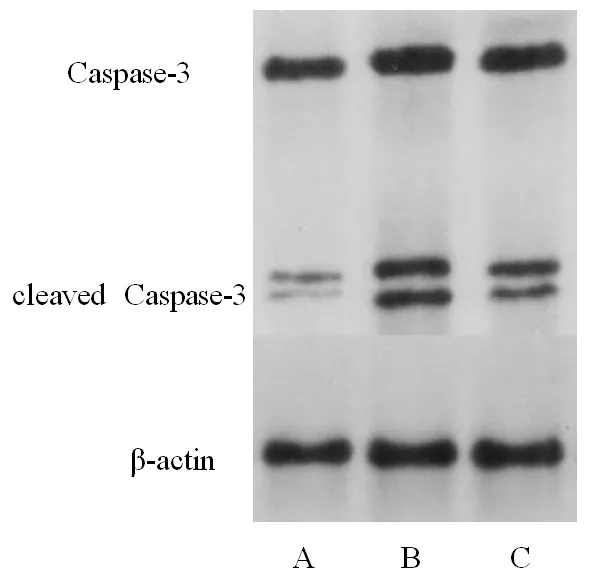
图3 4组大鼠肾脏组织cleaved Caspase-3、Caspase-3表达情况
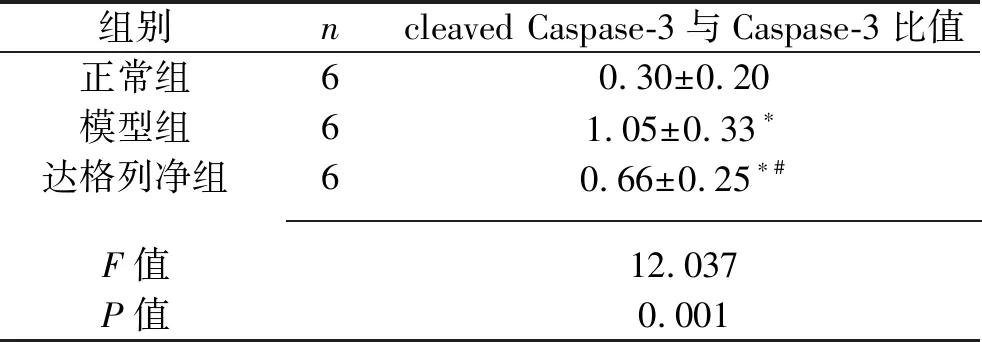
表4 3组大鼠肾脏组织cleaved Caspase-3与Caspase-3比值的比较(x±s)
3 讨 论
CIN的病理生理学较为复杂,炎症反应是CIN病理机制的重要组成部分,炎症反应可能发生在最初的低氧和活性氧簇介导的肾脏损伤之后,形成炎症、血管损伤和缺氧的正反馈循环[5,10]。IL-1β是IL-1家族的重要成员,在局部和全身均能发挥作用,可在外周血中检测到[11]。有学者发现,对比剂诱导急性肾损伤发生时炎症细胞因子IL-1β的表达水平明显升高[5,12]。因此,检测IL-1β的表达水平既可以发现早期肾脏炎性损伤,又可以预估肾脏损伤进展,对评估急性肾损伤具有重要意义[13]。本研究结果显示,CIN大鼠血清IL-1β含量升高,提示CIN大鼠体内存在炎症反应;给予达格列净预处理后大鼠血清IL-1β含量降低,表明达格列净可降低IL-1β表达从而减轻损伤组织的炎症反应。MPO是一种催化过氧化物还原的酶,是中性粒细胞和单核细胞氧依赖性杀菌系统的重要组分,MPO水平与中性粒细胞激活程度具有相关性[14]。本研究中,CIN大鼠肾脏组织MPO含量有增高趋势,但与其他两组的差异无统计学意义,可能与样本量较小有关。
炎性小体是自身免疫和无菌性炎症反应中的核心成员,在感知炎症引起的初始损伤后,自动链接机体内的炎症反应通路[15-16]。NLRP3炎性小体的激活是各种炎症产生的关键环节,各种细菌毒素、环境或细胞内危险信号均可触发NLRP3炎性小体信号通路。NLRP3被激活后发生寡聚化,招募凋亡相关斑点样蛋白,该蛋白再与Caspase-1前体结合并诱导其自身裂解为成熟的Caspase-1后,组成一个可催化IL-1β、IL-18成熟的平台,即炎性小体[17]。本研究结果提示,CIN大鼠肾脏组织的NLRP3表达增多,而达格列净可抑制NLRP3的表达,表明达格列净预处理可能通过抑制NLRP3炎性小体通路的活性来减轻CIN大鼠的炎症反应。
对比剂所造成的肾小管上皮细胞过度凋亡是CIN发生的中心环节之一[18]。本研究通过TUNEL免疫荧光染色法检测大鼠的肾小管上皮细胞凋亡率,结果显示CIN大鼠肾小管上皮细胞凋亡率升高,提示对比剂可促进肾小管上皮细胞凋亡;而给予达格列净干预后大鼠的肾小管上皮细胞凋亡率下降,提示达格列净预处理对减轻对比剂引起的肾小管上皮细胞凋亡有积极的作用。
细胞凋亡是受基因控制的细胞自发性死亡。虽然细胞凋亡的途径各不相同,但最终都会由Caspase家族介导的级联反应来执行最后的凋亡过程。Caspase-3位于凋亡级联反应下游,是细胞凋亡过程中关键的执行因子[19],当细胞受到各种不同凋亡因素刺激时,通过多个途径均能够激活反应下游的Caspase-3从而引起细胞凋亡,Caspase-3活化后细胞凋亡的结局将不可逆转。研究证实,在CIN模型大鼠中,肾脏组织Caspase-3蛋白表达上调、活化明显增强,细胞凋亡明显增加[17]。本研究结果显示,CIN大鼠肾脏组织的cleaved Caspase-3与Caspase-3比值升高,说明CIN发生后Caspase-3活化增强导致细胞凋亡增加;而使用达格列净预处理可降低cleaved Caspase-3与Caspase-3比值,说明达格列净可能通过抑制Caspase-3活化从而减少肾小管上皮细胞凋亡。
综上所述,达格列净预处理可能通过抑制NLRP3炎性小体通路的活性和炎症因子的表达来减轻CIN大鼠的炎症反应,并通过抑制Caspase-3活化来减少肾小管上皮细胞凋亡,进而发挥肾脏保护作用。

