粉防己碱调节Nrf2/HO-1/NLRP3信号通路对抑郁症大鼠神经元损伤的影响
邱雪,赵雯婧,王飞燕,李蓉,何宗岭,姚刚
抑郁症是一种常见的精神障碍疾病,其病因复杂,患者主要表现为情绪低落、思维迟缓、快感缺失、易怒喜哭等症状,具有持久或者反复发作的特点,严重时会出现自杀倾向和自杀行为,严重威胁患者的身体健康和生活质量[1-2]。抑郁症的发病率随着人们生活和工作压力的增大在逐渐升高,据统计,抑郁症患者人数在2005—2015年增加了18.4%,将在2030年成为全球第二大疾病[3]。目前已有的抗抑郁症药物治疗效果有限,不能治愈难治性抑郁症患者,因此,积极开发新的安全有效的治疗抑郁症的药物有重要意义[4]。粉防己碱(tetrandrine,Tet)是从粉防己根中分离出来的一种双苄基异喹啉类生物碱,具有抗炎、抗肿瘤、抑制纤维化、镇痛等多种生理活性[5]。Gao等[6]研究发现,Tet可以通过增加抑郁大鼠体质量、1%蔗糖消耗量和脑源性神经营养因子水平,在抑郁大鼠模型中发挥抗抑郁的作用。Sheng等[7]同样发现,Tet具有缓解、治疗抑郁症的作用。近年来,Nrf2/HO-1/NLRP3通路成为抑郁症研究的热点。一项研究发现,二氢硫辛酸通过Nrf2/HO-1/NLRP3通路对脂多糖诱导的抑郁大鼠具有预防作用[8]。Tao等[9]同样发现,厚朴酚通过调控Nrf2/HO-1/NLRP3信号通路,使小胶质细胞向M2表型极化,从而减弱小鼠抑郁行为。但Tet能否通过调节Nrf2/HO-1/NLRP3信号通路改善抑郁症大鼠神经元损伤,尚不清楚。因此,本研究旨在探讨Tet对抑郁症大鼠神经元损伤的影响及其可能的作用机制,以期为临床治疗抑郁症提供一定的参考价值,报道如下。
1 材料与方法
1.1 实验材料 (1)实验动物:SPF级SD大鼠购自长沙市天勤生物技术有限公司[生产许可编号:SCXK(湘)2019-0014],8~10周龄,体质量180~200 g,饲养温度22 ℃,湿度55%~60%,12 h光暗循环,每小时通风8~12次。不禁食水。(2)主要试剂:Tet、蛋白提取试剂盒购于北京伊塔生物科技有限公司;皮质酮购于上海凛恩科技发展有限公司;ML385 Nrf2/HO-1/NLRP3通路抑制剂购于上海一研生物科技有限公司;HE染色试剂盒、Nissl染色试剂盒购于北京索莱宝科技有限公司;活性氧试剂盒(ROS)购于上海烜雅生物科技有限公司;过氧化氢酶试剂盒(CAT)、丙二醛(MDA)、白介素-6和白介素-β(IL-6,IL-β)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒购于武汉伊莱瑞特生物科技股份有限公司;兔抗凋亡相关斑点样蛋白(ASC)、半胱氨酸蛋白酶-1(caspase-1)、Nrf2、HO-1、3-磷酸甘油醛脱氢酶(GAPDH)一抗抗体购于美国Abcam公司;辣根酶标记羊抗兔二抗购于上海信裕生物科技有限公司。
1.2 实验方法 2022年3—7月在电子科技大学脑科学学院附属临床医院基础医学实验室进行实验。选用SD大鼠72只,随机数字表法分为6组(12只/组):空白组、模型组、Tet低剂量组、Tet中剂量组、Tet高剂量组、抑制剂组。除空白组外余大鼠采用皮下注射皮质酮构建抑郁症模型,每天1次,连续28 d,具体操作参考文献[10]。通过行为学指标观测判定造模成功[11]。在建模后第8天,Tet低、中、高剂量组大鼠分别灌胃10、20、40 mg/kg的Tet[6],并腹腔注射等量的生理盐水;抑制剂组大鼠灌胃40 mg/kg的Tet和腹腔注射30 mg/kg的ML385[12];模型组和空白组大鼠灌胃并腹腔注射等量的生理盐水,每天1次,持续21 d。在建模结束后称量各组大鼠体质量。
1.3 观察指标与方法
1.3.1 大鼠行为学检测:糖水偏好试验:首先对大鼠进行糖水训练,第1天每笼放2瓶1%蔗糖水,第2天将1瓶蔗糖水换成纯水。大鼠禁食禁水24 h后,笼中放定量好的1瓶1%蔗糖水和1瓶纯水,1 h后取走称质量,计算大鼠糖水偏好率。糖水偏好率=糖水消耗量/(糖水消耗量+纯水消耗量)×100%。
强迫游泳试验:将大鼠放入透明的圆柱形筒中(水深约40 cm,水温24℃±2℃)适应2 min后,记录5 min内大鼠在水中不动时间。
旷场试验:将大鼠放在底部为25个方格的黑色敞箱(80 cm×80 cm×40 cm)中间自由活动1 min后,记录4 min内的水平跨格次数及垂直活动次数,两项总次数之和表示大鼠自主活动评分。
1.3.2 HE及Nissl染色:颈椎脱臼处死6只大鼠后,分离出大鼠大脑组织中的海马组织,在4%多聚甲醛固定24 h后,蔗糖梯度脱水,石蜡包埋后切片(3 μm)。然后将切片放进二甲苯进行脱蜡,随后进行HE染色与Nissl染色。乙醇脱水后封片,在显微镜观察,随机选取Nissl染色切片上CA1区5个视野进行神经元计数。
1.3.3 透射电镜观察海马突触超微结构:将上述剩余海马组织切块,先后用戊二醛(2.5%)固定3 d、锇酸(1%)避光固定2 h,经无水乙醇、丙酮梯度脱水,包埋剂渗透包埋后切片(50 nm),铀铅双染色后在透射电镜下观察海马神经元突触超微结构变化。
1.3.4 大鼠海马组织中炎性因子和氧化应激产物的检测: 处死剩余6只大鼠,分离出海马组织,将大鼠海马组织制成匀浆后,根据IL-6、IL-β、TNF-α ELISA试剂盒检测大鼠海马组织中IL-6、IL-β、TNF-α水平,CAT、ROS、MDA试剂盒检测大鼠海马组织中CAT、ROS、MDA水平。
1.3.5 Western-blot法检测Nrf2/HO-1/NLRP3信号通路蛋白及ASC、Caspase-1蛋白表达:提取各组大鼠海马组织总蛋白,对蛋白进行定量、电泳分离。转PVDF膜后室温条件下封闭2 h,最后再分别加Nrf2、HO-1、NLRP3、ASC、Caspase-1、GAPDH一抗在4℃条件下孵育过夜,加入二抗在37℃条件下孵育90 min。最后Image J软件分析各个蛋白条带的灰度值,计算各个蛋白的相对表达水平。
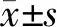
2 结 果
2.1 Tet对大鼠体质量及行为学的影响 与空白组比较,模型组大鼠体质量、糖水偏好率、自主活动评分显著降低,不动时间显著升高,有明显的焦虑和抑郁样特征(P<0.05);与模型组比较,Tet低、中、高剂量组大鼠体质量、糖水偏好率、自主活动评分显著升高,不动时间显著降低(P<0.05);与Tet高剂量组比较,抑制剂组大鼠体质量、糖水偏好率、自主活动评分显著降低,不动时间显著升高(P<0.05),见表1。

表1 各组大鼠体质量及行为学比较
2.2 Tet对大鼠海马组织及神经元损伤的影响 空白组大鼠海马组织结构正常,锥体细胞排列紧密有序且完整,细胞核清晰,胞浆内有大量尼氏小体;模型组大鼠海马组织结构受损,锥体细胞排列松散无序,部分核固缩,尼氏小体、神经元数目减少(P<0.05);与模型组比较,Tet低、中、高剂量组大鼠海马组织结构较为正常,锥体细胞排列较为整齐有序,细胞较为完整,核固缩现象减轻,尼氏小体、神经元数目增加(P<0.05);与Tet高剂量组比较,抑制剂组大鼠海马神经元损伤加重,神经元数目减少(P<0.05),见图1、2和表2。
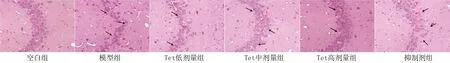
图1 各组大鼠海马组织损伤情况(HE染色,×400)
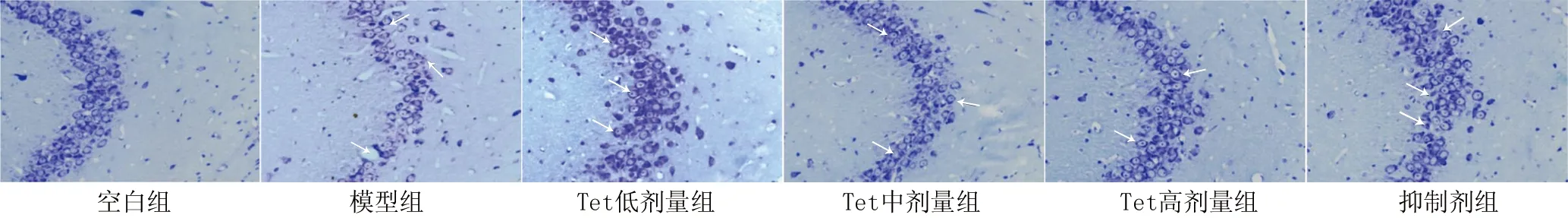
图2 各组大鼠神经元损伤情况(Nissl染色,×400)

表2 各组大鼠神经元存活情况比较
2.3 Tet对大鼠海马突触超微结构的影响 空白组大鼠海马突触结构清晰且完整、神经元细胞器丰富,突触囊泡丰富,突触数量多,突触前膜致密区存在、连续,树突棘基质均匀。与空白组比较,模型组大鼠线粒体肿胀、内质网扩张,神经元胞核皱缩,基质稀疏,突触数量减少,活性带长度和致密区厚度显著降低,突触间隙显著增加(P<0.05)。与模型组比较,Tet低、中、高剂量组大鼠海马突触结构有明显改善,神经元各细胞器结构基本正常、前后膜边界相对清晰,活性带长度和致密区厚度显著增加,突触间隙显著降低(P<0.05)。Tet高剂量组大鼠突触数量和突触小泡明显增多,Tet低剂量组大鼠突触数量增加不明显。与Tet高剂量组比较,抑制剂组大鼠海马突触结构受损加重,线粒体肿胀及内质网扩张明显,突触数量减少,活性带长度和致密区厚度显著降低,突触间隙显著增加(P<0.05),见图3和表3。
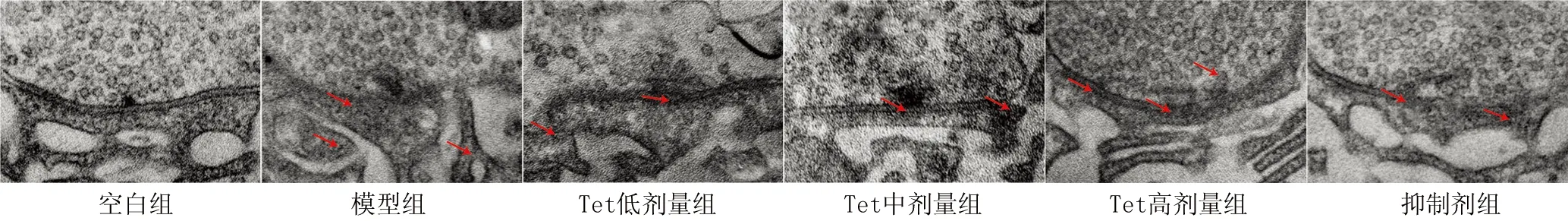
图3 透射电镜观察各组大鼠海马突触超微结构(×20 000)
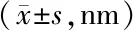
表3 各组大鼠海马突触超微结构参数比较
2.4 Tet对大鼠海马组织中IL-6、IL-β、TNF-α水平的影响 与空白组比较,模型组大鼠海马组织中IL-6、IL-β、TNF-α水平显著升高(P<0.05);与模型组比较,Tet低、中、高剂量组大鼠海马组织中IL-6、IL-β、TNF-α水平显著降低(P<0.05);与Tet高剂量组比较,抑制剂组大鼠海马组织中IL-6、IL-β、TNF-α水平显著升高(P<0.05),见表4。
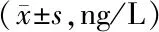
表4 各组大鼠海马组织中IL-6、IL-β、TNF-α水平比较
2.5 Tet对大鼠海马组织中CAT、ROS、MDA水平的影响 与空白组比较,模型组大鼠海马组织中CAT活性显著减弱,MDA、ROS水平显著升高(P<0.05);与模型组比较,Tet低、中、高剂量组大鼠海马组织中CAT活性显著增强,MDA、ROS水平显著降低(P<0.05);与Tet高剂量组比较,抑制剂组大鼠海马组织中CAT活性显著减弱,MDA、ROS水平显著升高(P<0.05),见表5。

表5 各组大鼠海马组织中CAT、ROS、MDA水平比较
2.6 Tet对大鼠海马组织中Nrf2、HO-1、NLRP3、ASC、Caspase-1蛋白表达的影响 与空白组比较,模型组大鼠海马组织中Nrf2、HO-1蛋白表达水平显著降低,NLRP3、ASC、Caspase-1蛋白表达水平显著升高(P<0.05);与模型组比较,Tet低、中、高剂量组大鼠海马组织中Nrf2、HO-1蛋白表达水平显著升高,NLRP3、ASC、Caspase-1蛋白表达水平显著降低(P<0.05);与Tet高剂量组比较,抑制剂组大鼠海马组织中Nrf2、HO-1蛋白表达水平显著降低,NLRP3、ASC、Caspase-1蛋白表达水平显著升高(P<0.05),见图4和表6。
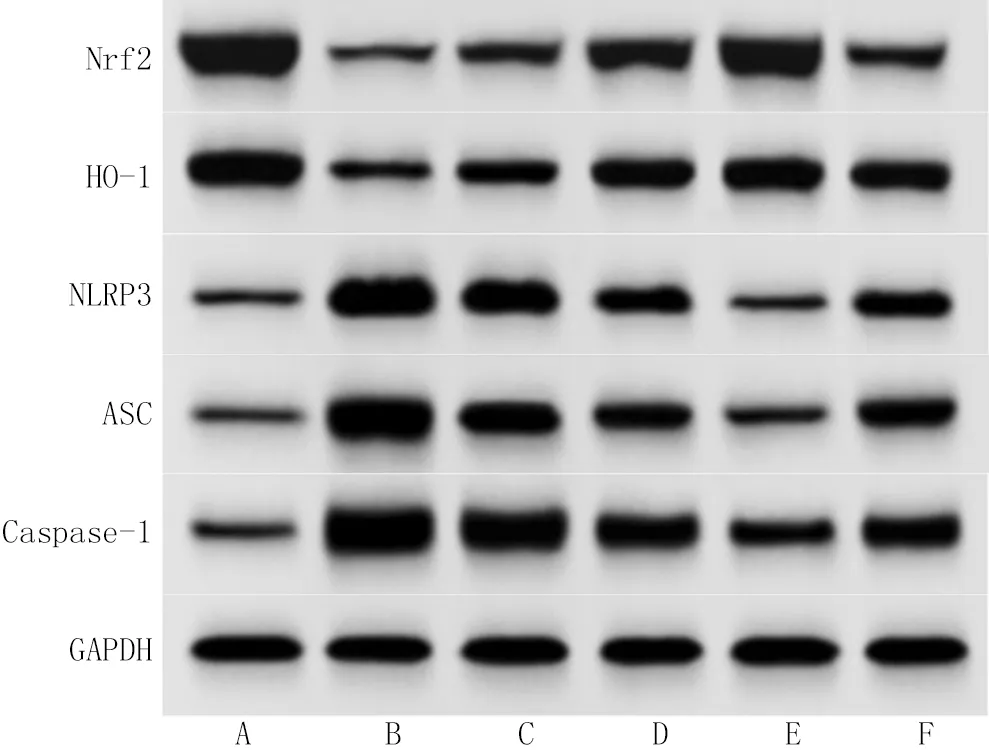
注:A.空白组;B.模型组;C.Tet低剂量组;D.Tet中剂量组;E.Tet高剂量组;F.抑制剂组。
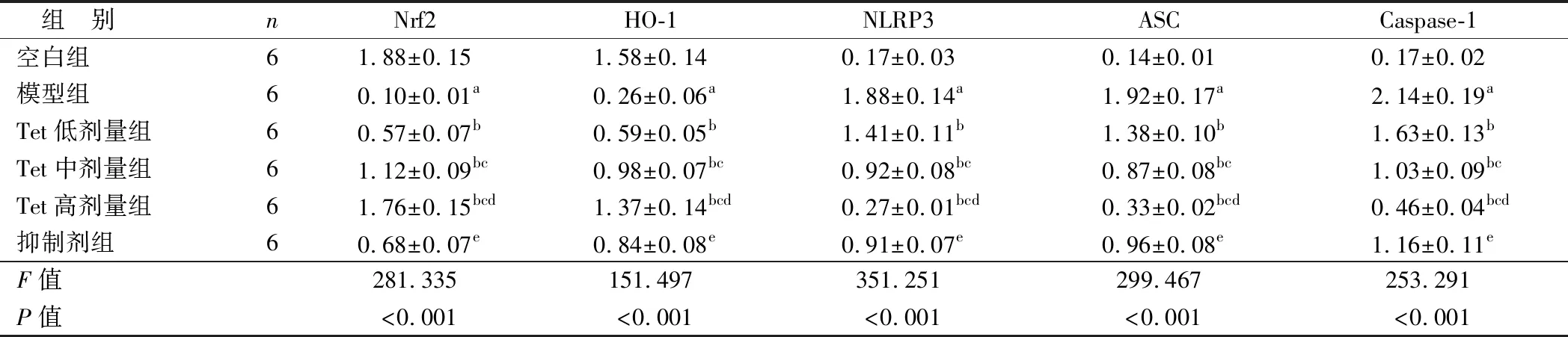
表6 各组大鼠海马组织中Nrf2、HO-1、NLRP3、ASC、Caspase-1蛋白表达比较
3 讨 论
重度抑郁症是一种慢性、复发性和潜在威胁生命的多病因异质性精神疾病,其患病率和病死率极高[13]。实验中常用皮下注射皮质酮构建抑郁症大鼠模型进行动物研究,以往对抑郁症模型大鼠研究发现[3,10-11],大鼠出现体质量减轻、探索欲与活动度低、绝望等抑郁情绪。本研究发现,模型组大鼠出现体质量、糖水偏好率、自主活动评分显著降低,强迫游泳不动时间延长等抑郁行为,与前人研究结果一致,说明抑郁症大鼠模型构建成功[11]。
目前临床上对抑郁症的治疗虽然有效,但因存在着用药时间长、易产生不良反应等问题,仍不够理想,因此,研究出更快速、更安全、更有效的抗抑郁药物是临床上亟待解决的难题[14]。研究表明,来源于中草药的Tet能增加抑郁大鼠体质量和1%蔗糖消耗量、降低强迫游泳试验和尾悬实验的静止时间,具有缓解、治疗抑郁症的作用[6-7]。本研究发现,Tet能缩短强迫游泳不动时间,增加大鼠体质量、糖水偏好率、自主活动评分,大鼠抑郁行为得到显著改善,与前人研究结果一致。
神经炎性反应被认为与神经精神疾病有关,一些临床研究表明,抑郁症状与促炎因子的表达之间存在很强的关联。而且,抗炎药的使用已被证明可以改善抑郁症状,证明了炎性反应作为抑郁症介质的重要性[15]。机体免疫功能紊乱所引起的中枢炎性反应会损伤神经元,导致神经元的结构功能发生改变。Nrf2是一种重要的转录因子,已成为炎性疾病的潜在治疗靶点。HO-1是一种具有抗炎和抗氧化应激作用的酶,Nrf2是HO-1表达的关键调制器[16]。Nrf2/HO-1信号通路在抗炎中起着关键作用。其他研究表明,激活的Nrf2/HO-1信号通路可能会减少细胞内ROS的产生[17]。已知神经炎性反应和NLRP3炎性小体激活与抑郁症的病理有关。NLRP3是细胞内一种多蛋白质复合体,由NLRP3、ASC及pro-Caspase-1组成。当细胞受到刺激时,NLRP3被激活并能够通过结合蛋白ASC招募pro-Caspase-1,形成NLRP3炎性小体。在NLRP3炎性小体的作用下pro-Caspase-1被激活成为Caspase-1,最终导致IL-1β、IL-18的成熟与分泌,引起一系列炎性反应[18]。阻断NLRP3/Caspase-1途径,对神经炎性反应和认知障碍具有神经保护作用[19]。ROS是氧化还原反应的正常代谢产物,ROS水平过高会破坏细胞的完整性,通过细胞脂质、蛋白质、线粒体和DNA的过氧化作用导致组织功能障碍[20]。文献报道ROS与NLRP3炎性小体激活相关[21]。研究发现,激活Nrf2/HO-1/NLRP3通路,可有效地降低炎性因子TNF-α、IL-1β、IL-6及Caspase-1、ROS的水平,对缓解抑郁大鼠的抑郁行为有很好的效果[8-9]。研究发现,Tet不仅对TNF-α、IL-1β、IL-6、IL-8等均有显著的抑制作用,还对神经系统起保护作用[5]。本研究发现,Tet显著增加海马组织中神经元数目、Nrf2、HO-1蛋白表达水平及CAT活性,降低NLRP3、ASC、Caspase-1蛋白表达水平、炎性因子(IL-6、IL-β、TNF-α)及MDA、ROS水平。
综上所述,Tet可能通过激活Nrf2/HO-1/NLRP3信号通路,减轻海马组织炎性反应和氧化应激损伤,从而起到缓解大鼠抑郁的作用。此研究为抑郁症的治疗提供了新思路。然而本研究尚存在不足之处,仅验证了Tet对Nrf2/HO-1/NLRP3信号通路的作用,未对其他靶点、途径进行验证,后续研究将会进一步明确Tet在抑郁症中的作用机制。
利益冲突:所有作者声明无利益冲突
作者贡献声明
邱雪、赵雯婧:提出研究思路,设计研究方案,实施研究过程,论文撰写;王飞燕、李蓉:分析试验数据,论文审核;何宗岭、姚刚:实施研究过程,进行统计学分析,论文修改

