多杀菌素发酵罐的发酵放大工艺研究
高保军,和富明,陈鑫,杨传伦,张心青,田杰伟,
(1.黄河三角洲京博化工研究院有限公司,山东滨州 256500;2.四川大学轻工科学与工程学院,四川成都 610065)
多杀菌素 (spinosad) 是由刺糖多孢菌(Saccharopolyspora spinosa) 经有氧发酵次级代谢产生的大环内酯类抗生素[1]。刺糖多孢菌最早由美国礼来公司的研究人员发现,后由美国陶氏益农公司研究发现该菌发酵产生的2 种高杀虫活性化合物-多杀菌素A 和D[2]。多杀菌素杀虫机理新颖,具有接触毒性和胃毒毒性,以胃毒为主。多杀菌素作用于靶标昆虫的烟碱型乙酰胆碱受体与γ-氨基丁酸(GABA)受体,造成非功能性的肌肉收缩、颤抖、衰竭和麻痹,最终致其死亡,能有效控制鳞翅目、双翅目和缨翅目等害虫,同时对直翅目、蚤目、革翅目和啮虫目等某些特定害虫有一定的毒杀作用。多杀菌素有极强的选择性与杀虫活性,其杀虫速度可与化学农药相媲美[3]。多杀菌素对非标靶类益虫、哺乳动物和鸟类的毒性较低,对水生动物具有轻微毒性[4],安全性高,与目前常用杀虫剂无交互抗性。
我国是农业大国,对杀虫剂有着极大的市场需求[5]。多杀菌素及其衍生物先后3 次获得美国的“总统绿色化学品挑战奖”[6]。多杀菌素的化合物专利在中国已经过期近15 年,国内对其研究更是长达20余年,仍未实现多杀菌素的产业化。究其原因主要存在2 方面问题,首先,多杀菌素菌株发酵水平低,国内报道的刺糖多孢菌多杀菌素发酵水平在2 g·L-1左右[7-8];其次,限制国内多杀菌素产业化的另一个重要因素是多杀菌素发酵生产工艺落后,国内大部分研究多杀菌素发酵工艺仍停留在摇瓶水平,对从摇瓶到发酵罐的放大工艺严重匮乏。祁桂玲等[6]进行了多杀菌素从摇瓶到50 L 发酵罐放大的研究,试验优化了种子罐培养基,并对发酵碳源和消泡剂进行了优化,将多杀菌素的发酵水平从0.565 g·L-1提高到0.707 g·L-1。张瀚等[9]利用5 L 的发酵罐对刺糖多孢菌AEG3-1 进行补料分批发酵,多杀菌素产量达到0.512 g·L-1。因此,通过菌种选育和发酵工艺优化等方法来提高多杀菌素的发酵水平具有极其重要的现实意义。
Saccharopolyspora spinosaYJY-12 是1 株具备大量产生多杀菌素的潜在菌株[10],其摇瓶发酵水平达到达2.625 g·L-1,利用发酵罐进行工艺放大的研究还在不断探索中。通常摇瓶发酵与发酵罐发酵在剪切力、CO2含量和O2含量方面存在较大差异[6,11]。因此,本研究在摇瓶试验结果的基础上,探究了溶氧和消泡剂对多杀菌素发酵的影响,开展了多杀菌素从摇瓶到30 L 发酵罐的发酵放大培养,并对其补料工艺进行研究,旨在为实现多杀菌素尽快国产化提供有价值的参考。
1 材料与方法
1.1 材料
1.1.1 设备 30 L 自动发酵罐BLBIO-30SJA-3,上海百伦生物科技有限公司。
1.1.2 菌株Saccharopolyspora spinosaYJY-12,精化材料生物研究所实验室保藏。
1.1.3 培养基 固体培养基:葡萄糖7 g·L-1,饴糖10 g·L-1,酪蛋白胨3 g·L-1,酵母浸粉5 g·L-1,MgSO42 g·L-1,琼脂20 g·L-1,pH 值6.9~7.3。
种子瓶培养基:葡萄糖10 g·L-1,饴糖10 g·L-1,酵母浸粉20 g·L-1,蛋白胨10 g·L-1,黄豆饼粉15 g·L-1,KH2PO43 g·L-1,NaCl 5 g·L-1,MgSO44 g·L-1,pH值6.9~7.3。
种子罐培养基:淀粉15 g·L-1,饴糖15 g·L-1,棉籽蛋白10 g·L-1,黄豆饼粉10 g·L-1,酵母浸粉5 g·L-1,丝氨酸1.5 g·L-1,硫酸镁1 g·L-1,硫酸铵1 g·L-1,碳酸钙2 g·L-1,THIX-298 1 g·L-1,pH 值6.9~7.3。
基础发酵培养基:葡萄糖45 g·L-1,棉籽蛋白30 g·L-1,油酸甲酯30 g·L-1,大豆油15 g·L-1,酵母粉10 g·L-1,蛋白粉10 g·L-1,玉米浆干粉10 g·L-1,蛋白胨15 g·L-1,KH2PO43 g·L-1,(NH4)2SO43 g·L-1,CuSO40.002 g·L-1,(NH4)6Mo7O240.002 g·L-1,FeSO40.002 g·L-1,THIX-298 1 g·L-1,CaCO35 g·L-1,pH 值7.3~7.5。
发酵补料培养基一:葡萄糖500 g·L-1,玉米浆干粉20 g·L-1。
发酵补料培养基二:V(油酸甲酯)∶V(大豆油)=1∶1。
1.1.4 消泡剂 试验采用的消泡剂生产厂家和类型见表1。

表1 消泡剂类型及生产厂家
1.2 方法
1.2.1 菌种活化 从-80 ℃冰箱取出冻存管,将菌种接种至固体培养基,30 ℃培养8 d,形成成熟的孢子。
1.2.2 摇瓶培养 刮下孢子,制备孢子悬液,孢子悬液按10 mL·L-1的接种量接种至种子瓶培养基,30℃,220 r·min-1,培养4 d,获取成熟的种子液。
1.2.3 种子罐培养 摇瓶培养液按50 mL·L-1的接种量接种至种子罐中,罐温30 ℃,溶氧控制在30%以上,根据溶氧水平调节转速和通气量,培养30~40 h,获得成熟的发酵罐种子液。
1.2.4 发酵罐培养 将发酵罐种子液按200 mL·L-1的接种量接种至基础发酵培养基,罐温30 ℃,根据溶氧水平调节转速和通气量,溶氧控制在30%以上,以氨水和10%硫酸控制pH 值在6.5~6.7 范围内。
1.2.5 溶氧对多杀菌素发酵水平的影响 采用500 mL 三角瓶,装液量分别为25、50、75、100 mL,接种量50 mL·L-1,30 ℃,220 r·min-1培养10 d,测定发酵液中多杀菌素的发酵水平。
采用500 mL 三角瓶,装液量为50 mL,摇床转速分别设置200、220、240、260、280、300 r·min-1,接种量50 mL·L-1,30 ℃,培养10 d,测定发酵液中多杀菌素的发酵水平。
1.2.6 消沫剂对多杀菌素发酵水平的影响 试验选取了聚醚类、有机硅类、聚醚改性硅3 类(共5 种)常用的消沫剂进行试验,加入量分别为0.5‰、1‰、1.5‰。采用500 mL 三角瓶,装液量为50 mL,接种量50 mL·L-1,30 ℃,240 r·min-1培养10 d,测定发酵液中多杀菌素的发酵水平。
1.2.7 发酵罐间歇发酵 将SaccharopolysporaspinosaYJY-12 的成熟孢子接种至种子瓶,培养成熟后接种至种子罐,接种量50 mL·L-1,培养24~30 h,将其接种至30L 发酵罐,接种量200mL·L-1,装液量15L,初始转速和通气量分别为100r·min-1和10 L·min-1,30℃培养,通过控制转速和通气量来控制发酵过程溶氧,将溶氧控制在10%、15%、20%、25%、30%、35%、40%,30℃培养10d,检测多杀菌素的发酵水平。
1.2.8 发酵罐补料分批发酵 将Saccharopolyspora spinosaYJY-12 的成熟孢子接种至种子瓶,培养成熟后接种至种子罐,接种量50 mL·L-1,培养24~30 h,将其接种至30 L 发酵罐,接种量200 mL·L-1,装液量15 L,初始转速和通气分别为100 r·min-1和10 L·min-1,30 ℃培养,将溶氧控制30%,通过补加发酵补料培养基一控制还原糖在15~20 g L-1,从第6 天开始补加复合油脂,每天补加10 mL·L-1。当发酵水平不再提高或增加较为缓慢时结束发酵并放罐。
1.2.9 分析方法(1)多杀菌素发酵水平测定。取发酵液1 mL,加无水乙腈4 mL,充分振荡30 min,10 000×g 离心10 min,取上清液,通过HPLC 测定多杀菌素的发酵水平。
液相条件:C18 反相柱(250 mm×4 mm,5 μm),流动相为V(甲醇)∶V(乙腈)∶V(0.05%乙酸铵水溶液)=45∶45∶10;流速1.0 mL·min-1,波长250 nm,温度35 ℃。
(2)菌浓测定。取发酵液5 mL,3 000 r·min-1离心10 min,固形物所占体积百分比为菌浓。
(3)还原糖测定。采用DNS 法测定发酵液还原糖浓度。
(4)用SPSS 22.0 统计软件对数据进行单因素ANOVA-LSD 分析和Duncan’s 多重比较,结果为3次独立试验平均值±标准差,不同小写字母表示各处理间差异显著(P<0.05)。
2 结果与分析
2.1 溶氧对多杀菌素发酵的影响
多杀菌素在不同装液量下的发酵水平如表2 所示。在500 mL 三角瓶中装量为25、50 mL 时,多杀菌素发酵水平分别为(2.65±0.13)g·L-1、(2.63±0.11)g·L-1,二者差异不显著;装量为75、100 mL 时,多杀菌素发酵水平显著下降至(1.95±0.11)g·L-1、(1.57±0.07)g·L-1,此时残糖浓度显著升高,糖耗较慢,这表明多杀菌素发酵对溶氧要求较高。

表2 装液量对多杀菌素摇瓶发酵水平的影响
摇床转速对多杀菌素发酵水平的影响如表3 所示。随着摇床转速的提高(200~240 r·min-1),多杀菌素的发酵水平逐渐提高,从(1.72±0.06)g·L-1提高到(2.74±0.04)g·L-1,同时还原糖的消耗也变快;但是,随着摇床转速的进一步提高(260~300 r·min-1),多杀菌素发酵水平逐渐降低。
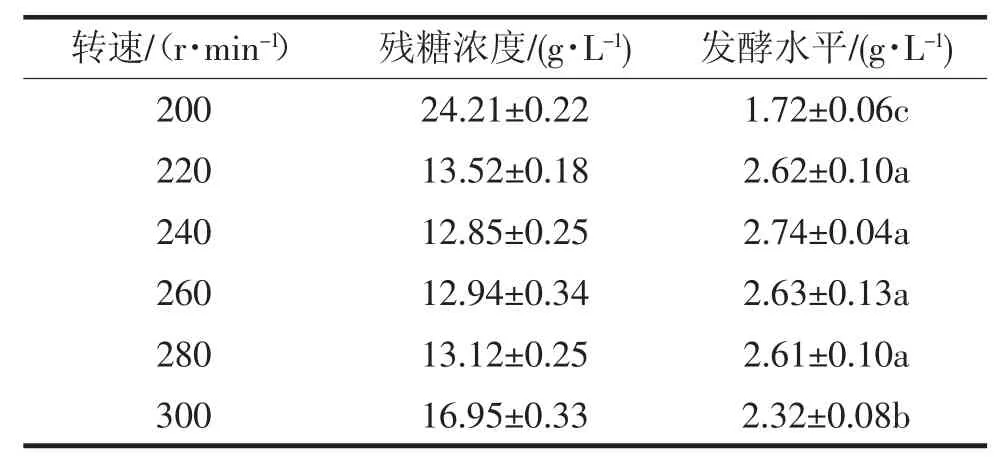
表3 摇床转速对多杀菌素摇瓶发酵水平的影响
2.2 消沫剂对多杀菌素发酵水平的影响
由表4 可知,消泡剂的添加会对多杀菌素的合成产生不利影响,其中有机硅类消泡剂影响最大,聚醚改性硅类消泡剂THIX-298 影响最小。发酵罐放大过程中,在发酵培养基时,随着发酵时间的延长、搅拌转速和通气量的增加,缓慢滴加消泡剂THIX-298,能够控制气泡,防止跑料和溢料。添加量测试结果显示,消泡剂THIX-298 添加量控制在0.5‰时多杀菌素发酵水平为(2.65±0.06)g·L-1,与空白对照组无显著差异,显著高于1‰、1.5‰消泡剂发酵水平。

表4 消沫剂对多杀菌素发酵水平的影响(g·L-1)
2.3 发酵罐间歇发酵
通过控制通气量来控制发酵过程溶氧,不同溶氧下多杀菌素发酵水平如图1 所示。 在Saccharopolyspora spinosaYJY-12 发酵罐间歇发酵过程中控制溶氧为25%、30%时,多杀菌素发酵水平较高,分别达到(2.13±0.06)g·L-1、(2.23±0.06)g·L-1;随着溶氧水平的降低,多杀菌素的发酵水平迅速下降,这也表明了多杀菌素发酵对溶氧要求较高;当溶氧达到35%以上时,多杀菌素发酵水平也出现下降。结果说明,在发酵过程中溶氧控制在25%~30%之间,有利于提高Saccharopolyspora spinosaYJY-12在发酵罐中的发酵水平。
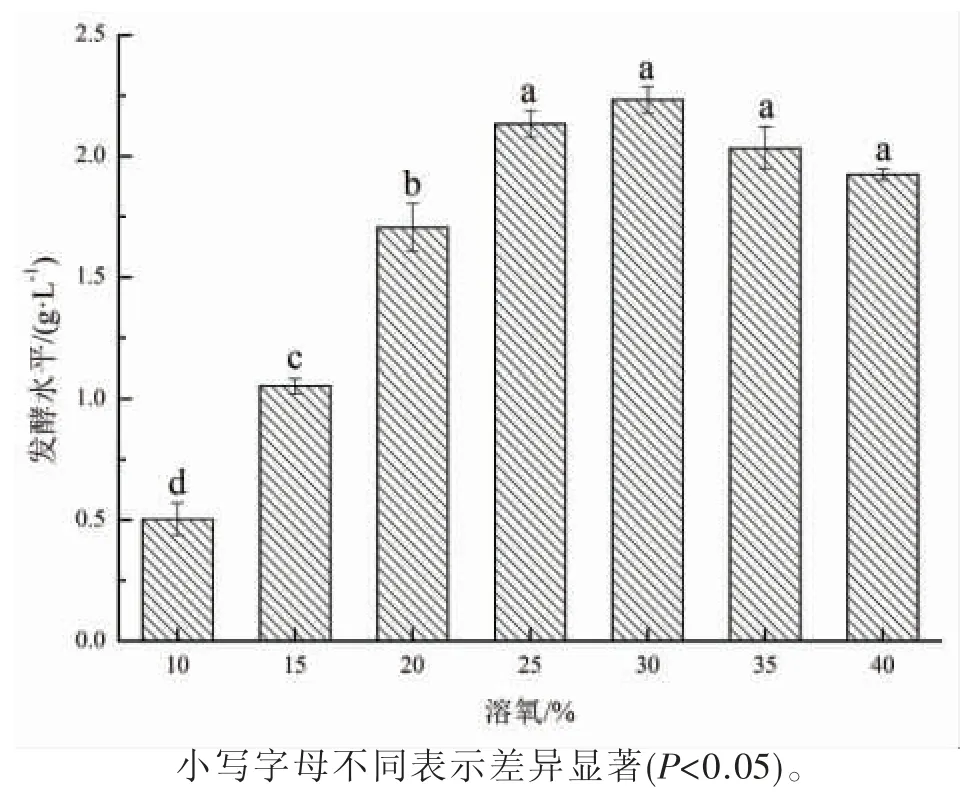
图1 溶氧对多杀菌素发酵水平的影响
在发酵罐多杀菌素间歇发酵过程中溶氧控制在30%,菌浓、还原糖、pH 值,多杀菌素发酵水平的变化如图2 所示。随着发酵时间的延长,还原糖浓度逐渐降低,培养至第6 天,降低至30 g·L-1,进入第7 天,降至19 g·L-1,至发酵结束,降至6 g·L-1。随着培养时间的延长,发酵液pH 值先逐渐上升,至第3 天,发酵pH 值最高,达到7.8,之后逐渐下降,培养至第8天达到最低,发酵pH 值为6.75,之后逐渐上升。菌浓随着培养时间的延长逐渐升高,培养至第4 天,菌浓达到最高约为50%,在4~8 d 菌浓维持在46.5%~50%,之后逐渐下降。多杀菌素的发酵水平在接种1~3 d 缓慢增长,至第4~6 天增长较快,之后增长速度减缓,至第10 天放罐,多杀菌素发酵水平达到(2.23±0.06)g·L-1,实现了多杀菌素从摇瓶到发酵罐的间歇发酵放大。

图2 多杀菌素30 L 发酵罐间歇发酵
2.4 发酵罐补料分批发酵
通过补料,在发酵过程中菌浓、还原糖、pH 值,多杀菌素发酵水平的变化见如图3 所示。培养时间从10 d 延长至12 d,多杀菌素的发酵水平大幅提高,从(2.23±0.06)g·L-1提高至(3.65±0.08)g·L-1,较间歇发酵提高了63.71%。
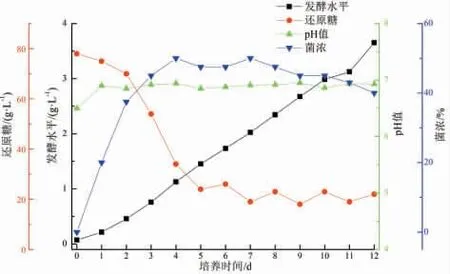
图3 多杀菌素30 L 发酵罐补料分批发酵
3 讨论与结论
多杀菌素发酵是一个好氧过程,缺氧轻则发酵水平降低,重则绝产。提高发酵过程中氧摄入量的方式主要有2 种,一是提高发酵菌株对溶氧的吸收,如:Luo 等[12]将透明颤菌(Vitreoscilla stercoraria)血红蛋白(vgb)基因导入刺糖多孢菌中,可显著促进多杀菌素的生物合成;二是优化发酵工艺,增加外部供氧能力,如:改变摇瓶装液量、摇床转速、偏心距,添加氧载体[13]或使用挡板摇瓶等。本研究通过改变摇瓶装液量和摇床转速改变发酵过程溶氧。摇瓶装液量25 mL,多杀菌素的发酵水平最高达到(2.65±0.13)g·L-1。摇床转速达到240 r·min-1,发酵水平达到最高为(2.74±0.04)g·L-1;当转速高于240 r·min-1,多杀菌素发酵水平逐渐降低,这可能是摇床转速过快,剪切力对菌丝体损伤,菌丝提前老化,造成多杀菌素发酵水平降低[6]。
从摇瓶到发酵罐发酵放大过程中,产生大量泡沫,主要原因有2 个,一是发酵液中含有大量的糖、蛋白质及各种代谢物等;二是发酵罐发酵过程中通气和揽拌形成大量泡沫。泡沫过多容易造成逃液,增加染菌风险,影响产物的合成,因此发酵过程中需要加入一定量消沫剂。消泡剂在罐上发酵非常重要,发酵品种不同消泡剂类型的选择也存在显著差异,有些消泡剂会抑制目的产物的合成[14]。本研究对多杀菌素罐上发酵所需消泡剂进行筛选,结果显示,所有消泡剂对刺糖多孢菌产多杀菌素均有一定程度的抑制,其中聚醚改性硅类消泡剂THIX-298 影响最小,其使用浓度应在0.5‰以下。
通过控制转速和通气量调节罐上发酵溶氧浓度,当罐上氧浓度达到30%,多杀菌素发酵水平最高可达(2.23±0.06)g·L-1,溶氧降低会强烈抑制多杀菌素的生物合成。溶氧高于30%,多杀菌素发酵水平降低,这可能是由于发酵罐搅拌转速过快,剪切力对菌丝体的损伤,菌丝老化过快造成。
在发酵过程中进行补料是提高目的产物最有效的方式,补料既能避免高浓度基质抑制和葡萄糖分解代谢阻遏效应,也能避免一次性投糖过多出现菌体疯长,耗氧过多造成供氧不足的状况。采用补料分批发酵的方式,能够显著延长微生物发酵的稳定期周期,这对于次级代谢产物尤为重要,有利于目的产物的积累。通过补料分批发酵,补加葡萄糖和油酸甲酯,调控pH 值,多杀菌素发酵水平从(2.23±0.06)g·L-1提高到(3.65±0.08) g·L-1,发酵水平提高了63.71%。

