水酶法提取羊油的工艺优化及理化分析
王玉丹,马玉莹,韩玲,余群力,曹晖
(1. 甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2. 陕西秦宝牧业股份有限公司,陕西 宝鸡 721000)
我国羊肉产量不断增加,羊脂产量也不断增多[1]。羊油是指经检验检疫合格的羊经过屠宰后,取新鲜完整的脂肪组织,经过高温炼制,得到的油脂[2]。羊油作为食用油脂的重要组成部分,具有独特的风味和优质的功能性,比植物油更具有利用价值[3]。羊油中富有多种饱和脂肪酸,具有较高的营养价值和热量,特别适合供给寒冷地区的人们食用[4]。作为羊肉加工副产物,羊脂资源丰富,但因其加工利用率低,导致资源浪费、环境污染严重[5]。
因此,本试验以羊板油为原料,采用水酶法提取羊油,探究提取条件对羊油提取率的影响,并采用响应面法优化羊油提取工艺条件,结合气相色谱-质谱比较分析水酶法和传统干法所得油脂中脂肪酸的组成并进行品质分析,以期为羊油的高效提取提供理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
羊脂,采自甘肃古浪中天羊业有限公司,选取年龄在1岁左右公羊的羊板油,去除外部结缔组织,切碎,置于-18 ℃环境中;碘化钾、碘、氢氧化钾、硫代硫酸钠、无水硫酸钠、石油醚,均为分析纯;中性蛋白酶,蛋白酶活力50 000 U/g,北京索莱宝科技有限公司,均为食品级。
1.2 仪器与设备
SSY-H型恒温水浴锅,北京京创泰宁伟业科技发展有限公司;JA2003 型电子天平,陕西德祥实验设备有限公司;JP-020S型超声波清洗器,亦为超声技术有限公司;QL-866 漩涡振荡器,绍兴万力仪器有限公司;GCMS-6800气相色谱-质谱联用仪,广东惠州市华高仪器设备有限公司。LHS-150SC 电热恒温干燥箱,武汉江宇制造有限公司;PHS-320酸度计,武汉吉尔德科技有限公司;TGL-16M 高速冷冻离心机,浙江纳德科学仪器有限公司。
1.3 试验方法
1.3.1 羊油水酶法提取工艺 羊脂→除杂→切碎→搅成糜状→用蒸馏水调节料液比→调节温度→加酶→水浴酶解→离心(5 000 r/min,15 min)→上清液→羊油。
1.3.2 单因素试验 依据预试验,选择中性蛋白酶,参考王庆玲[6]的方法,在料液比1∶1 、酶解时间2 h、温度55 ℃的基础条件下,保持其他条件不变,只改变其中1 个因素,设置酶添加量100、300、500、700、900 U/g、酶解时间0.5、1.0、1.5、2.0、2.5 h、料液比2∶1、1∶1、1∶2、1∶3、1∶4(g∶mL)、温度50、55、60、65、70 ℃,以提取率为指标进行单因素试验,每个试验重复3次。
1.3.3 响应面试验优化 在单因素试验基础上,采用Box-Behnken设计,以酶添加量(A)、时间(B)、料液比(C)和温度(D)为自变量,提取率为因变量,设计四因素三水平试验(表1)。

表1 响应面试验因素水平Table 1 Response surface test factor level
1.3.4 羊油理化指标测定 碘值:参考《GB/T 5532-2008 动植物油脂碘值的测定》;酸值:参考《GB/T 5009.229-2016食品安全国家标准 食品中酸价的测定》;过氧化值:参考《GB/T 5009.227-2016动植物油脂 过氧化值测定》;皂化值:参考《GB/T 5534-2008动植物油脂 皂化值的测定》。
1.3.5 羊油脂肪酸组成分析
其中u=u(x,y,t)=vx,α,β,γ1,γ2,γ3是任意常数。最近马文秀教授等人利用Hirota双线性形式获得了方程(1)的Lump形式解[17]。接下来我们将利用Hirota双线性形式讨论方程(1)的混合型孤子解。
1.3.5.1 脂肪的甲酯化 参考李涛等[12]的方法,并稍作修改。称取0.5 g 样品于具塞试管中,加入10 mol/L KOH 溶液0.35 mL,无水甲醇2.65 mL,55 ℃水浴皂化1.5 h,每30 min 振摇1 次。水浴结束后,取出试管,冷却,加入12 mol/L 的H2SO4溶液0.29 mL,55 ℃水浴1.5 h进行游离脂肪酸甲酯化,同时每30 min振摇1次。水浴结束后,取出试管冷却,加入1.5 ml 正己烷,摇匀,转至离心管,离心5 min(3 000 r/min),取上清液待测。采用GC-MC进行脂肪酸组成分析。
1.3.5.2 脂肪酸测定的气相色谱-质谱条件 色谱条件:PE-5MS 毛细管气相色谱柱(30 m×0.25 m,0.25 μm),氮气流速1.0 mL/min,汽化室的温度为290 ℃ ;流速1.0 mL/min;采用程序升温,起始温度55 ℃,保持3 min,以5 ℃/min升到290 ℃,保持30 min;进样方式为分流,分流比50∶1。
质谱条件:电离子源温度 240 ℃,电离模式在电子冲击70 eV 时使用,接口温度250 ℃,接口温度250 ℃,传输线温度210 ℃,扫描范围(m/z) 30~550。
1.4 数据分析
采用SPSS 软件对数据之间的差异进行处理,Origin 9.0软件作图,Design Expert 8.0.6软件进行响应面试验设计分析。
2 结果与分析
2.1 单因素试验
2.1.1 酶添加量对提取率的影响 从图1可知,酶添加量在0~500 U/g 之间,羊油提取率呈上升趋势,当为500 U/g达到最大值,为93.63%。之后随着酶添加量进一步增加,羊油的提取率无显著变化(P>0.05)。其原因是底物浓度一定,酶添加量增大,加快了酶与底物的反应速度,油脂释放增大[13]。酶添加量继续增加,因底物浓度一定,酶与底物反应速度减慢,酶解较彻底,故提取率无显著变化(P>0.05)。考虑成本宜选择500 U/g 作为酶添加量。

图1 提取率与酶添加量之间的关系Figure 1 The relationship between extraction rate and enzyme concentration
2.1.2 酶解时间对提取率的影响 从图2可知,酶解时间在0.5~2 h之间,羊油提取率呈上升趋势,当为2 h 达到最大值,为93.50%。之后随着酶解时间进一步延长,羊油的提取率无显著变化(P>0.05)。其原因是酶解时间增加,破坏了油脂细胞壁成分,油脂分子团暴露,益于油脂释放[14]。酶解时间继续增加,酶与底物充分反应,油脂释放完全,提取率无显著变化(P>0.05)。故选择2 h作为酶解时间。

图2 提取率与酶解时间之间的关系Figure 2 The relationship between extraction rate and enzymatic hydrolysis time
2.1.3 料液比对提取率的影响 从图3可知,料液比在2∶1~1∶1 之间,羊油提取率呈上升趋势,当为1∶1 达到最大值,为92.90%。之后随着料液比进一步增大,羊油的提取率显著下降(P<0.05)。其原因是料液比过低,酶与底物浓度降低,影响酶反应速率,提取率下降[8]。料液比继续增大,因酶与底物碰撞几率降低,不利于提油[15]。故选择1∶1 作为料液比。
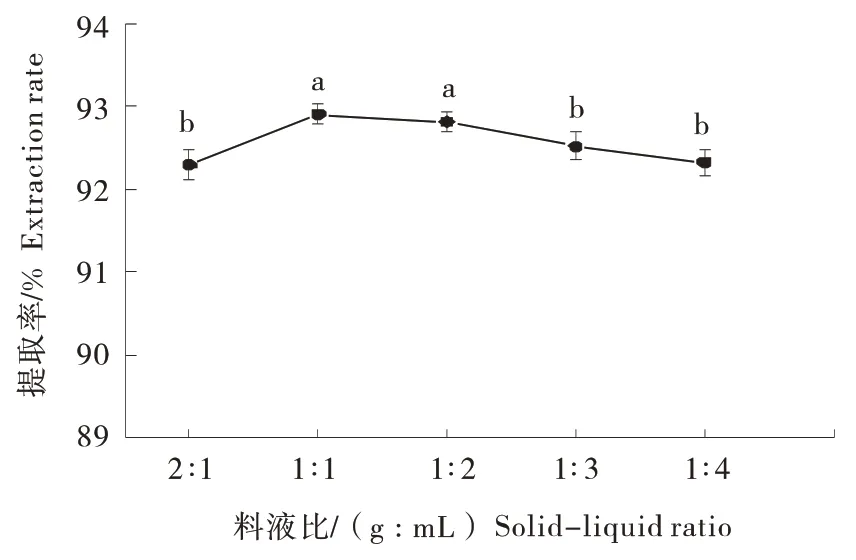
图3 提取率与料液比之间的关系Figure 3 The relationship between oil extraction rate and solid - liquid ratio
2.1.4 温度对提取率的影响 从图4可知,温度在50~55 ℃之间,羊油提取率呈上升趋势,当为55 ℃达到最大值,为93.37%。之后随着温度继续增加,羊油的提取率显著下降(P<0.05)。其原因是温度较低,未达到酶的最适温度,油脂部分酶解。温度继续上升,因高温破坏了蛋白结构,使酶变性,故提取率降低[16]。从而选择55 ℃作为提取温度。

图4 提取率与温度之间的关系Figure 4 The relationship between extraction rate and temperature
2.2 响应面优化试验结果
2.2.1 响应面试验设计及结果 响应面试验结果见表2。

表2 响应面试验设计及结果Table 2 Response surface test design and results
采用Design-Expert 8.0.6 统计软件对表中数据进行拟合,得到水酶法提取羊油的二次多项回归方程为:
对该模型进行方差分析,结果见表3。
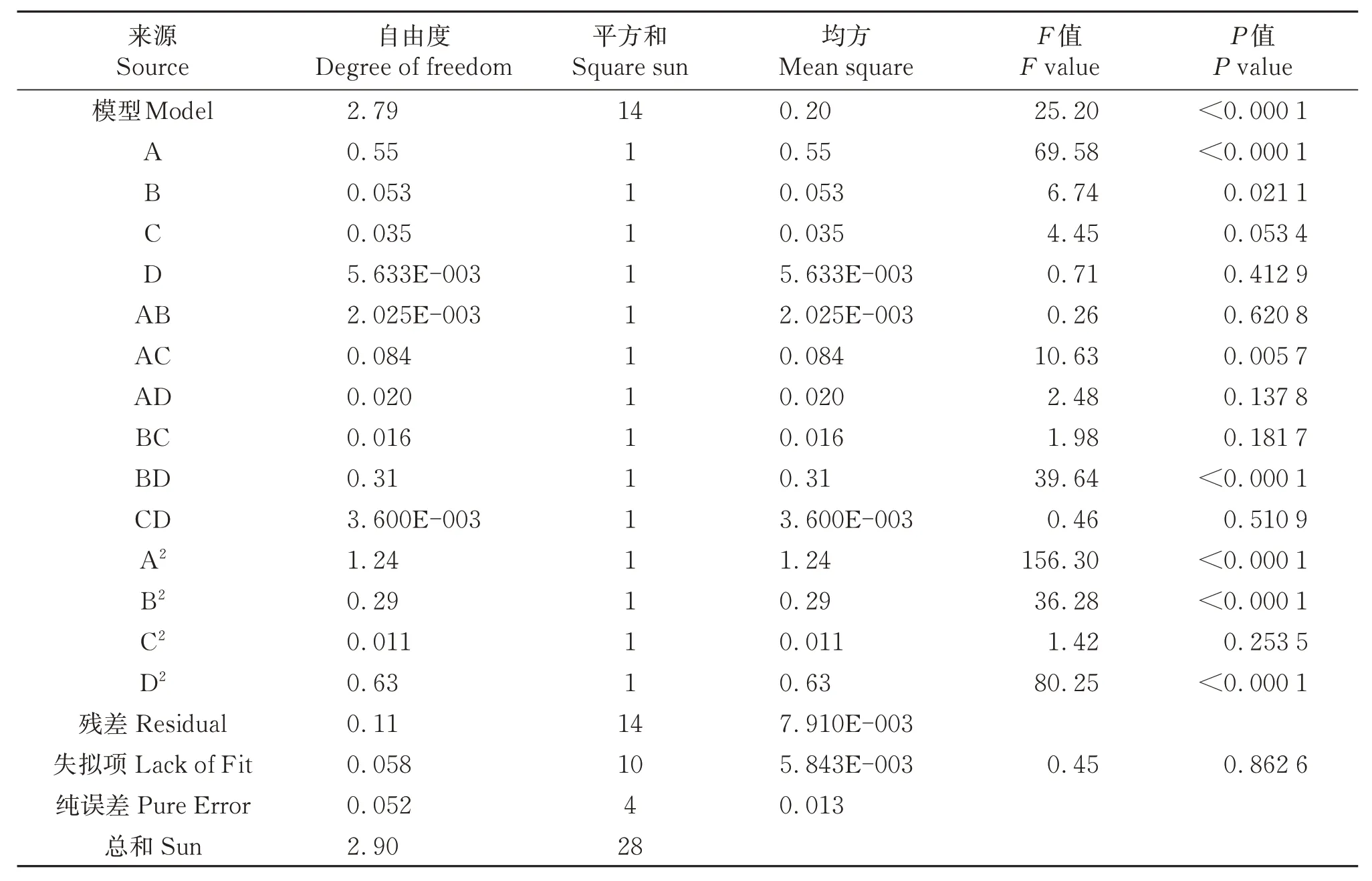
表3 响应面回归模型的方差分析Table 3 Analysis of variance of response surface regression model
由回归模型方差分析(表3)可以看出,响应模型的P<0.000 1,F=25.20,失拟项P=0.862 6>0.05不显著,该模型的拟合度较高。此外,R2为0.961 8,说明该模型能解释96.18%的响应值变化,只有很小的变量(3.82%)没有得到合理的解释,表明预测结果与实际结果具有很好的一致性。R2Adj为92.37%,说明试验有92.37%受控制变化的因素影响,未控制因素对试验结果的影响很小,以上结果表明该模型的拟合度良好,可用于羊油提取率的预测。由表3可知,一次项A对羊油提取率的影响较大,达到了极显著水平(P<0.01),B 对羊油提取率的影响较显著(P<0.05),而C、D对羊油提取率的影响不显著(P>0.05)。二次项A2、B2、D2对羊油提取率的影响极显著(P<0.01),C2对羊油提取率的影响不显著(P>0.05)。模型中的交互项AC、BD对羊油提取率的影响极显著(P<0.01),AB、AD、BC和CD对羊油提取率的影响不显著(P>0.05)。各因素对羊油提取率影响大小顺序为:酶量(A)>时间(B)>料液比(C)>温度(D)。
2.2.2 响应面优化分析 图5是三维响应面图,显示了4 个自变量与响应值的影响。其说明2 个变量及其与另外2 个变量固定影响因变量的相互作用。等高线是响应面在水平方向的投影,圆形等高线图表示相应变量间的相互作用可以忽略不计,而椭圆等高线图表示相应变量之间的显著相互作用[17]。通过这些3D 响应面及其各自的等高线图,就能够非常容易和方便地认出2 个变量间的相互作用,和定位其最佳范围。由图5 可得知,各因素交互作用大小依次为:酶解时间与温度>酶添加量与料液比>酶添加量与温度>酶解时间与料液比>料液比与温度>酶添加量与酶解时间,与表3 中回归分析结果相符。
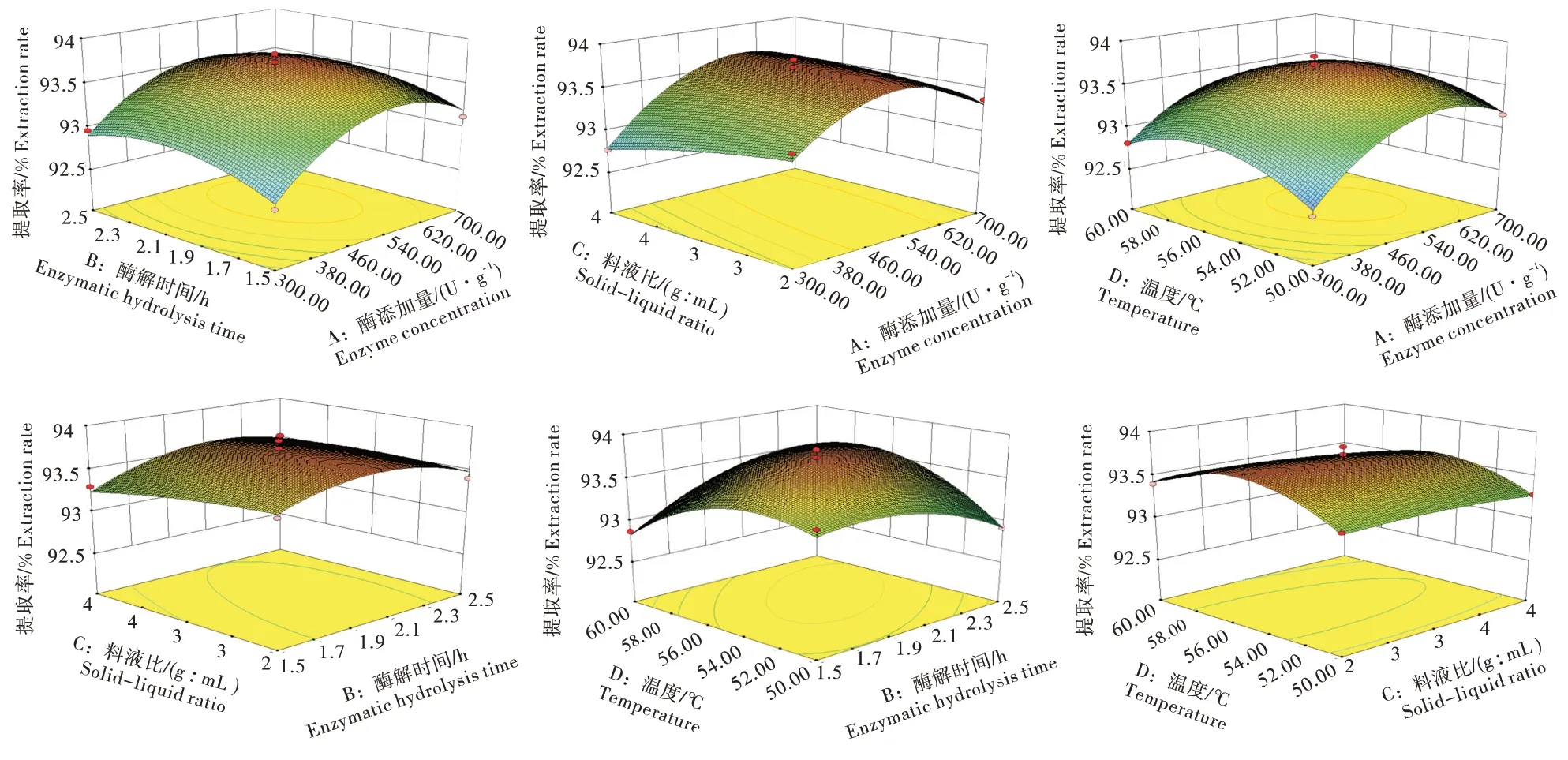
图5 四因素间交互作用响应面图Figure 5 Response surface diagram of interaction among four factors
2.3 最佳提取条件的确定及验证
通过Design-Expert 8.0.6 软件分析得出水酶法提取羊油的最优组合为:酶添加量539.72 U/g,时间2.09 h,料液比1∶1,温度55.53 ℃,预测得到的提取率为93.71%。考虑实际生产的操作性,将羊油提取的工艺条件优化为:酶添加量540 U/g,时间2.0 h,料液比1∶1,温度56 ℃。对水酶法提取羊油的最佳工艺条件进行验证试验,3次平行试验后,羊油提取率平均值为93.54%,这与回归模型预测的值非常契合,从而验证了模型的可靠性。因此,水酶法提取羊油的条件可靠且实用。
2.4 羊油理化指标分析
采用传统干法和水酶法提取羊油,对比不同的提取方法对羊油品质及提油率的影响。由表4可知,水酶法提取羊油的提油率最高,为93.54%,显著高于传统干法(P<0.05),相较于传统干法(81.45%),提高了12.9%。这是由于在酶的作用下,油脂更容易渗出。水酶法提取羊油的酸值显著低于传统干法(P<0.05),可能由于在水酶法提取羊油的过程中,碱中和了油脂中的部分游离脂肪酸[18],使油脂酸值较低。碘值是衡量油脂不饱和程度的重要指标,油脂中的不饱和脂肪酸含量越高,碘值就越大。相比于传统干法提取,水酶法的碘值显著较高(P<0.05),说明水酶法提取工艺可以使油脂中存在的不饱和脂肪酸较好的保留下来;水酶法提取羊油的皂化值和过氧化值显著低于传统干法(P<0.05),可能是由于传统干法在提取过程中温度较高,水酶法提取的温度较低,过程较温和,而高温会加速油脂的氧化酸败,使油脂过氧化值升高,品质下降。综合考虑羊油提油率与品质,水酶法提取过程安全有效,可以有效的提高羊油的利用率,提取的羊油品质较好。

表4 传统干法和水酶法对羊油品质和提取率的影响Table 4 Effects of traditional dry method and aqueous enzymatic method on the quality and extraction rate of sheep oil
2.5 羊油脂肪酸组成分析
为了解水酶法提取羊油的脂肪酸组成,在样品甲酯化后使用GC-MC分析。结果示于表5中。羊油的水酶法中共含有17种脂肪酸,其中SFA占57.47%,UFA占42.53%。主要的SFA是C18∶0和C16∶0,占总脂肪酸的24.83%和16.52%,因此羊脂质地很坚硬[19];主要的UFA 是C18∶1n9t,占总脂肪酸的32.43%,这与李涛等人[12]的研究结果一致。在结果中,羊油的水酶法和干法中的脂肪酸无明显差异。表明水酶法处理对羊油脂肪酸组成无明显影响。

表5 羊油中脂肪酸组成及含量Table 5 Composition and content of fatty acids in sheep oil
3 讨论
水酶法提取羊油的工艺,受到酶添加量、酶解时间、料液比、温度等条件的影响,在规定条件范围内,羊油提取率随提取因素的变化而改变。本研究中,羊油提取效率随着酶添加量的提高而出现了先增高后趋于平稳的态势,这与贾俊强等[20]研究的中性蛋白酶水解蚕蛹油结果类似,很可能是在含量相当的条件下,蛋白酶与底物充分反应,在相应时间内,提取率显著增加;酶添加量过量时,过量蛋白酶与底物无法结合,可能形成抑制效应[21]。酶与底物的接触时间影响着酶的活性,影响反应程度[22]。试验中随着酶解时间的不断增加,提取率呈现先上升后趋于平缓的趋势,这与刘倩霞等[23]研究的2种蛋白酶酶解曲拉干酪素条件优化的结果相似,可能是因为在蛋白酶解初期,由于酶切位点较多,有利于水解反应的进行,使提取率上升趋势明显,而随着酶解时间的不断增加,暴露的酶切位点相对较少,酶与底物不能有效地结合,提取率趋于平缓[24]。试验中料液比不断增大,提取率呈先升高后下降的趋势,可能是由于料液比较大时,酶与底物碰撞几率降低,不利于提油[18],提取率下降;料液比过低,酶与底物的浓度降低,影响酶反应速率,提取率下降[8]。由于酶属于生物活性物质,其构象和活性取决于提取温度[17]。试验中温度的升高使提取率先升高后下降,此结果与王庆玲等[5]研究的猪油的水酶法提取工艺结果相似,可能是温度上升,加快了酶促反应的速率,过高的温度,使酶变性失活,导致酶反应速率减慢[5]。
油脂理化性质和脂肪酸组成反映了油脂的品质。由于酶、热和微生物的作用,油脂会发生水解,生成游离脂肪酸,影响油脂的质量[25]。油脂中游离脂肪酸含量的多少,是油脂品质好坏的重要指标,而酸价是脂肪中游离脂肪酸含量的重要标志,可作为油脂变质程度的指标[26-27]。在本研究中,水酶法提取的羊油酸值显著低于传统干法(P<0.05),可能由于在水酶法提取羊油的过程中,碱中和了油脂中的部分游离脂肪酸[18],使油脂酸值较低。过氧化值是油脂和脂肪酸等被氧化程度的一种指标,以 1 kg样品中活性氧的毫摩尔数表示,也可用油脂过氧化物从碘化钾中析出的碘占试样的百分比来表示。水酶法提取的羊油过氧化值优于传统干法,可能是水酶法提取的过程温和,传统干法提取温度较高,高温加速油脂的氧化酸败,使油脂过氧化值升高,说明水酶法提取的油脂氧化程度低,这与程倩[28]研究的水酶法提取葵花籽仁油工艺优化的结果相似。碘值是衡量油脂不饱和程度的重要指标,油脂中的不饱和脂肪酸含量越高,碘值就越大。与传统干法相比,水酶法的碘值显著较高,说明水酶法提取工艺可以使油脂中存在的不饱和脂肪酸较好的保留下来。在本研究中,水酶法与干法提取的羊油中脂肪酸组成与含量基本一致,此结果与王庆玲等[6]研究的猪油水酶法提取工艺结果相似,表明运用水酶法提取羊油的过程安全,提油率高,羊油的脂肪酸组成未受到影响。由此可见,水酶法提取羊油的提取率高,油脂品质较好。
4 结论
本研究采用水酶法提取羊油,在单因素和响应面试验的基础上,优化得到最佳提取条件为酶添加量540 U/g,酶解时间2 h,料液比1∶1,温度56 ℃。在此条件下,羊油提取率为93.54%,显著高于传统干法。且水酶法所得羊油理化指标优于传统干法,脂肪酸组成与含量基本一致,均主要含有油酸、硬脂酸和棕榈酸等。水酶法作为提取羊油的新方式,条件温和,提取率高,品质较好,对羊油的工业化生产具有一定指导意义。

