生物炭/凹凸棒石复合材料对铅镉的吸附
李贝贝,张亚平,郭炳跃,杨锟鹏,沈凯,胡文友
(1.东南大学能源与环境学院,能源热转换及其过程测控教育部重点实验室,南京 210096;2.江苏省地质勘查技术院,南京 210008;3.中国科学院南京土壤研究所,南京 210042)
重金属污染是危害最大的水污染问题之一。在淡水生态系统中,废水中重金属的主要来源为自然(岩石风化与火山活动等)和人为(工农业活动、生活污水排放)两种[1-2]。不同于有机污染物,重金属不可降解,其可通过食物链直接或间接地危害人类健康[3]。目前,已有许多用于去除水溶液中重金属离子的技术,如吸附法、化学沉淀法、离子交换法和膜过滤法等[4]。其中吸附法由于具有处理效率高、操作简单及成本低等优点而被广泛应用于废水处理。现有吸附剂包括活性炭[5]、黏土矿物[6]、壳聚糖[7]、碳纳米管[8]、石墨烯[9]和金属氧化物[10]等。选择一种环境友好、成本低、吸附性能良好的吸附剂是当前吸附技术研究的关键。
生物炭是生物质材料在缺氧或无氧环境下,通过高温热解得到的富含碳的固体产物,具有孔隙多、比表面积大、官能团丰富等特性。近年来,生物炭已被广泛应用于水体和土壤中污染物的去除[11-13],尤其能够有效吸附废水中的重金属。郜礼阳等[14]研究发现桉树叶生物炭对Cd2+的最大吸附量可达到94.32 mg·g-1;Zhang 等[15]利用苦楝木制备磁性生物炭用于去除水中的Cr(Ⅵ),其最大吸附量为25.27 mg·g-1;Zhang等[16]在低氧热解气氛下制备毛竹生物炭作为吸附剂,其对Pb2+的吸附量为67.4 mg·g-1。但实践证明,由于生物质自身特点及制备条件的不同,生物炭在实际应用中的作用有限,因此越来越多的学者开始研究制备生物炭复合材料以改善生物炭的理化性质,增强其吸附性能[17-19]。凹凸棒石(ATP)又名坡缕石,化学式为(Mg,Al)2Si4O10(OH)·4H2O,是一种天然的纤维状水合镁铝硅酸盐黏土矿物[20],其表面具有活性羟基,比表面积较大,阳离子交换容量适中,吸附性能良好,凹凸棒石常被用作吸附剂以去除水溶液中的染料、重金属及表面活性剂等[21]。Wang 等[22]研究发现通过盐酸处理的凹凸棒石对Cd2+更具亲和力,Cd2+吸附量最高可达到52.58 mg·g-1;廖晓峰等[23]制备的凹凸棒复合纳米材料吸附剂对Pb2+的最大吸附量为129.32 mg·g-1。为提高生物炭吸附能力,降低生产成本,相关应用研究结合生物炭与天然黏土矿物材料的优势开发了新型生物炭/黏土复合材料[24]。
现有研究表明,生物炭的吸附机理主要取决于生物炭的原料种类及热解温度,目前针对于此的定性及定量分析已有大量研究[25-28]。然而,关于生物炭/凹凸棒石复合材料对Cd2+和Pb2+的吸附机理的定量分析研究仍较少,此外,由于原料是影响吸附机制的主要因素,不同原料及不同比例条件下的复合材料在吸附特性和吸附机制上的差异尚不明晰。本研究通过将凹凸棒石和氯化钙(CaCl2)预处理的水稻秸秆和小麦秸秆生物质热解制备了生物炭/凹凸棒石复合材料,分析所得复合材料的理化性质,探究不同原料及不同配比的复合材料对Cd2+和Pb2+的吸附特性,定性分析复合材料对溶液中Cd2+和Pb2+可能的吸附机理,同时定量比较复合材料吸附过程中不同吸附机制的贡献率,以期为复合材料在水体污染领域的应用提供理论依据。
1 材料与方法
1.1 实验方法
吸附材料的比表面积和孔体积利用N2吸附静态容量法,采用表面积和孔隙度分析仪(V-Sorb 2800P)测定。表面晶体结构采用X 射线衍射仪(日本理学SmartLab 9kw)测定。采用傅里叶变换红外分光光度计(Nicolet6700)对吸附材料的表面官能团性质进行表征。通过扫描电子显微镜(Hitachi Regulus8100)表征吸附材料的表面形貌。采用电位分析仪(Malvern Nano-ZS90)在2~7的不同pH下测定Zeta 电位。
1.2 材料制备
水稻秸秆与小麦秸秆均于江苏省南京市的当地农民处收集,凹凸棒石产自江苏盱眙。将生物质原料用去离子水洗净后,放入烘箱在80 ℃下干燥至质量恒定,使用SUS 粉碎机进行研磨后过60 目筛密封保存。凹凸棒石与不同生物质原料分别按照1∶3与1∶5的比例混合,CaCl2·2H2O 与混合物的比例为1∶2,将其加入到100 mL 去离子水中,超声30 min,磁力搅拌2 h 后浸渍24 h。将混合物于80 ℃干燥后,取适量放入石英管并置于管式炉内,在N2气氛下以10 ℃·min-1的升温速率升温至600 ℃并保持1 h。材料冷却至室温后取出,用去离子水清洗多次至pH 为7。最后将产物在105 ℃条件下烘干,密封袋保存,放置于干燥器中备用。不同比例稻秆复合材料和麦秆复合材料分 别 命 名 为RABC3-1、RABC5-1 和WABC3-1、WABC5-1。以同样的方法制备未经凹凸棒石改性的稻秆生物炭(RBC)和麦秆生物炭(WBC)。
1.3 吸附实验
以0.01 mol·L-1的NaNO3作为背景电解质,利用Cd(NO3)2·4H2O 和Pb(NO3)2制备Cd2+和Pb2+溶液。称取0.05 g 吸附材料加入含有25 mL Cd2+(120 mg·L-1)或Pb2+(400 mg·L-1)溶液的离心管中,溶液初始pH 调节为5,离心管以200 r·min-1的频率振荡,分别于1、5、10、30、60、120、240、360、720、1 440 min 取样离心、过滤,测定滤液中残留的重金属浓度。
在不同初始Cd2+浓度(10、20、40、80、160、320 mg·L-1)或Pb2+浓度(20、50、100、200、400、600、800 mg·L-1)下进行等温吸附实验,称取0.05 g吸附材料分别加入含有25 mL Cd2+或Pb2+溶液的离心管中,溶液初始pH 调节为5,离心管以200 r·min-1的频率振荡,吸附时间为24 h。
为考察初始pH 对Cd2+和Pb2+吸附的影响,在pH为2~7 的范围内,使用0.1 mol·L-1的HNO3和NaOH 溶液调节pH进行吸附实验。
最后,使用ICP-OES 对溶液中Cd2+和Pb2+的浓度进行检测。吸附实验均在室温下进行,每个处理重复3 次。吸附材料对Cd2+和Pb2+的去除率和吸附量用式(1)和式(2)计算:
式中:R为去除率,%;C0和Ce分别为溶液初始浓度和平衡浓度,mg·L-1;Q为平衡吸附量,mg·g-1;V为溶液体积,mL;m为吸附材料投加量,g。
利用准一级动力学模型和准二级动力学模型模拟动力学吸附过程,拟合吸附动力学的实验数据,公式如式(3)和式(4)所示:
为了估计重金属在生物炭上的吸附能力和强度,使用Langmuir 等温吸附模型[式(5)]和Freundlich 等温吸附模型[式(6)]来模拟等温吸附过程,拟合吸附等温线的实验数据。
式中:qt、qe分别为t时刻、平衡时刻的吸附容量,mg·g-1;qm为最大吸附容量,mg·g-1;t为吸附反应时间,min;k1为准一级动力学反应速率常数,L·min-1;k2为准 二 级 动 力 学 反 应 速 率 常 数,g·min-1·mg-1;KL为Langmuir 吸附容量参数,L·mg-1;KF为Freundlich 吸附平衡常数,mg1−n·Ln·g-1;n为吸附强度。
1.4 不同吸附机理的定量分析
依据以往关于炭材料吸附重金属过程中不同吸附机理相对贡献量的研究[29-30]计算了矿物沉淀的吸附量(Qpre)、阳离子交换的吸附量(Qexc)、含氧官能团的络合量(Qcom)和π 电子的配位量(Qπ)[31],并进一步研究了各种机理与复合材料吸附性能的关系。
(1)Qexc是指复合材料吸附前后溶液中阳离子的净释放量,通过对比吸附平衡时含重金属离子溶液和空白溶液中阳离子的浓度差来计算。计算公式如式(7)所示:
式中:QK、QCa、QNa、QMg分别为未酸洗吸附材料在吸附过程中由于K+、Ca2+、Na+、Mg2+的净释放而产生的对重金属离子的吸附量,mg·g-1。
(2)利用1 mol·L-1的HCl 溶液冲洗复合材料样品,得到脱矿物质的复合材料样品,后用去离子水冲洗至pH恒定。通过计算酸洗前后复合材料吸附的重金属的减少量计算无机矿物总的吸附量(Qm)。已知矿物对重金属的吸附是离子交换和矿物沉淀共同作用的结果,因此Qpre可通过Qm与Qexc的差值来计算。计算公式如式(8)、式(9)所示:
式中:Qct、Qca分别为酸洗处理前、后吸附材料的吸附量,mg·g-1;Y指酸洗后复合材料的得炭率。
(3)通过脱矿复合材料在吸附前后pH 的变化值计算出溶液中H+的释放量,从而确定含氧官能团络合后的吸附量Qcom,计算公式如式(10)所示:
式中:QpH为酸洗后脱矿复合材料对重金属离子的吸附量,mg·g-1。
(4)Qπ计算公式如式(11)所示:
2 结果与分析
2.1 复合材料特性
表1给出了不同原料及不同配比的复合材料及原材料的产率、比表面积、孔体积和平均孔径。根据孔径的大小,可以将其分为微孔(<2 nm)、介孔(5~20 nm)和大孔(>50 nm)[32]。由表1 可知,本实验所用吸附材料的平均孔径为4.23~43.40 nm,且由孔径分布图可知,不同复合材料其孔径大小集中于5~20 nm,证明其孔结构均为介孔。与原始生物炭相比,复合材料的比表面积和孔体积都有所增加,平均孔径明显减小。这是由于复合材料在合成过程中,CaCl2作为活化剂促进了孔隙的发育,并产生了新的孔隙;另外凹凸棒石含有相当比例的矿物元素,且具有丰富的过渡孔[33]。然而随着凹凸棒石含量的增加,比表面积减小。这可能是由于当凹凸棒石与生物质原料的比值增加到1∶3 时,凹凸棒石含量过高,生物炭样品的部分气孔被凹凸棒石堵塞。
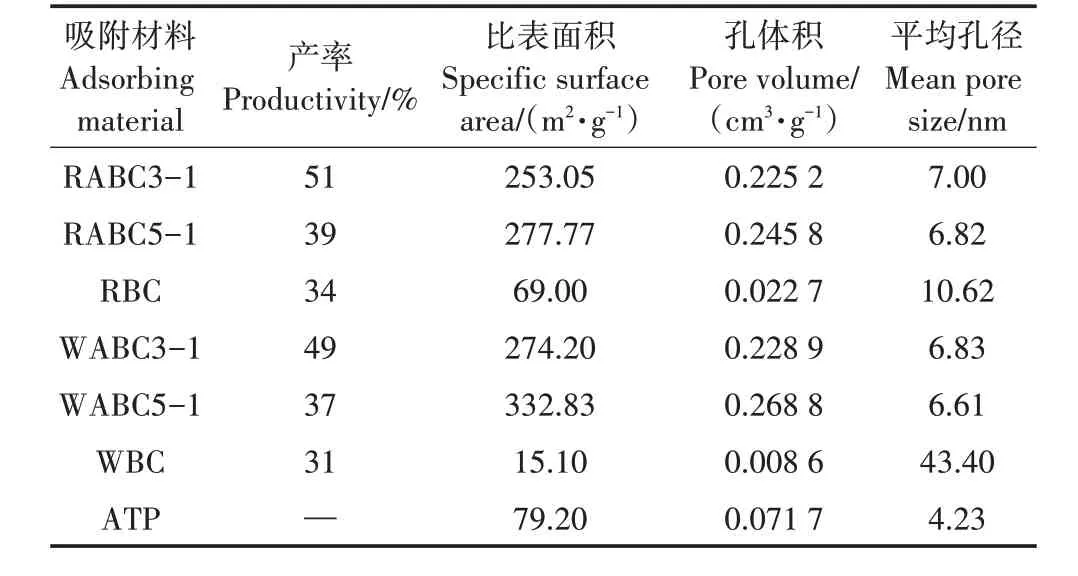
表1 吸附材料基本物理性质Table 1 Basic physical properties of adsorbent materials
2.2 吸附动力学
图1 显示了不同吸附材料对Cd2+、Pb2+的吸附量随吸附时间(0~1 440 min)的变化,表2 为不同吸附材料对Cd2+及Pb2+的吸附动力学方程拟合参数。相较原始生物炭和凹凸棒石,复合材料表现出更优的吸附能力,其中RABC5-1 吸附性能最佳,其在吸附初期(0~120 min)对Cd2+的吸附量达到了51.61 mg·g-1,占吸附总量的86%,对Pb2+的最终吸附量为199.85 mg·g-1,去除率接近100%。这是由于复合材料与重金属溶液之间初始浓度差较大以及初期复合材料表面存在大量活性吸附位点,而后期二者之间的浓度差逐渐减小,导致吸附相中重金属离子与溶液相中重金属离子间静电斥力增强[34],同时表面活性吸附位点也趋于饱和。由表2 可知,准一级动力学与准二级动力学均能较好地拟合吸附过程,但准二级动力学拟合更接近于实测的qe值,说明吸附材料对Cd2+、Pb2+的吸附主要为化学吸附过程。
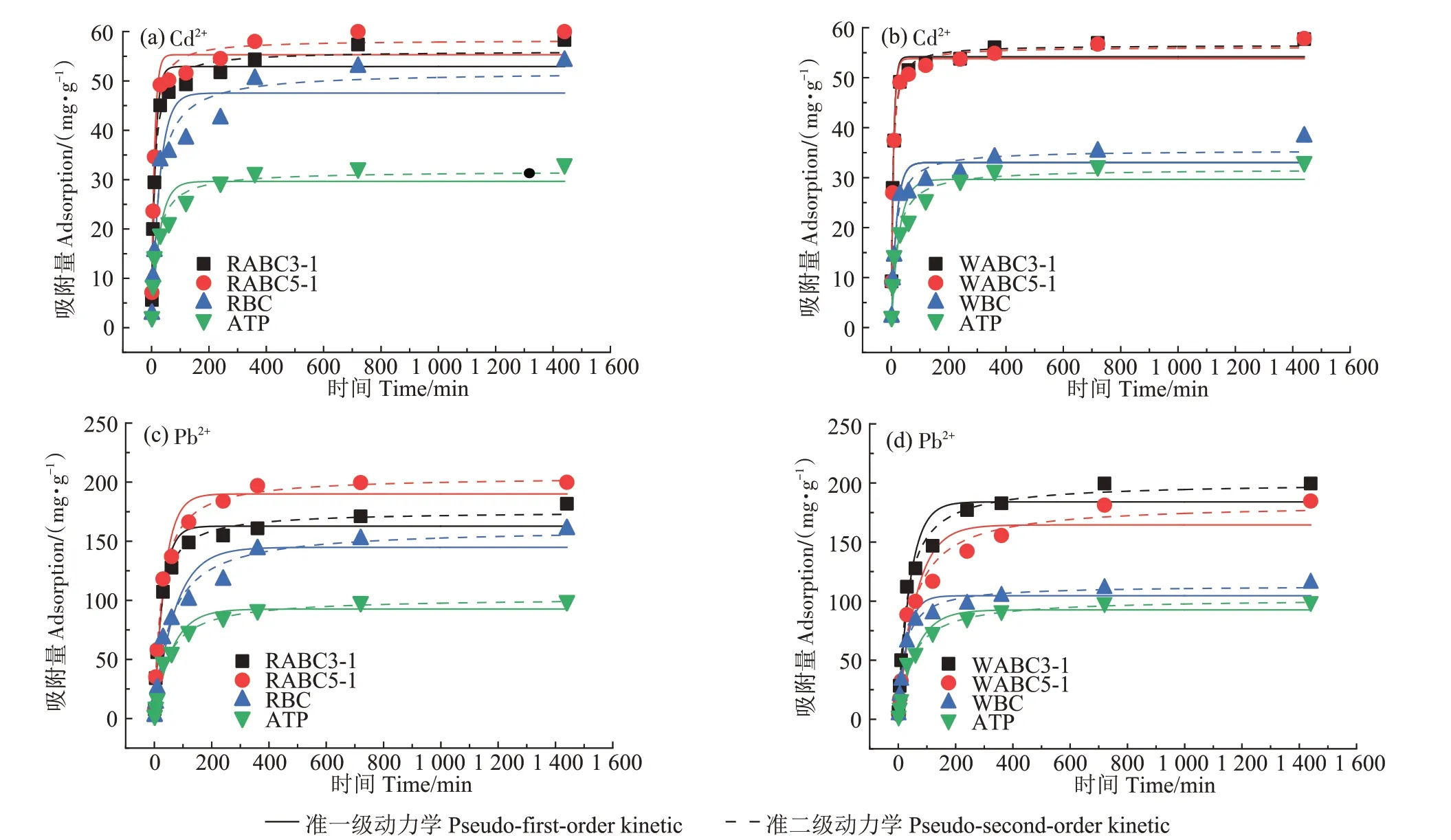
图1 吸附材料对Cd2+、Pb2+的吸附动力学曲线Figure 1 Sorption kinetic of Cd2+and Pb2+on different adsorbent materials
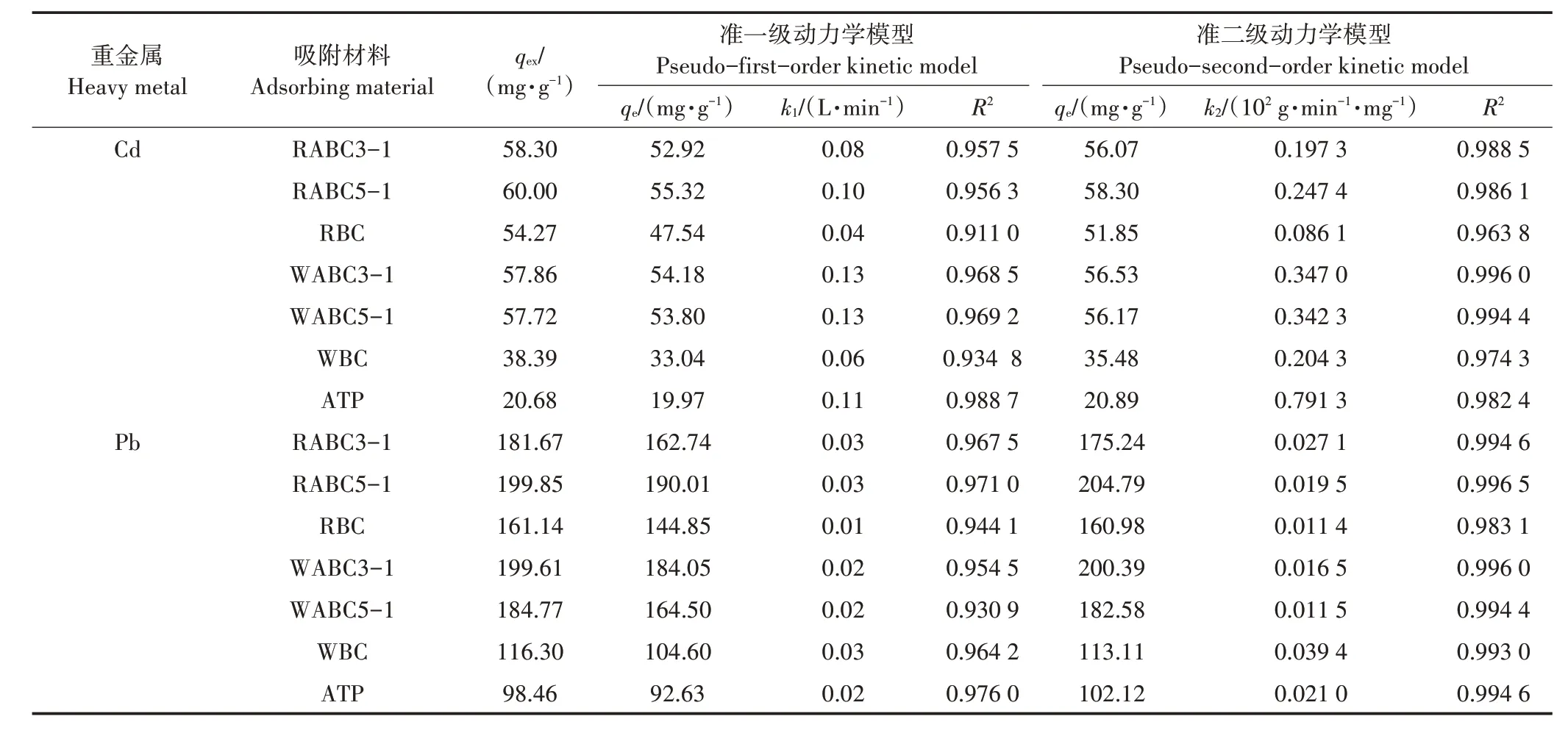
表2 吸附材料对Cd2+、Pb2+的吸附动力学方程拟合参数Table 2 Kinetic parameters of adsorption kinetics equations for Cd2+and Pb2+adsorption on different adsorbent materials
2.3 吸附等温线
不同吸附材料对Cd2+的吸附等温线如图2 所示,分别利用Langmuir 方程和Freundlich 方程对实验数据进行拟合,相应拟合参数列于表3。通过比较拟合参数可知,Langmuir等温吸附模型更好地拟合了复合材料对Cd2+、Pb2+的吸附平衡数据,这表明复合材料对Cd2+的化学吸附过程为单层吸附,并且吸附发生在复合材料内的特定均质位点[35]。进一步比较Langmuir模型中复合材料的qm可知,RABC5-1 与WABC3-1 对Cd2+的qm分别为132.97 mg·g-1与132.39 mg·g-1,相比原始生物炭与凹凸棒石的吸附量提高了48%以上,对Pb2+的吸附量分别为222.60 mg·g-1和220.55 mg·g-1,显著高于其他复合材料及原始材料(105.16~188.55 mg·g-1)。以上结果表明,复合材料RABC5-1与WABC3-1 对于Cd2+和Pb2+有着更佳的吸附潜能,是极具潜力的吸附材料。
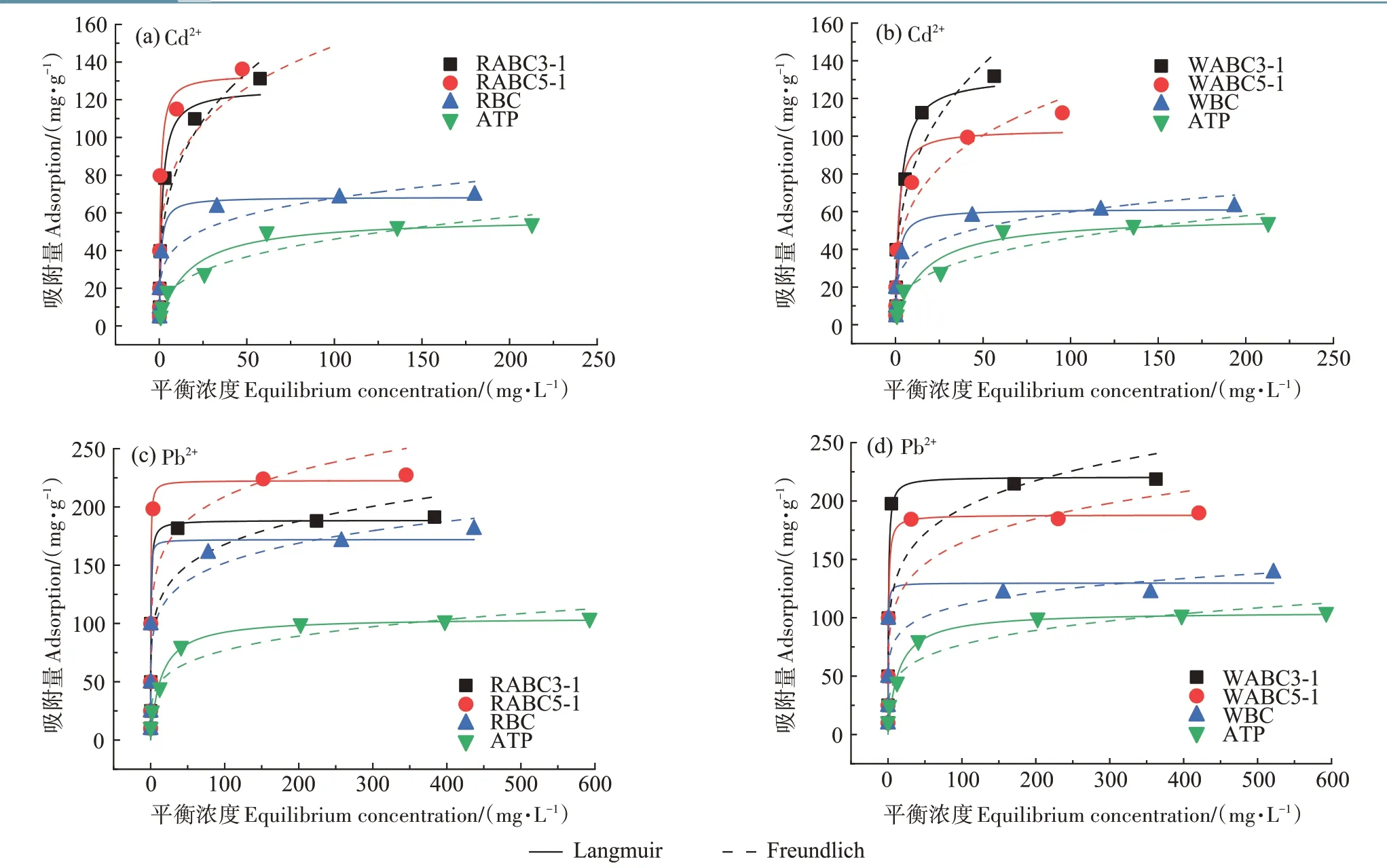
图2 吸附材料对Cd2+、Pb2+的等温吸附曲线Figure 2 Adsorption isotherms of Cd2+and Pb2+on different adsorbent materials
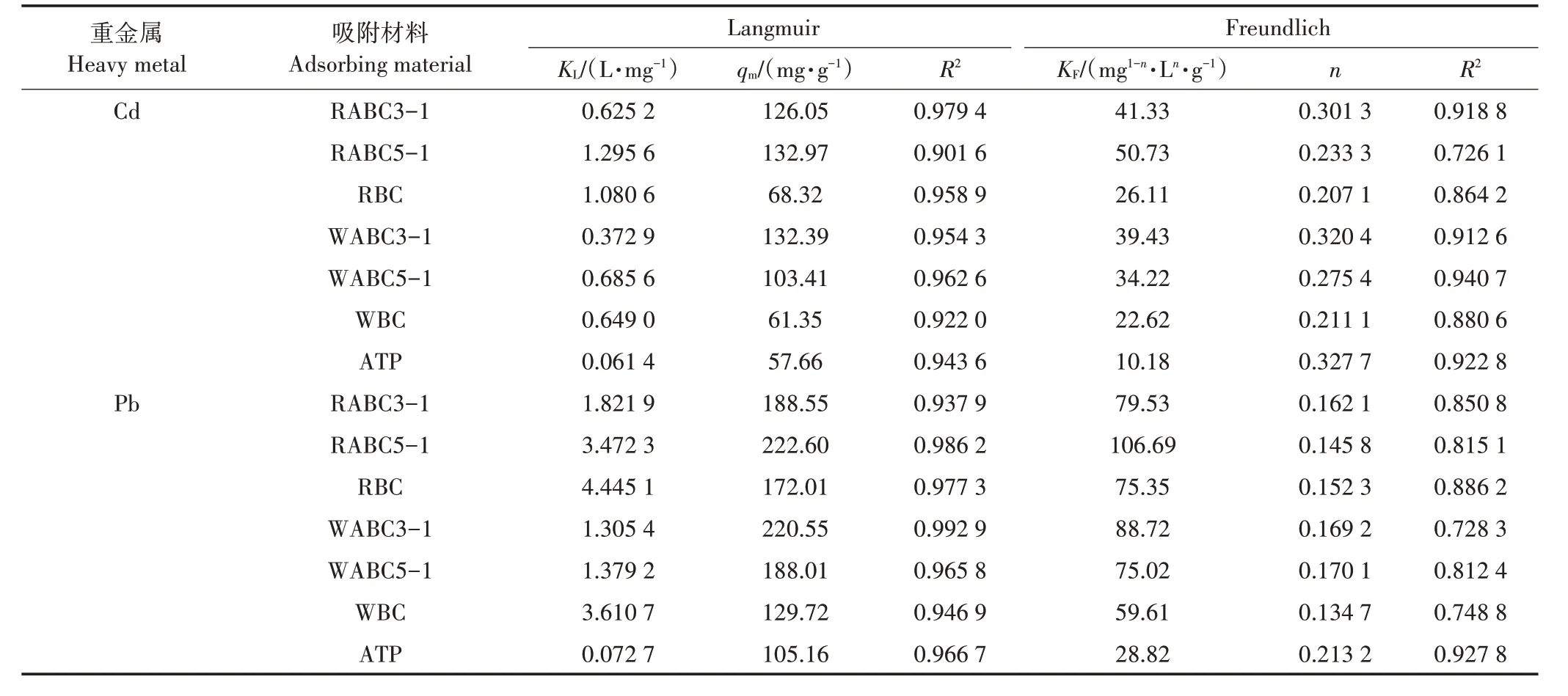
表3 吸附材料对Cd2+、Pb2+的等温吸附方程拟合参数Table 3 Adsorption isotherms parameters for Cd2+and Pb2+sorption on different adsorbent materials
2.4 pH对复合材料吸附Cd2+、Pb2+的影响
溶液的pH 是控制Cd2+和Pb2+吸附过程的一个重要参数,因为pH 会影响材料表面官能团的电离状态及重金属的离子化程度[36]。如图3 所示,当溶液的pH 为2 时,复合材料对Cd2+和Pb2+的吸附能力较差。当溶液pH 较低时,溶液中存在大量的H+,H+与重金属离子形成竞争吸附,占据了复合材料的活性吸附位点,从而抑制Cd2+和Pb2+的吸附。当pH 大于3时,复合材料对Cd2+和Pb2+的吸附量呈现大幅上升趋势,而当pH 为5~7 时,复合材料对Cd2+和Pb2+吸附量的变化随pH 的增大趋于平稳。这是由于复合材料与重金属之间的静电吸引力增加,并且表面官能团与重金属之间的络合作用逐渐成为复合材料吸附的主要机理。同时通过开展空白对照实验可知,含Cd2+或Pb2+的溶液在吸附平衡时的pH 低于不含Cd2+或Pb2+的空白系统。pH 的降低可能归因于Cd2+或Pb2+与官能团之间的络合作用释放了更多的H+,使得吸附平衡时pH 降低。
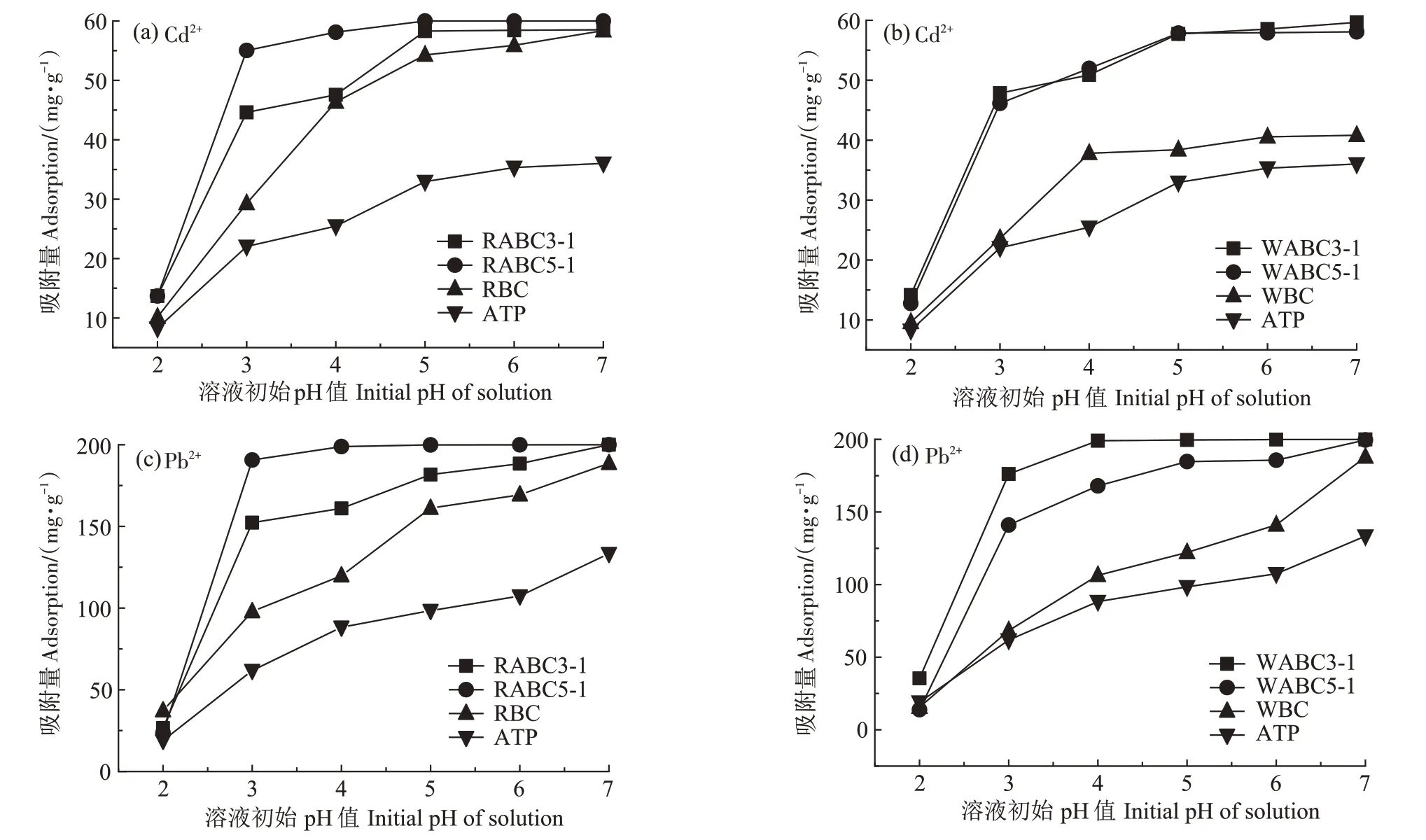
图3 pH对吸附材料吸附Cd2+、Pb2+的影响Figure 3 Effects of pH on Cd2+and Pb2+sorption by different adsorbent materials
Zeta 电位代表粒子与悬浮液中其他粒子相互作用的表面电荷特性。由图4 可知,Zeta 电位曲线呈水平S 形,具有两个明显的拐点,这与Zhang 等[37]的观察结果相似。通过实验结果分析发现RABC5-1 与WABC3-1 的零点电位分别为4.46 与4.65,在复合材料对Cd2+和Pb2+的吸附过程中,吸附剂表面带负电会导致静电吸引力提高,从而更有利于其吸附。
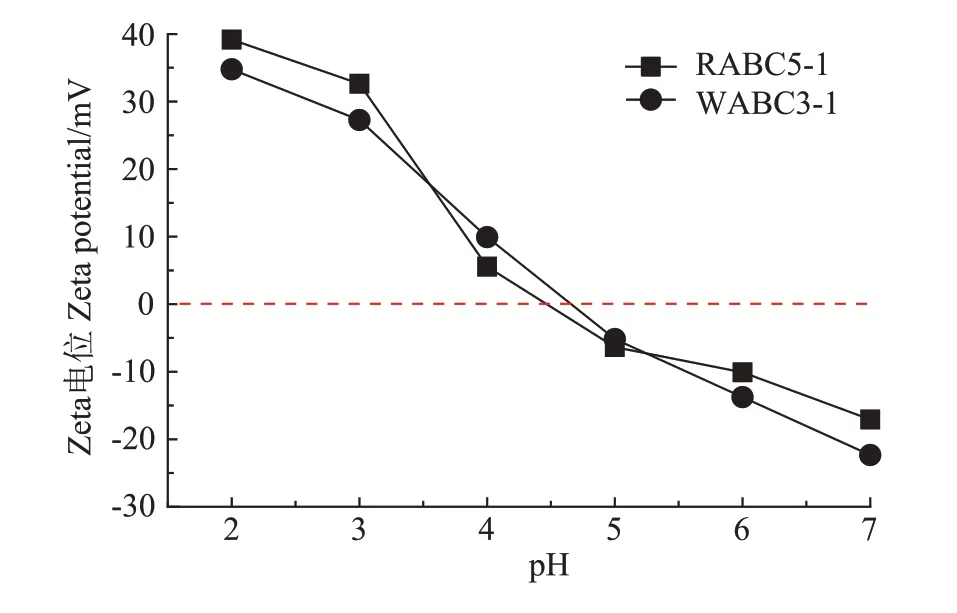
图4 复合材料的Zeta电位值Figure 4 Zeta potential of composite materials
2.5 吸附机制
2.5.1 沉淀作用扫描电镜(SEM)分析能够直观地反映复合材料吸附前后的表面微观结构。如图5 所示,复合材料表面呈现粗糙的多孔结构,且表面存在针状晶体及层状结构,这表明ATP 已成功负载到生物炭表面。同时,吸附Cd2+或Pb2+后,RABC5-1 和WABC3-1 表面出现颗粒状杂质,证明复合材料已成功吸附了重金属。

图5 复合材料吸附重金属前后的扫描电镜图Figure 5 Scanning electron microscopy of composite materials before and after the adsorption of Cd2+and Pb2+
复合材料RABC5-1与WABC3-1吸附Cd2+和Pb2+前后的X 射线衍射(XRD)谱图如图6 所示。在吸附前复合材料存在3个明显的特征峰,其中2θ=29.41°为CaCO3的特征峰,2θ=20.86°与2θ=26.64°均为SiO2的特征峰且与ATP 的晶体结构相吻合,相比原始生物炭,复合材料表面SiO2特征峰明显增多,这表明ATP成功负载到了生物炭表面。酸洗后,复合材料表面的Ca⁃CO3的特征峰消失,这证明酸洗后复合材料对Cd2+吸附量的降低是计算矿物沉淀作用的指标,这与Wang等[38]的研究结果一致。复合材料在吸附Pb2+后明显出现了新的衍射峰,说明生成了新的矿物相。RABC5-1 在2θ=19.85°、24.76°、34.16°和40.40°等处的衍射峰代 表Pb3(CO3)2(OH)2,WABC3-1 在2θ=20.87°、24.78°与25.43°等处的衍射峰归因于PbCO3沉淀。同样在吸附Cd2+后,2θ=23.49°、30.28°与36.42°等处的衍射峰也表明在复合材料上有CdCO3生成。此外在2θ=29.91°和30.18°处的衍射峰为Pb(OH)3Cl,这可能是Pb2+与溶解的Cl-共沉淀的产物。这些衍射峰均有明显的峰值,表明引入ATP后,复合材料在吸附过程中与Cd2+和Pb2+形成了沉淀化合物,且碳酸盐为主要沉淀物,从而增强了对溶液中Cd2+和Pb2+的去除,证明沉淀作用为复合材料吸附重金属离子的机理之一。
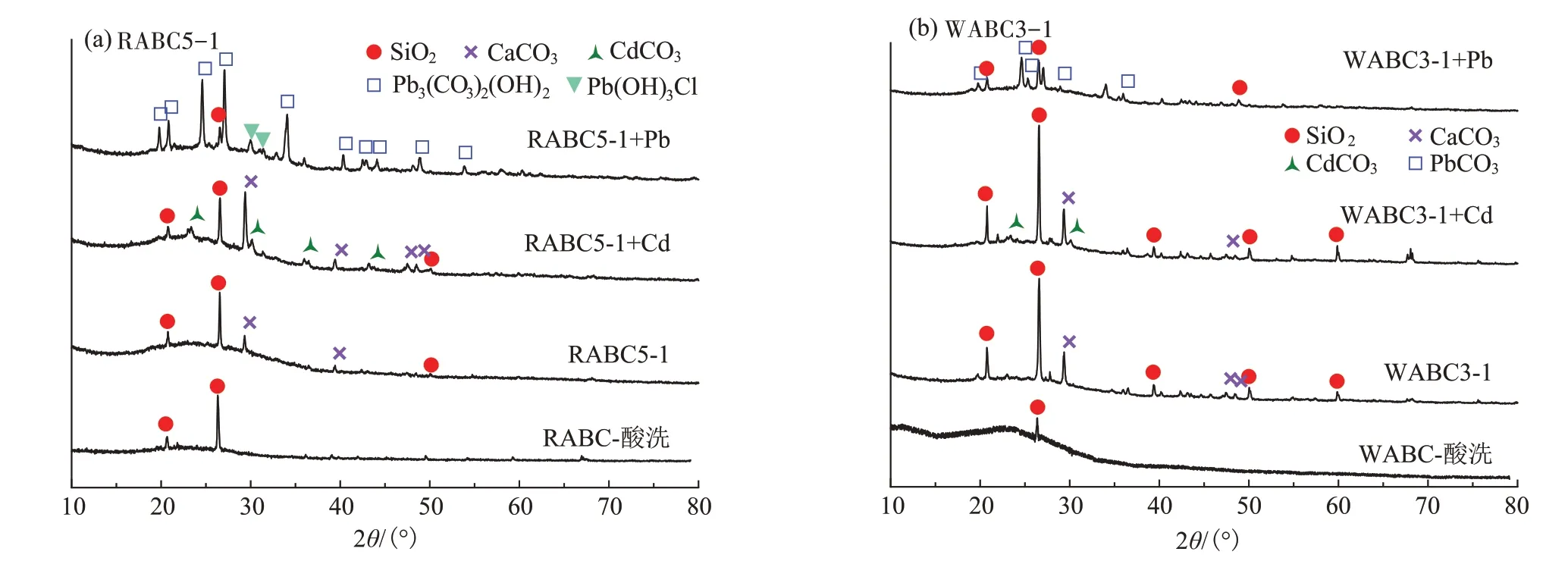
图6 RABC5-1与WABC3-1吸附重金属前后的XRD谱图Figure 6 XRD patterns of RABC5-1 and WABC3-1 before and after the adsorption of Cd2+and Pb2+
2.5.2 离子交换作用
金属离子(如K+、Na+、Ca2+、Mg2+)可以直接通过静电吸引作用与炭材料所含羧基和羟基形成复合物(如COOM、R OM)。这些金属可以在吸附过程中通过静电离子交换或形成表面络合物的金属交换反应与溶液中的Cd2+或Pb2+交换[31]。为了进一步说明离子交换作用,通过对比实验最终确定了不同吸附材料吸附Cd2+和Pb2+前后溶液中金属离子的净释放量。如表4 所示,Ca2+在复合材料的离子交换中均占有主导地位。其中Ca2+在RABC5-1 和WABC3-1 吸附Pb2+过程中的离子交换贡献率分别达到了84.1%、87.1%,吸附Cd2+的离子交换贡献率分别达到26.2%、48.4%。其次为Na+,在RABC5-1 和WABC3-1 吸附Pb2+过程中的离子交换贡献率分别达到了6.4%、11.3%,吸附Cd2+的离子交换贡献率分别达到46.7%、39.4%。研究显示,单价阳离子主要与静电离子交换形成的表面络合物有关,而二价阳离子则主要来源于表面官能团的络合作用[39]。
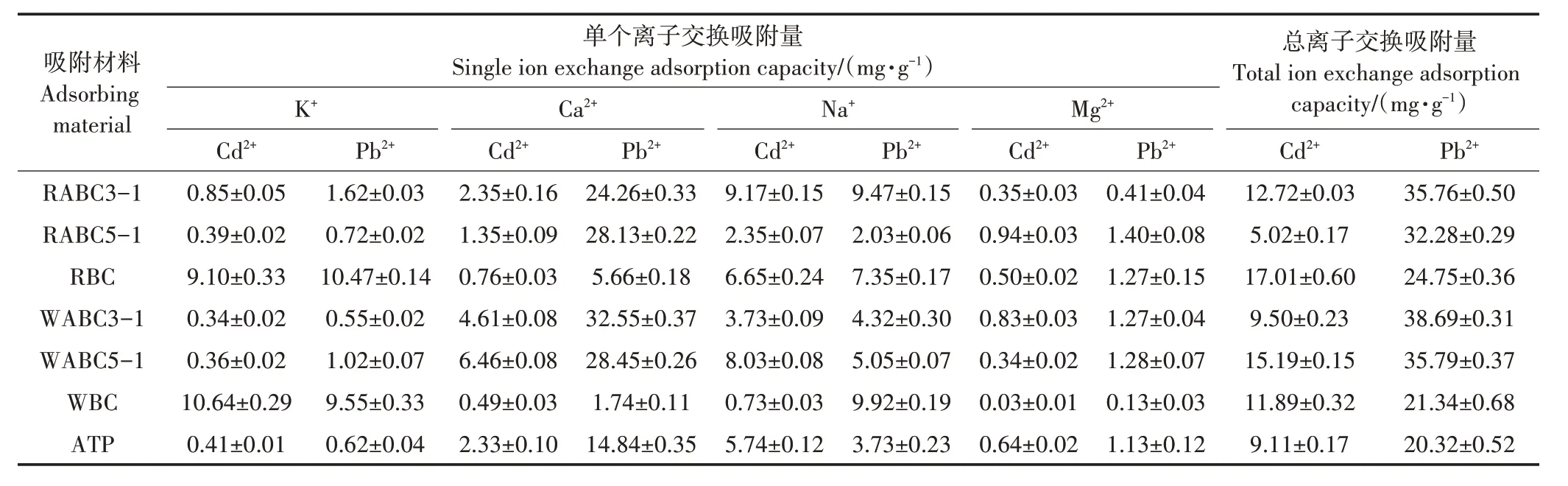
表4 复合材料吸附重金属前后溶液中金属离子的净释放量Table 4 Adsorption capacity of composite materials on Cd2+and Pb2+in solution through ion exchange
2.5.3 含氧官能团的表面络合作用
利用傅里叶变换红外光谱(FTIR)研究了吸附Cd2+和Pb2+前后复合材料RABC5-1 和WABC3-1 表面官能团的差异。如图7 所示,吸附前后峰位置大致相同,这表明复合材料所含官能团种类未发生变化,但不同官能团峰值不同,表明官能团含量发生了改变。吸附Cd2+和Pb2+后,在波长3 315 cm-1(RABC5-1)和3 339 cm-(1WABC3-1)处对应羟基(OH)延伸振动的吸收峰显著降低,这表明Cd2+和Pb2+可能通过与羟基络合从而吸附在复合材料表面。在2 887 cm-1(RABC5-1)和2 883 cm-(1WABC3-1)及其附近的脂肪族(CH2)延伸振动峰峰值降低,说明CH2基团可能参与了吸附。此外CO延伸振动,芳香族CC振动(1 625、1 614 cm-1),CO 延伸振动峰(1 014、1 017 cm-1)、羧基(COOH)和醛基(CHO)(1 412、1 422 cm-1)及芳香族CH 变形振动峰(796、876、880 cm-1)[40]在吸附前后的峰强度同样发生了变化。上述结果表明,凹凸棒石的存在使得复合材料表面含有更多含氧官能团,多种官能团如羧基、羰基及C O基团等通过络合作用增强了复合材料对Cd2+和Pb2+的吸附能力。
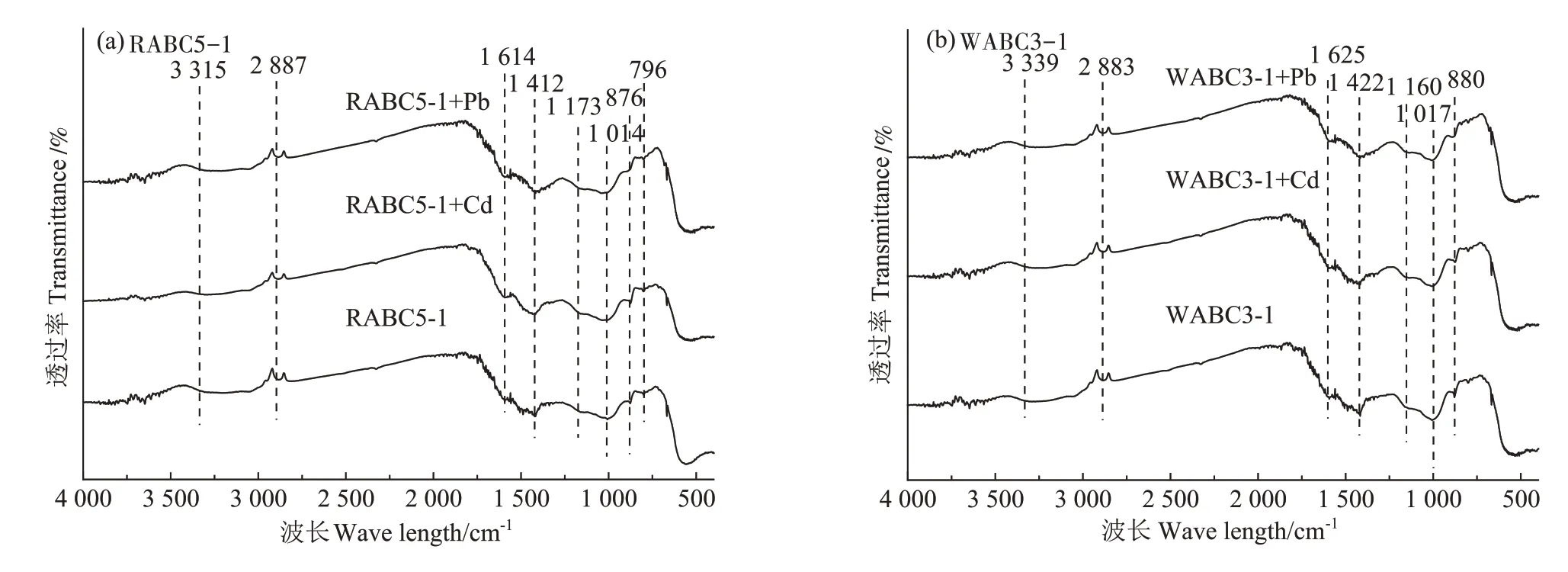
图7 RABC5-1与WABC3-1吸附重金属前后的红外光谱图Figure 7 FTIR spectra of RABC5-1 and WABC3-1 before and after the adsorption of Cd2+and Pb2+
2.5.4 π电子的配位作用
阳离子-π 相互作用也是生物炭吸附重金属的重要机理。在高温条件下,复合材料形成了更多的芳香结构,使得复合材料的芳香性增强。环状芳香族π系统可以作为π-供体,并且随着缔合环数目的增加,给电子能力变得更强[41]。有研究证明芳香基团如呋喃的γ-CH 和吡啶的β-环通过贡献π 电子容易与Cd2+结合[42]。由吸附Cd2+和Pb2+前后复合材料的红外光谱分析可知,复合材料的芳香族C H 基团(400~700 cm-1)在吸附后强度降低,峰宽变宽,这表明复合材料中可能发生了Cd2+、Pb2+与π电子的配位。
2.5.5 Cd2+、Pb2+吸附机制的相对贡献
根据原始和脱矿吸附材料对Cd2+和Pb2+的吸附情况,本研究总结了4 种不同吸附机制对总吸附的相对贡献(图8)。由图8 可知,不同吸附材料在吸附重金属的过程中,矿物沉淀作用对总吸附的贡献率均占50%以上。其中RABC5-1和WABC3-1在吸附Cd2+过程中沉淀作用对于总吸附的贡献率分别为84.6%与77.3%,明显高于其他吸附材料。同时在吸附Pb2+过程中,RABC5-1 和WABC3-1 的沉淀作用占比分别为82.0%与78.3%,结合吸附容量分析,证明沉淀作用是复合材料吸附重金属的主要机理。阳离子交换也在复合材料对Cd2+和Pb2+的吸附机制中发挥了重要作用,RABC5-1和WABC3-1对Cd2+的贡献率分别为8.5%和16.4%,对Pb2+的贡献率分别为16.3%和19.2%。在凹凸棒石材料吸附过程中,官能团络合作用分别占Cd2+和Pb2+总吸附量的17.1%和16.7%,是凹凸棒石吸附重金属的重要机制之一。然而对于生物炭及其复合材料,官能团络合作用所占比例较小,这是由于热解过程导致了炭材料表面官能团含量的降低。综上所述,阳离子交换作用和沉淀作用是主要的吸附机制,而官能团络合作用和阳离子-π作用虽然起到一定作用,但整体贡献率较小。
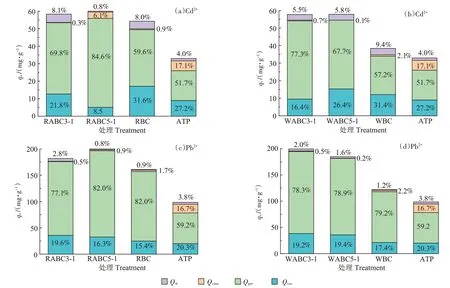
图8 复合材料对Cd2+、Pb2+吸附量及各吸附机理的相对贡献Figure 8 Adsorption capacity and relative contribution of each adsorption mechanism during the adsorption of Cd2+and Pb2+
3 结论
(1)采用同时炭化活化法制备了一种新型生物炭/凹凸棒石复合材料,相比原材料,复合材料的比表面积明显提高,同时稻秆与凹凸棒石5∶1配制的复合材料(RABC5-1)与麦秆与凹凸棒石3∶1 配制的复合材料(WABC3-1)对Cd2+和Pb2+的吸附效果最佳,吸附量在132 mg·g-1与220 mg·g-1以上,证明复合材料RABC5-1 与WABC3-1 是极具潜力的吸附材料。
(2)吸附实验拟合表明,复合材料对Cd2+与Pb2+的吸附过程符合准二级动力学模型和Langmuir 等温吸附模型,证明复合材料的吸附过程以化学吸附为主,且为单层吸附。复合材料对Cd2+与Pb2+的吸附容量与溶液初始pH成正比。
(3)复合材料表面的羧基、羰基等含氧官能团通过络合作用增强了复合材料对Cd2+和Pb2+的吸附能力。机理定量分析表明,RABC5-1 和WABC3-1 在吸附过程中,沉淀作用对总吸附的贡献率均在75%以上,明显高于其他吸附材料,且沉淀作用与其吸附量成正比,证明沉淀作用是复合材料吸附重金属的主要机制。

