全氟丁烷磺酸对其耐受菌胞外聚合物特征的影响
余果,孙丽娜,唐蕊,韩悦
(沈阳大学环境学院区域污染环境生态修复重点实验室,沈阳 110044)
全氟化合物(Perfluorinated compounds,PFCs)是指烷基链上的氢原子全部被氟原子取代的一类人工合成的新型持久性有机污染物,由全氟磺酸类(Per⁃fluoroalkyl sulfonic acids,PFSAs)和全氟羧酸类(Per⁃fluoroalkyl carboxylic acids,PFCAs)的离子型全氟化合物(Perfluoroalkyl acids,PFAAs)和非离子型全氟化合物(Non-ionic PFCs)组成[1]。长期以来,长链全氟化合物(含有7 个以上全氟烷基碳的PFCAs 和6 个以上全氟烷基碳的PFSAs)被广泛应用于纺织、不粘式炊具、食品包装、泡沫灭火剂及地毯保护剂等消费品的生产过程[2],全氟辛烷磺酸(PFOS)和全氟辛酸(PFOA)也成为环境中主要检出的全氟化合物[3-4]。由于具有环境持久性、高毒性、生物富集性和污染广泛等特点,PFOA 和PFOS 分别于2017 年和2009 年被列入《斯德哥尔摩公约》,并对其生产和使用进行了全球限制和严格管控。
全氟丁烷磺酸(Perfluorobutanesulfonic acid,PFBS)是碳原子数为4 的一种短链PFCs,与碳原子数为8的PFOS具有相似的元素组成及物理结构(图1),PFBS 无明显生物积累性,在人体中的半衰期较短[5]。因此,在2009 年PFOS 及其衍生物被列入国际斯德哥尔摩公约的背景下,PFBS被广泛作为PFOS的替代品而大量使用,导致PFBS 在垃圾填埋场[6]、地下水[7]、河流水[8]和市政污水[9]、污泥[10]、土壤[11]等环境中被频繁检测到。PFBS 对人体的脏器[12]、免疫[13]、神经[14]、生殖[15]及发育系统[16]等具有毒害作用,特别是PFBS 的水溶性(42 g·L-1)远高于PFOS(591 mg·L-1)[17],其较高的环境持久性和流动性使其具有比PFOS更高的全球污染潜力[18],2020 年1 月16 日PFBS 及其盐类正式被添加到高度关注物质(SVHC)候选物质中,因此PFBS的环境污染问题值得我们关注。
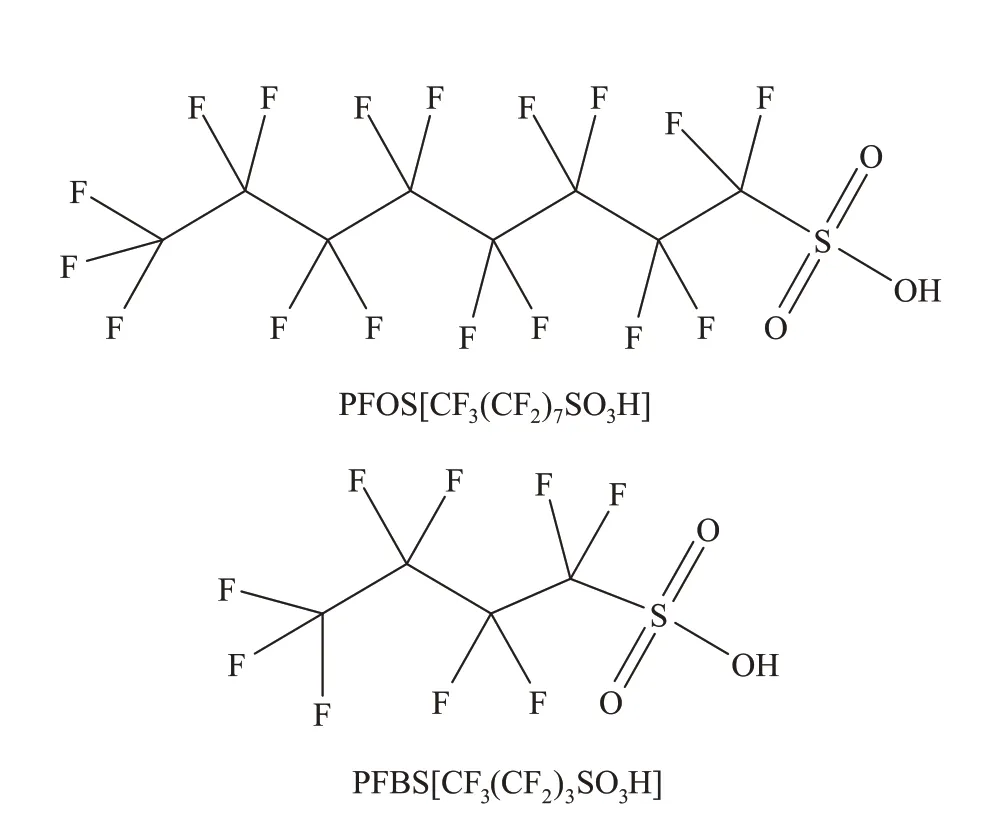
图1 PFOS和PFBS结构式Figure 1 The structure of PFOS and PFBS
环境污染微生物修复以其易操作、成本低和环境友好的特点而受到广大研究者的关注。胞外聚合物(Extracellular polymeric substances,EPS)是在特定生长条件下由微生物分泌、并附着在细胞表面或周围的多聚化合物,主要由蛋白质、多糖、核酸和脂质等大分子物质组成。EPS 在微生物缺乏营养时即可作为碳源物质被利用,为微生物生存活动提供能量[19];也可以帮助微生物抵御外界不良环境,提高微生物对有毒环境的耐受性[20]。污染物的存在可以诱导微生物产生更多的EPS 来抵御外界不良环境[21],EPS 对环境污染物的去除具有重要作用[22],但PFCs 对微生物产生EPS的影响具有很大的不确定性。Weathers等[23]研究发现PFCs 会诱导微生物分泌更多的EPS,从而抵御有毒物质进入细胞,保障微生物的生长和繁殖[23];而Chen等[24]研究发现PFOS的添加会导致EPS中类蛋白质和类腐植酸的浓度显著下降;唐琳钦等[25]研究发现添加PFOS 和PFOA 会降低污泥EPS 中色氨酸的含量。Yan等[26]研究发现EPS中色氨酸和酪氨酸两种组分的浓度与添加的PFOA 浓度呈负相关。目前相关研究主要集中在长链PFCs 对EPS 的影响上,而短链PFCs对EPS的影响研究较为鲜见。
基于此,本文从阜新某氟化工污水处理厂污泥中分离出两种PFBS 耐受菌株,通过实验和三维荧光光谱(Three-dimensional fluorescence spectrum,3D-EEM)分析,研究了100 μg·L-1PFBS 胁迫下两种菌株的生长量与代谢活性和EPS 产量、组成特征及其对PFBS的去除作用,并运用傅里叶红外光谱(Fourier trans⁃form infrared spectroscopy,FTIR)进一步分析了EPS官能团的变化,以期为PFBS 污染的微生物EPS 去除机理提供新的认识。
1 材料与方法
1.1 实验材料
1.1.1 耐受菌筛选所用污泥
筛选菌种所用的污泥采自辽宁省阜新市某氟化工污水处理厂的浓缩污泥,采集时间为2020年9月28日。
1.1.2 实验仪器和主要试剂
HITACHI F-4600 荧光光度计、Thermo NICOLET 380 傅里叶红外光谱仪、Elementar Liqui TOC 总有机碳分析仪、SUPELCO Visiprep™SPE 真空固相萃取装置、Thermo TSQ ENDUR 三重四极杆质谱仪、Dionex UltiMate 3000 高 效液相色谱 仪。PFBS(2 000 ng·mL-1,≥99%)与内标(MPFAC-MXA,2000 ng·mL-1,≥99%)均 购 自Wellington Laboratories 公 司,甲 醇(HPLC)和乙酸铵(HPLC)购自上海安谱实验科技公司,WAX-SPE 固相萃取柱购自Suplco 公司。本试验采用富集培养基:NH4NO35 g·L-1、NaCl 2 g·L-1、KH2PO41 g·L-1、K2HPO41 g·L-1、MgSO4·7H2O 0.5 g·L-1、CaCl2·2H2O 0.05 g·L-1、酵母粉1 g·L-1,分别加入10、20、30、40 mg·L-1和50 mg·L-1的PFBS,pH 7.0。无机盐培养基:NH4NO35 g·L-1、NaCl 2 g·L-1、KH2PO41 g·L-1、K2HPO41 g·L-1、MgSO4·7H2O 0.5 g·L-1、CaCl2·2H2O 0.05 g·L-1,pH 7.0。LB培养基:蛋白胨10 g·L-1、NaCl 10 g·L-1、酵母粉5 g·L-1,调节pH 至7.0,固体培养基调节pH后再加入5 g·L-1琼脂粉。
1.2 实验方法
1.2.1 菌株的分离和纯化
取10 g 污泥接种于200 mL 富集培养基中,在30 ℃和130 r·min-1的振荡条件下培养。每隔7 d,将5%的培养液转接到新的富集培养基中,逐渐升高PFBS 的浓度至50 mg·L-1,驯化结束。将10 mL 驯化后的培养液转接到90 mL以50 mg·L-1PFBS为唯一碳源的无机盐培养基中。通过连续4次转接进行富集和筛选。取1 mL最终培养液用无菌水梯度稀释后,分别涂布于含50 mg·L-1PFBS的琼脂平板上,放入30 ℃培养箱中培养,待平板上长出明显菌落时,挑选生长状态较好的菌落进行划线纯化为单一菌落(共纯化4 次),纯化后的菌株在-20 ℃的15%甘油中保存[27]。
1.2.2 生长量
将单株菌按2%接种量接种到浓度为100 μg·L-1PFBS 的50 mL 无机盐培养基中,在30 ℃条件下以130 r·min-1振荡培养,第1天分别在0、4、8 h和12 h各取样1 次,从第2 天开始每天取样1 次,净培养(不包括取样时间)7 d 结束培养。实验设置CK 对照组(PFBS 浓度为0 μg·L-1的无机盐培养基)及3 组平行(包括CK 组),选用2 mL 比色皿取1.5 mL 培养液,以蒸馏水为对照,测定生长量(OD600)[28]。
1.2.3 代谢活性(ETSA)
取0.5 mL 培养液与1 mL 0.2%的INT(氯化碘硝基四氮唑)溶液混合,避光反应20 min 后加入50 μL甲醛终止反应,1 000 r·min-1离心5 min,去上清。沉淀用1 mL 96%的甲醇重悬,混匀使之完全溶解。1 000 r·min-1离心5 min,去除菌体对吸光度的干扰。测定495 nm 处的吸光值,以7 mL 96%甲醇加2 mL 0.2%INT作为空白[28]。
ETSA(A,μg·g-1·d-1,以O2计)的计算公式:
式中:S为样品体积;t为反应时间;Ab为吸光度;V为用来重悬的甲醇体积;32/2 为常数;15.9 为摩尔吸光度。
1.2.4 菌种鉴定
将纯化后的菌株转接到LB 培养基中,30 ℃培养2 d,观察菌落形态,并委托生工生物工程(上海)股份有限公司进行16S rDNA 鉴定。通过NCBI 基因库中(http://blast.ncbi.nlm.nih.gov/Blast)Blast 已知菌株的16S rDNA 序列与16S rDNA 测序结果进行同源性比较,选取相似性较高的序列,利用CLUSTAL-X 软件将选取的序列与菌株序列进行多序列比对,对齐所得序列,基于邻接法(Neighbor-joining)通过MEGA7 软件构建系统发育树[29]。
1.2.5 EPS提取与分析
取生长到稳定期的菌体培养液,8 000 r·min-1离心4 min,除去上清液后补充无菌水至原体积,再8 000 r·min-1离心4 min,除去上清液,补充适量无菌水制备成菌悬液。将上述菌悬液放入60 ℃的水浴锅中加热30 min,然后样品于12 000 r·min-1离心5 min,上清液经过0.45 μm 滤膜过滤后,得到的无色透明溶液即为EPS溶液[30]。
用总有机碳分析仪测定EPS 中有机碳(TOC)浓度。通过标准曲线计算出EPS 中TOC 的浓度,EPS 产生量用TOC 浓度作为量化指标,采用硫酸-苯酚法测定多糖的浓度,采用改良的Lowry 法测定EPS 中蛋白质的浓度[31]。
将提取的EPS 溶液进行三维荧光测定。荧光光度计参数设定:发射扫描波长(Em)250~650 nm,激发扫描波长(Ex)200~550 nm,激发和发射狭缝宽度为5 nm,扫描速度为12 000 nm·mL-1,响应时间为自动方式,扫描光谱进行仪器自动校正[30]。
将提取好的EPS经真空干燥(-60 ℃,24 h),取适量的粉末用NICOLET 380 傅里叶红外光谱仪进行测试,分辨率4 cm-1,扫描次数32 次·min-1,测定范围4 000~500 cm-1[30]。
1.2.6 PFBS提取与分析
将单株菌按2%接种量接种到PFBS 浓度为100 μg·L-1的30 mL 液体无机盐培养基中,在30 ℃条件下以130 r·min-1振荡培养4 d 后,取样分析。将固相萃取柱安装于固相萃取装置后,分别使用2 mL 质量分数为0.1%的氨水/甲醇溶液,2 mL 甲醇溶液,2 mL Milli-Q水进行活化。
取2 mL待测菌液和250 μLρ=20 ng·mL-1的PFCs内标液(n=5 ng)置于WAX-SPE 中,流速控制在约1滴·s-1。待全部样品通过WAX-SPE 后,加入4 mLρ=25 mmol·L-1醋酸铵缓冲液进行洗杂。之后用2 mL甲醇溶液和2 mL 质量分数为0.1%的氨水/甲醇溶液进行洗脱,洗脱液收集于15 mL 康宁离心管内。洗脱液于40 ℃水浴加热,氮气速度调节至洗脱液表面有微小旋涡,浓缩至0.5 mL,再加入0.5 mL甲醇溶液,定容至1 mL。提取液通过0.22 μm 滤膜后置于2 mL 棕色进样瓶内,4 ℃保存。用Thermo TSQ ENDUR 高效液相色谱-质谱联用仪(UPLC-MS-MS)测定PFBS 浓度[32]。UPLC 系统色谱条件为进样量10 μL;流速0.3 mL·min-1;流动相:5 mmol·L-195%甲醇-乙酸铵(A),5 mmol·L-1乙酸铵(B);梯度洗脱条件:0 min,20%B;1.5 min,40% B;1.5~9 min,95% B;9~12 min,80% B,将柱平衡3 min。质谱条件:SRM 负离子模式;喷雾电压3 000 V;护套气体压力50 Arb;辅助气体压力10 Arb;雾化器温度350 ℃;离子传递管温度度350 ℃。Q1 分 辨 率0.7;Q3 分 辨 率0.7;CID 碰 撞 能 量2.0 mTorr。回收率范围为92.2~94.41%,检出限为1.12 ng·L-1,定量限为3.74 ng·L-1。
1.3 数据处理
实验数据结果以平均值±标准偏差表示。通过Excel 2021和Origin pro 2020对数据进行计算和绘图。
2 结果与讨论
2.1 PFBS耐受菌株的筛选与鉴定
2.1.1 PFBS耐受菌株的筛选
(1)菌株的培养特征
将从污泥中经过梯度压力驯化和富集培养后的菌液按不同浓度梯度涂布在含PFBS的无机盐固体培养基上,培养48 h 后,用接种环挑选长势良好的菌落进行画线,挑取单菌落,重复上述步骤4 次后,分离出两株菌落形态一致且以PFBS 为唯一碳源的耐受菌(图2),分别命名为H1菌和B2菌。H1菌在培养基上呈淡黄色,是边缘规则、表面光滑、隆起的半透明圆形菌落;B2 菌在培养基上呈乳白色,是边缘规则、表面光滑、隆起的不透明圆形菌落。
图2 菌株的形态Figure 2 Morphology of the strain
(2)菌株的生长量
H1菌和B2菌的OD600曲线如图3所示,OD600的值可以指示菌株的生长量。从图3 可以看出,H1 菌在0~8 h内处于快速增长期,1 d后进入稳定生长期。与H1菌对比,B2菌不但快速生长期更长(0~2 d)而且在第二天生长量达到最大后明显下降,再缓慢上升。与CK 对比,添加100 μg·L-1PFBS 虽然没有改变两种菌的生长周期,但两种菌的生长量均有不同程度的提高,H1 菌平均提高了19.97%,B2 菌提高了7.94%,表明PFBS 对H1 菌的促进作用更明显。该结果与有些研究的结果不同:Li 等[33]研究了添加PFOS 为5、10 mg·L-1和20 mg·L-1时对枯草芽孢杆菌生长的影响,结果表明添加PFOS 后OD600值下降,PFOS 添加对枯草芽孢杆菌的生长有抑制作用;Zheng 等[34]的研究也表明,PFOS 为10、20 mg·L-1和40 mg·L-1时对枯草芽孢杆菌的生长有抑制作用,枯草芽孢杆菌的OD600值随PFOS 浓度的增加而降低。这可能与实验中添加的PFOS浓度差异较大有关,或与菌种不同有关,尚需进一步实验验证。
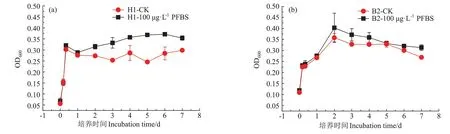
图3 H1菌和B2菌生长量曲线Figure 3 The growth curves of H1 and B2 strain
(3)菌株的代谢活性
H1 和B2 菌的ETSA 曲线如图4 所示,ETSA 的值可以指示菌株的代谢活性。由图4 可知,H1 菌的ET⁃SA 的变化趋势基本与OD600一致,ETSA 在0~8 h 快速增长,在8 h 达到最大值后迅速下降,之后趋于稳定。与CK 处理对比,在100 μg·L-1PFBS 胁迫下H1 菌的代谢活性受到明显的促进,平均提高了59.69%。但与H1 菌相反(图4b),PFBS 的添加会抑制B2 菌的代谢活性,其ETSA比CK处理平均降低了4.71%。
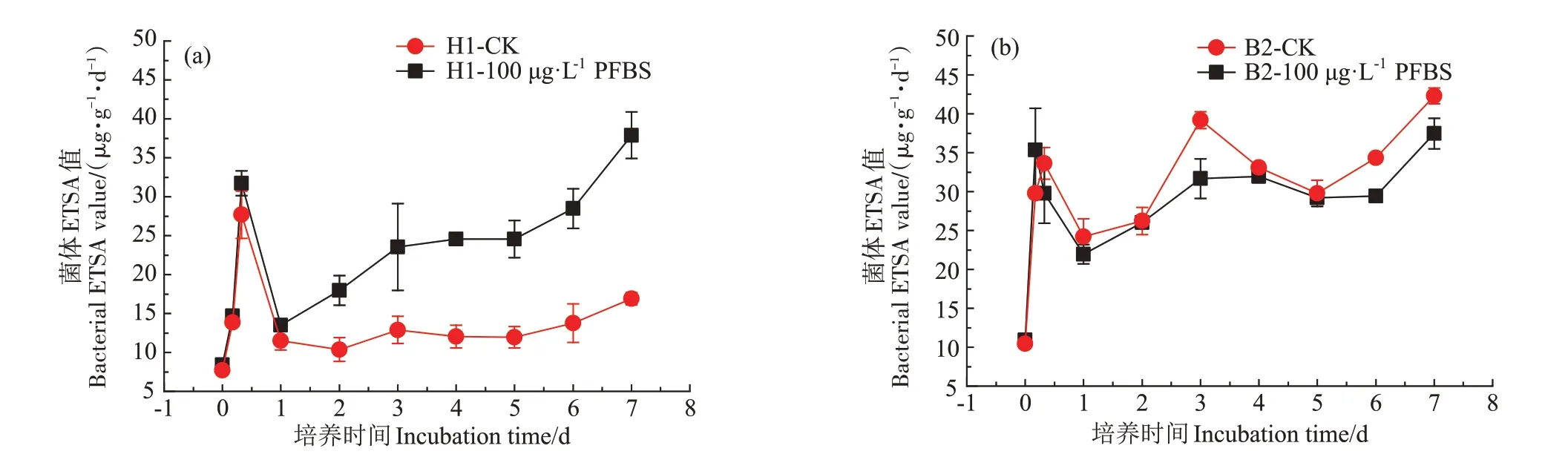
图4 H1菌和B2菌代谢活性曲线Figure 4 Metabolic activity curves of H1 and B2 strain
2.1.2 菌株的鉴定
委托生工生物工程(上海)股份有限公司分别对H1菌和B2菌进行16S rDNA测序,并将所得测序结果与NCBI 基因库中(http://blast.ncbi.nlm.nih.gov/Blast)序列进行比对,选择相似性不小于98%的序列,使用MEGA7 构建系统发育树(Neighbor-Joining 法),结果如图5所示。菌株H1的碱基对个数为1 429 bp,菌株B2 的碱基对个数为1 364 bp。通过系统发育树分析可知,H1 菌与假单胞菌亲缘性较高,与Pseudomonas aeruginosaNCTC 13628(ON359917)的16S rDNA 基因序列有100%的相似性,判定其为Pseudomonas(假单胞菌属),推测为Pseudomonas aeruginosa(铜绿假单胞菌);B2菌与沙雷氏菌亲缘性较高,与Serratiasp.BZL(KT001067)的16S rDNA 基因序列有99.93%的相似性,判定其为Serratia(沙雷氏菌属),推测为Serratia nematodiphila(嗜线虫沙雷氏菌)[35-38]。
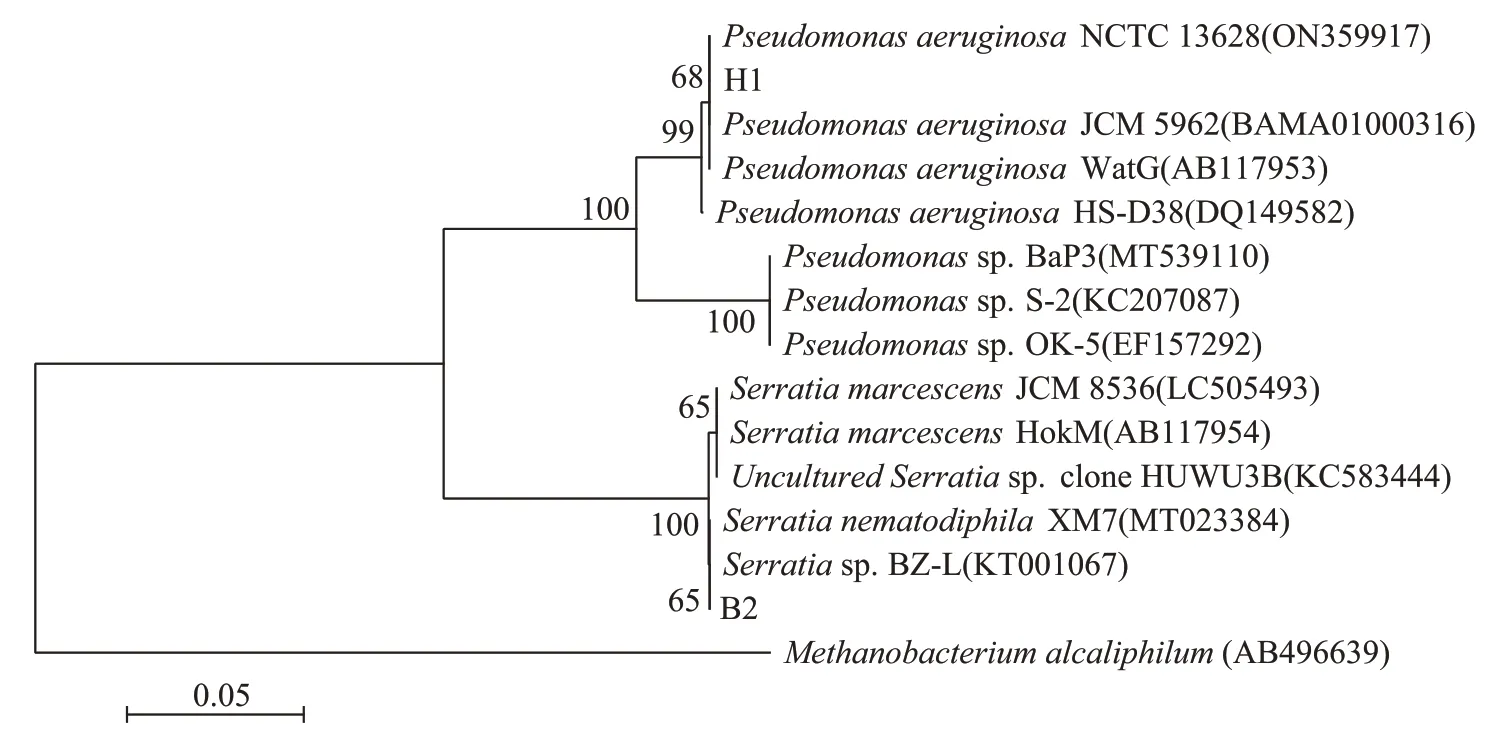
图5 菌株系统发育树Figure 5 Phylogenetic tree of strains
2.2 PFBS胁迫下耐受菌株EPS产量及其对PFBS的去除作用
从图6 可以看出,加入PFBS 后H1 菌和B2 菌的EPS 产量减少,与CK 组相比,H1 菌从21.13 mg·L-1降低为14.76 mg·L-1(下降了30.17%),B2 菌从35.29 mg·L-1变为28.44 mg·L-1(下降了19.41%),表明在100 μg·L-1PFBS胁迫下这两种菌分泌EPS受到抑制。H1 菌和B2 菌在接种量为2%时,4 d 后对100 μg·L-1PFBS 的去除率分别为33.18%和19.95%,与B2 菌对比,H1 菌的去除效果更好,这可能与H1 的生长周期短、以及100 μg·L-1PFBS 处理对H1 菌生长量和代谢活性的促进作用更明显有关。Yi 等[27]将从全氟化合物生产厂附近土壤中分离到的Pseudomonas parafulva(副黄假单胞菌)YAB1,在30 ℃、pH 7.0、2%接种量下培养96 h,发现其对500 mg·L-1PFOA 的降解率为32.4%。赵淑艳等[29]研究发现在温度为30 ℃、pH 为7.0~7.2 条件下,生丝微菌(Hyphomicrobium)PF1 对PFOSA 和N-EtFOSA 的降解率分别为14.6%和8.2%。对比前人的研究结果,本研究的H1 菌能在中性条件下有效去除短链全氟化合物PFBS,在短链全氟类化合物污染修复应用中具有一定的竞争优势。
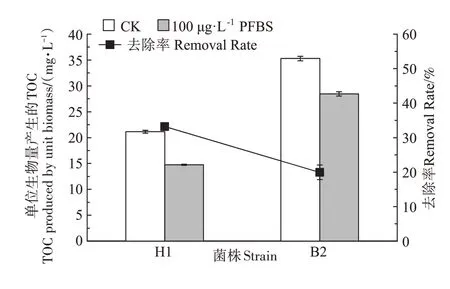
图6 H1菌和B2菌的EPS产生量及去除率Figure 6 EPS production and removal rate of H1 and B2 strain
2.3 PFBS胁迫下耐受菌株EPS组成特征
从H1 菌和B2 菌的EPS 组分变化(图7)可以看出,两种菌的EPS 主要成分为蛋白质。与CK 处理相比,在100 μg·L-1PFBS 胁迫下,两种菌EPS 中蛋白质和多糖的浓度均降低,H1 菌的EPS 中蛋白质浓度从20.42 mg·L-1降低到17.08 mg·L-1(下降了16.37%),多糖浓度从2.73 mg·L-1降低到1.78 mg·L-1(下降了34.80%);B2 菌的EPS 中蛋白质浓度从30.21 mg·L-1降低到26.67 mg·L-1(下降了11.72%),多糖浓度由13.81 mg·L-1降低到9.35 mg·L-1(下降了32.30%)。与B2菌对比,H1菌EPS中的蛋白质、多糖降低更多。添加PFBS后,H1菌的EPS中蛋白质/多糖的比值从7.48升高到9.58,B2 菌的比值由2.19 升高到2.85,分别升高了28.07%和30.14%。这可能是因为EPS是细胞代谢产生的,在营养物质缺乏的情况下,为了维持代谢活动,微生物会消耗存储在EPS中的多糖并分泌酶蛋白,使EPS 中蛋白质浓度增加进而导致蛋白质/多糖的比值增大[39]。但Lu 等[40]的研究表明,在PFOS 浓度为10 μg·L-1时,蛋白质浓度升高,多糖浓度降低,而在PFOS 浓度为1 000 μg·L-1时,EPS 中蛋白质的浓度比对照组降低了35.34%,多糖浓度提高了18.29%。由此可见,PFCs 的浓度会对EPS 的组成产生相反的影响。
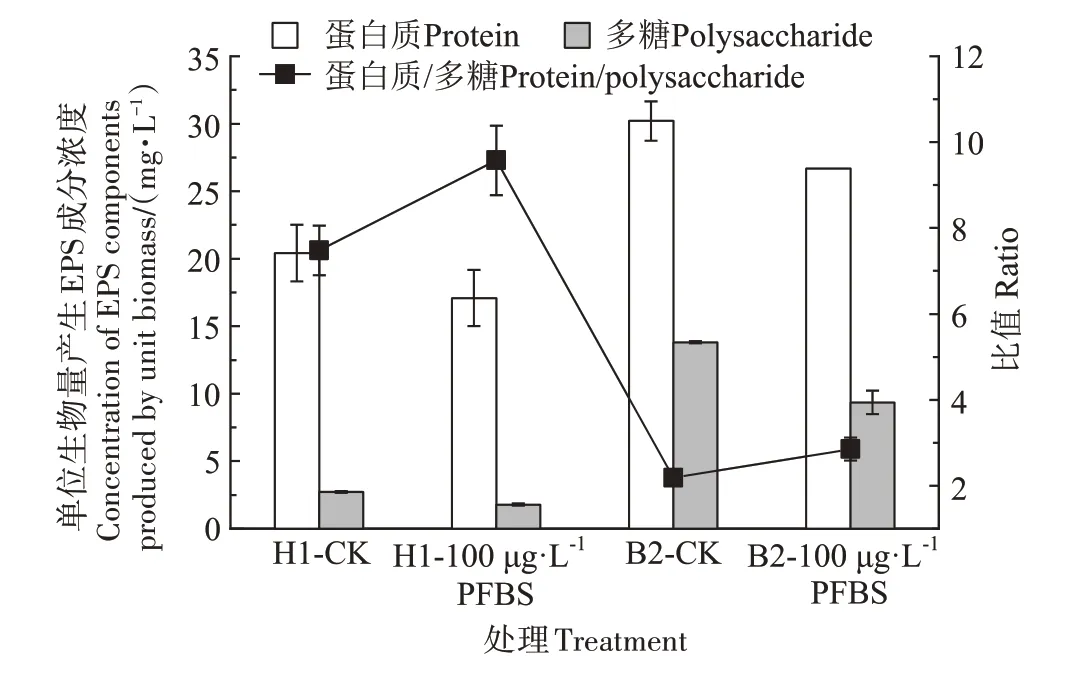
图7 H1菌和B2菌的EPS组分含量Figure 7 Contents of EPS components of H1 and B2 strain
2.4 菌株EPS三维荧光光谱分析
图8 为H1菌和B2菌的EPS三维荧光光谱。由图8可知,图谱中主要有4个荧光峰,PeakA位于Ex/Em=225 nm/330~340 nm,PeakB 位于Ex/Em=275~280 nm/330~340 nm,为类蛋白质物质,其中PeakA 为酪氨酸物质,PeakB 为色氨酸物质;PeakC 位于Ex/Em=385~405 nm/465 nm,为类腐植酸物质;PeakD 位于Ex/Em=240~270 nm/445~455 nm,为类富里酸物质[41]。
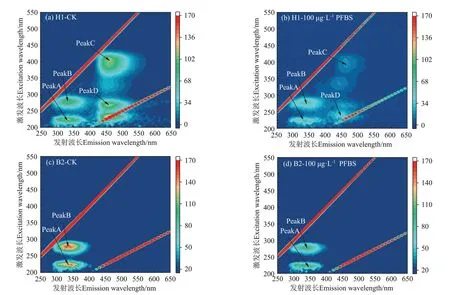
图8 H1菌和B2菌的EPS三维荧光光谱图Figure 8 Three-dimensional fluorescence spectra of H1 and B2 strain EPS
从三维荧光光谱强度(表1)可以看出,与CK 处理对比,添加100 μg·L-1PFBS 使两种菌的类蛋白峰(酪氨酸和色氨酸)强度均明显下降,与实验测定的EPS 中蛋白质浓度降低的结果相一致。其中H1 菌的PeakA 强度从129.10 a.u 下降到75.81 a.u(降低 了41.28%),PeakB 强度从96.48 a.u 下降到65.98 a.u(降低了31.61%);B2菌的PeakA强度从161.70 a.u下降到126.60 a.u(降低了21.71%),PeakB 强度从157.40 a.u下降到101.40 a.u(降低了35.58%),这与前人的相关研究结果类似。Lu 等[40]的研究结果表明,添加1 000 μg·L-1PFOS 后,EPS 中的酪氨酸和色氨酸分别比CK 处理降低了10.90%和9.38%;色氨酸荧光峰强度的降低是由PFCs 与EPS 中色氨酸发生疏水作用所导致[25]。色氨酸和酪氨酸的荧光依赖于苯环的化学结构,PFCs 中的C—F 链能够与EPS 蛋白质中的芳香基团形成疏水作用,导致苯环结构发生变化[26],从而导致PeakA 和PeakB 的荧光强度下降。
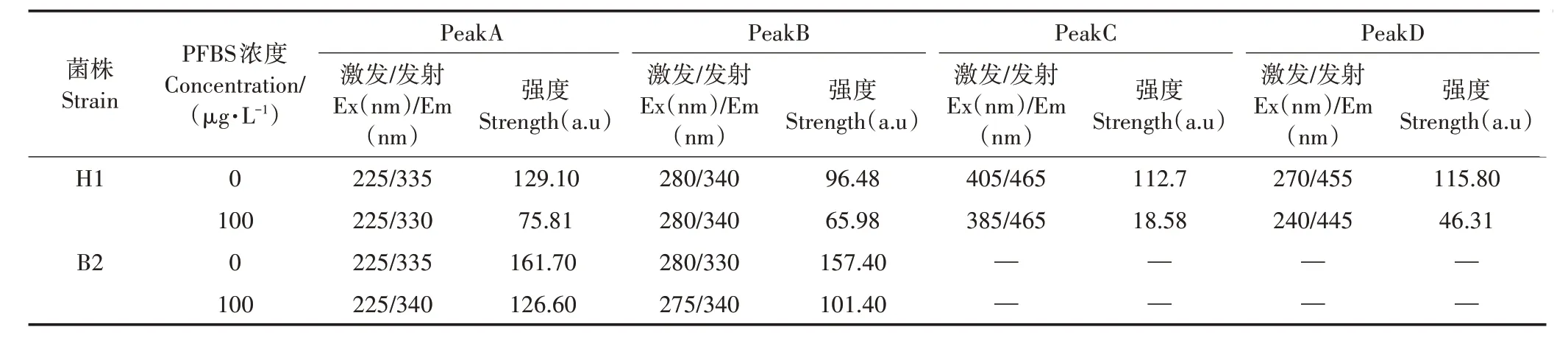
表1 H1菌和B2菌的EPS三维荧光光谱分析结果Table 1 Three-dimensional fluorescence spectrum analysis results of H1 and B2 strain EPS
如图8a和图8b所示,在H1菌的荧光谱图中还检测到了PeakC(类腐植酸)和PeakD(类富里酸),说明在H1 菌EPS 中不仅有蛋白质,还含有腐殖质。与CK处理对比(图8a),添加PFBS使H1菌的EPS中类腐植酸峰和类富里酸峰强度也有所下降,PeakC(类腐植酸)强度从112.70 a.u 下降到18.58 a.u(降低了83.51%),PeakD(类富里酸)强度从115.80 a.u 下降到46.31 a.u,(降低了60.00%),可能与腐殖质含有芳香基团和PFCs 中的C-F 链形成的疏水作用有关[26]。腐殖质含有更多的芳香族位点,腐殖质含量的增加可以在一定程度上阻止PFOS 进入细胞[40]。荧光峰C 的强度与腐殖酸结构中的羧基有关[42],因此推测PeakC(类腐植酸)和PeakD(类富里酸)的荧光强度下降的原因可能是其中的芳香基团和羧基与PFBS 发生反应所导致。
2.5 菌株EPS傅里叶红外光谱分析
100 μg·L-1PFBS 胁迫下H1 菌和B2 菌EPS 的傅里叶红外光谱如图9所示。从图9可以看出,在3 427 cm-1处的强宽带吸收峰为多糖和腐植酸中的羟基和蛋白质中酰胺基团产生的O H 和NH 的混合物伸缩振动[26,43],在2 929 cm-1处出现的尖锐式不对称吸收峰为芳香族氨基酸(色氨酸)中CH2反对称伸缩振动,2 500~2 250 cm-1处的吸收峰为空气中CO2引起的干扰峰,可能与样品中的CO2没有排干净有关。1 644 cm-1处为蛋白质中酰胺的吸收带Ⅰ,1 530 cm-1和1 526 cm-1为蛋白质中酰胺的吸收带Ⅱ,1 061 cm-1处的红外吸收峰为多糖和类多糖中C O 伸缩振动,小于1 000 cm-1的吸收峰为样品中不饱和键所形成,属于指纹区域[44-45]。
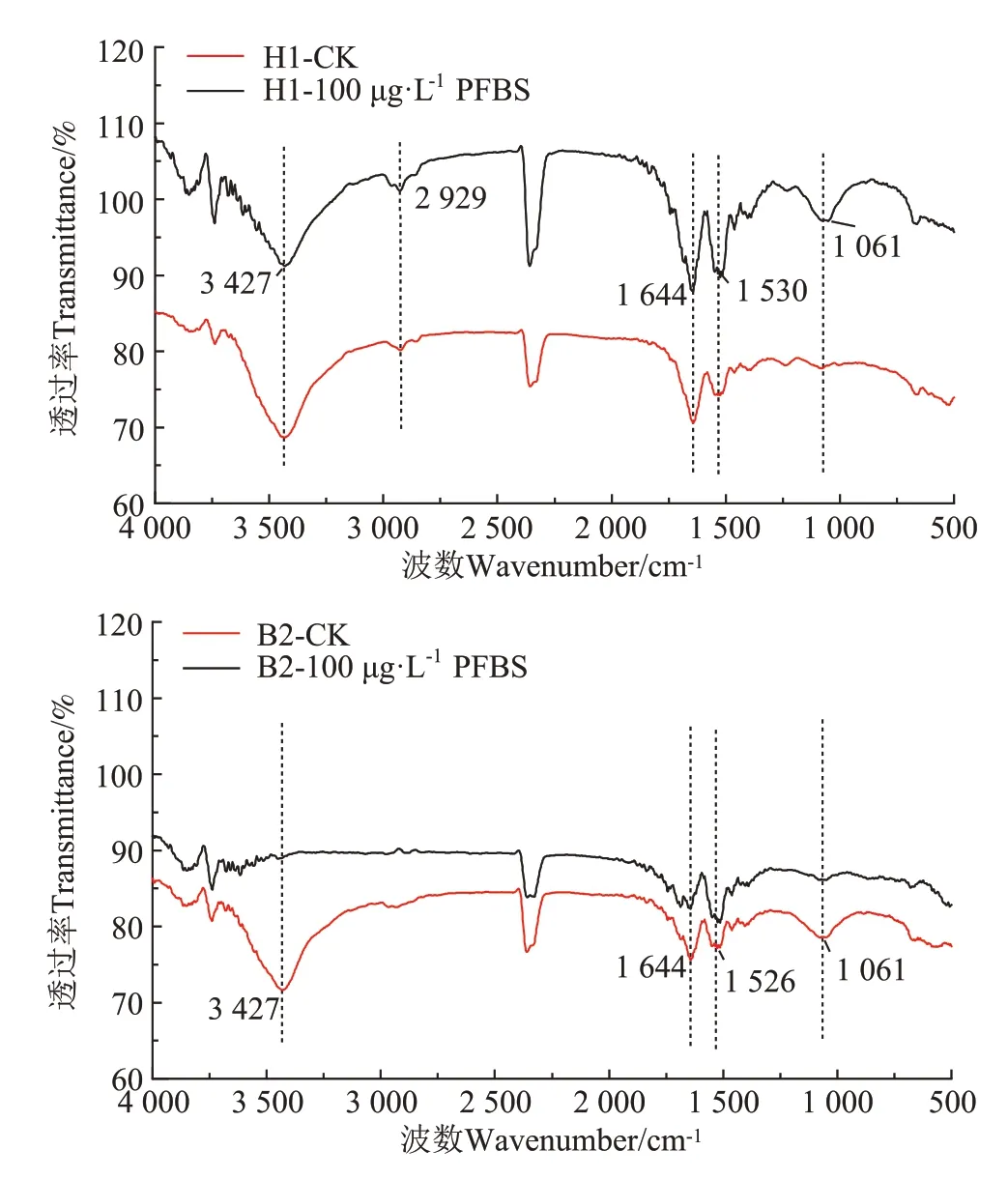
图9 H1菌和B2菌的EPS傅里叶红外光谱图Figure 9 EPS infrared spectra of H1 and B2 strain
与CK 处理对比,添加PFBS 后,没有引起EPS 的红外光谱谱峰位置的移动,表明EPS中的主要官能团类型没有发生改变。但谱峰强度有所改变,有研究表明,红外光谱图中峰强度与样品中所含官能团的浓度存在着密切关系,峰值强度的大小能够反映相应官能团的相对浓度[46]。与CK 相比,H1 菌红外光谱图在3 427 cm-1处O H 和N H 伸缩振动峰强度减弱,B2菌的红外光谱图峰的强度都变弱,尤其是3 427 cm-1和1 061 cm-1处,3 427 cm-1处O H和NH伸缩振动峰消失,1 061cm-1处CO 伸缩振动峰强度减弱,推测EPS 中蛋白质、多糖和腐植酸组分为PFBS 的吸附提供了大量的活性结合位点[26,39]。
3 结论
(1)H1 菌和B2 菌分别被鉴定为Pseudomonas(假单胞菌属)和Serratia(沙雷氏菌属),全氟丁烷磺酸(PFBS)对H1 菌的生长量和代谢活性均有促进作用,对B2 菌的生长量有促进作用,而对其代谢活性有抑制作用。H1 菌和B2 菌在接种量为2%时,4 d 后对100 μg·L-1PFBS的去除率分别为33.18%和19.95%。
(2)H1 菌和B2 菌的胞外聚合物(EPS)主要成分为蛋白质。100 μg·L-1PFBS 对这两种菌分泌EPS 有抑制作用,EPS 中的蛋白质、多糖浓度均降低,而蛋白质/多糖比值增加,其中相比于B2 菌,H1 菌EPS 中蛋白质、多糖浓度降低更多,蛋白质/多糖的比值增加更少。
(3)三维荧光光谱结果表明,100 μg·L-1PFBS 胁迫下EPS中类蛋白质、类腐植酸和类富里酸的荧光强度均降低;傅里叶红外光谱结果表明,C—O、O—H 和N—H等官能团峰强度降低。

