基于细胞焦亡途径探讨高良姜素对小鼠溃疡性结肠炎的保护机制
王浩坤 刘成霞滨州医学院附属医院消化病研究所,滨州 56600;滨州医学院附属医院消化内科,滨州 56600
溃疡性结肠炎是一种肠道非特异性炎症性疾病,具有慢性复发性的特点[1]。溃疡性结肠炎的发病率在全球范围内呈上升趋势,以西方发达地区最高,但亚洲和西班牙裔人口的发病率近年来有所增加[2]。目前,治疗药物虽然可以使疾病得到长期缓解,但停药后易复发。因此,研究溃疡性结肠炎的发生发展机制、积极探索潜在的治疗靶点,对溃疡性结肠炎的治疗至关重要。
细胞焦亡是一种由半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,Caspase)介导的程序性的细胞死亡。多种损伤因子被核苷酸结合寡聚化结构域样受体(nucleotide-binding oligomerization domain like receptors,NLRs)识别,进一步形成炎性小体,介导细胞焦亡[3]。通过在质膜上形成孔,引起大量促炎因子释放,如白细胞介素(IL)-1β和IL-18等,引发炎性反应[4]。研究表明,敲除NLRP3 基因的实验小鼠,经葡聚糖硫酸钠(DSS)诱导后,其结肠炎的症状相对较轻,应用药物阻断Caspase-1 与敲除NLRP3 基因均可减轻DSS 诱导的小鼠结肠炎,且效果相似[5-6]。
高良姜素(galangin)是一种从蜂胶以及高良姜中提取的天然黄酮类化合物。此外,高良姜素能明显改善DSS 诱导结肠炎小鼠的结肠组织病理改变和组织损伤,下调Toll样受体4(TLR4)的表达,抑制核因子(NF)-κB p65 的活化,降低IL-6、肿瘤坏死因子(TNF)-α炎症细胞因子水平,并且具有抗氧化作用[7]。可见,高良姜素可以通过抗炎、抗氧化等来减轻溃疡性结肠炎,但在细胞焦亡方面并无研究,所以其作用机制仍需进一步探讨。我们通过建立DSS 诱导小鼠的结肠炎模型,通过高良姜素进行干预,验证了高良姜素与细胞焦亡的关系,为溃疡性结肠炎的治疗提供了新的思路。
材料与方法
1.动物材料与试剂
C57BL/6 雄性小鼠,6~8 周龄,(23±2.0)g,济南朋悦实验动物繁育有限公司;DSS,Coolaber 公司;高良姜素,美国MCE 公司;美沙拉嗪(艾迪莎),上海爱的发制药有限公司;4%多聚甲醛;苏木精-伊红(HE)染色试剂盒,大连美仑生物技术有限公司;小鼠IL-1β 酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒,武汉博士德生物工程有限公司;小鼠IL-18 ELISA 试剂盒,武汉爱博泰克生物科技有限公司;小鼠/兔免疫球蛋白G(IgG)-免疫组化试剂盒,武汉博士德生物工程有限公司;NLRP3 抗体,武汉博士德生物工程有限公司;Caspase-1 抗体,武汉三鹰生物技术有限公司。
2.仪器设备
离心机,德国eppendorf 公司;轮转式切片机,Leica 公司;石蜡包埋机,Leica 公司;病理组织漂烘仪,常州市中威电子仪器有限公司;多功能微孔板检测仪,美国BioTek仪器有限公司;恒温孵育箱,Thermo Fisher Scientific 公司;蓄电显微镜,日本OLYMPUS公司。
3.方法
3.1.实验分组 C57BL/6 雄性小鼠30 只,均为SPF 级实验小鼠,经动物伦理委员会批准,决议编号:20210808-20。每组6 只,分别为正常对照组、模型组、高良姜素组(40 mg·kg-1·d-1)、美沙拉嗪组(0.5 g·kg-1·d-1)、高良姜素联合美沙拉嗪组(高良姜素40 mg·kg-1·d-1、美沙拉嗪0.5 g·kg-1·d-1),均按0.1 ml/10 g 灌胃给药。正常对照组小鼠自由饮用蒸馏水,无药物干预。除对照组外,其余每组小鼠从造模第1 天开始自由饮用3.5% DSS 溶液,同时给予药物灌胃,每天1次,共7 d。造模期间每组小鼠自由进食标准饲料,定期给予更换垫料,并每天观察造模效果,同时根据McCarthy 等[8]制定的疾病活动指数(disease activity index,DAI)评分标准进行疾病炎症程度评估。7 d后处死小鼠,留取血液4 ℃离心(2000×g15 min)后收集血清,放于-80 ℃冰箱保存,同时游离结肠组织,部分置于4%多聚甲醛中固定备用。
3.2.HE 染色及组织损伤指数(histological index,HI)评分 将固定好的结肠组织进行脱水、透明、浸蜡、包埋、切片(厚度为4 μm)、脱蜡、HE染色、封片等处理。根据Dieleman等[9]制定的HI评分标准进行评分。
3.3.免疫组化法 经制备好的石蜡切片进行烤片、脱蜡、抗原修复、灭活内源性过氧化物酶、封闭、滴加一抗(均以1:200稀释)、滴加山羊抗兔试剂、二氨基联苯胺(DAB)显色、苏木素复染、脱水和透明等处理。在40×光镜下,相同观察条件下每张切片随机取5 个视野,棕黄色细胞为阳性细胞。使用Image-Pro Plus 6.0 进行分析,利用OD=IOD/Area表示阳性细胞的表达情况。
3.4.ELISA 检测小鼠血清中的IL-1β、IL-18的含量 使用ELISA试剂盒检测小鼠血清中的IL-1β、IL-18的含量,绘制标准曲线和二次回归方程,带入待测样本OD 值,得出待测样本浓度。
4.统计分析
实验数据采用SPSS 26.0 统计软件进行数据分析,计量资料符合正态分布,以均数±标准差(±s)表示。多个样本间比较采用One-way ANOVA 进行组间分析。采用GraphPad Prism 8.0 软件绘制图表。采用Image-Pro Plus 6.0 对免疫组化结果进行分析处理。P<0.05 差异有统计学意义。
实验结果
1.造模情况及DAI评分
正常对照组小鼠一般情况良好,体质量呈上升趋势。模型组从DDS 干预第3~4 天,小鼠活跃度较前降低,出现软便、稀便,体质量开始下降,第5~7 天小鼠活动减少,出现肉眼血便,体质量明显下降。高良姜素组、美沙拉嗪组、高良姜素联合美沙拉嗪组小鼠从DSS 干预第4 天起出现活动度减低、体质量下降、稀便、血便、饮食减少,但上述症状较模型组轻。各组DAI评分见图1。

图1 各组小鼠DAI评分比较
2.各组小鼠结肠长度及大体观
正常对照组小鼠结肠无明显缩短(71.33±2.94)mm,模型组小鼠结肠明显缩短(45.71±5.08)mm,差异有统计学意义(P<0.01);其余各治疗组小鼠结肠均有不同程度缩短,程度较模型组轻,并且差异均有统计学意义(均P<0.05)。正常对照组小鼠结肠肠壁无水肿,黏膜无出血、溃疡等表现;模型组小鼠结肠肠壁水肿,肠黏膜有出血、溃疡等表现;其余各治疗组上述表现较模型组轻。具体如图2、3。
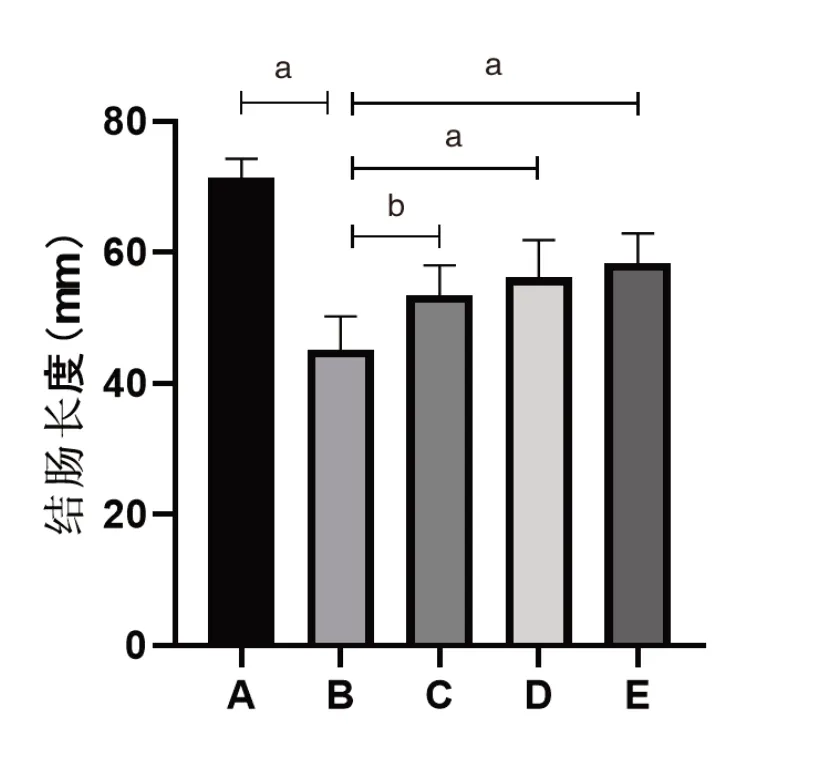
图2 各组小鼠结肠长度对比
3.各组小鼠结肠组织HE染色及HI评分
正常对照组小鼠结肠黏膜组织结构完整,腺体结构完好排列整齐,无明显炎症细胞浸润。经DSS 干预后,结肠黏膜组损伤严重,腺体结构异常,隐窝破坏,可见糜烂、溃疡形成,黏膜及黏膜下层大量炎性细胞浸润。经高良姜素、美沙拉嗪处理后,结肠黏膜损伤程度有不同程度减轻,各组HE染色见图3,HI评分见图4。
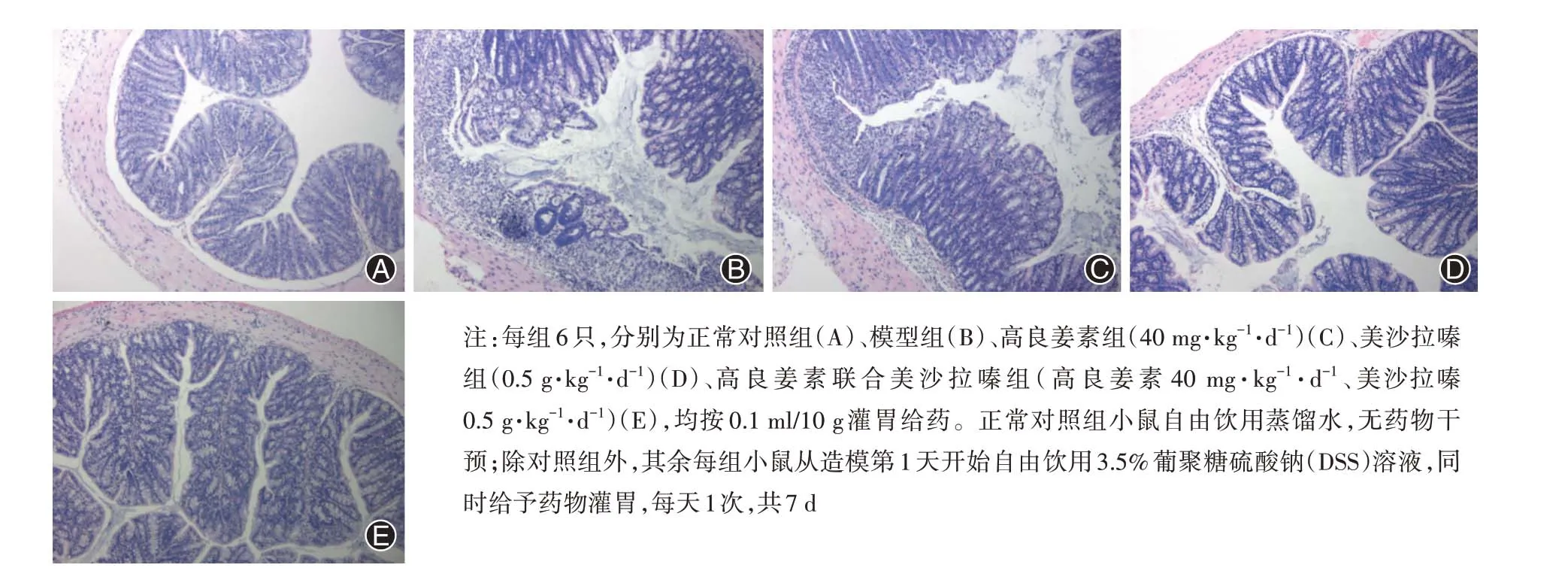
图3 各组小鼠结肠组织苏木精-伊红(HE)染色(×100)

图4 各组小鼠结肠组织HI评分
4. 免疫组化法检测小鼠结肠组织中NLRP3、Caspase-1的表达
如图5、6所示,NLRP3、Caspase-1表达于结肠黏膜及黏膜下层。正常对照组小鼠结肠组织NLRP3、Caspase-1 阳性细胞少见,模型组小鼠结肠组织中可见大量NLRP3、Caspase-1 阳性细胞表达,差异均有统计学意义(均P<0.01);高良姜素组NLRP3、Caspase-1 阳性细胞表达较模型组减少(均P<0.01)。美沙拉嗪组与高良姜素联合美沙拉嗪组相比,NLRP3、Caspase-1 阳性细胞率差异均有统计学意义(均P<0.05)。见图7。

图5 各组小鼠结肠组织中NLRP3的表达(免疫组化法 ×400)
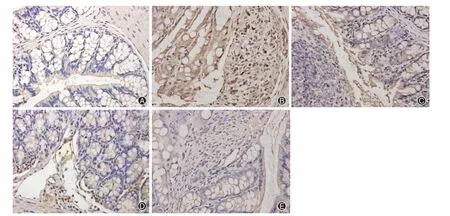
图6 各组小鼠结肠组织中Caspase-1的表达(免疫组化法 ×400)
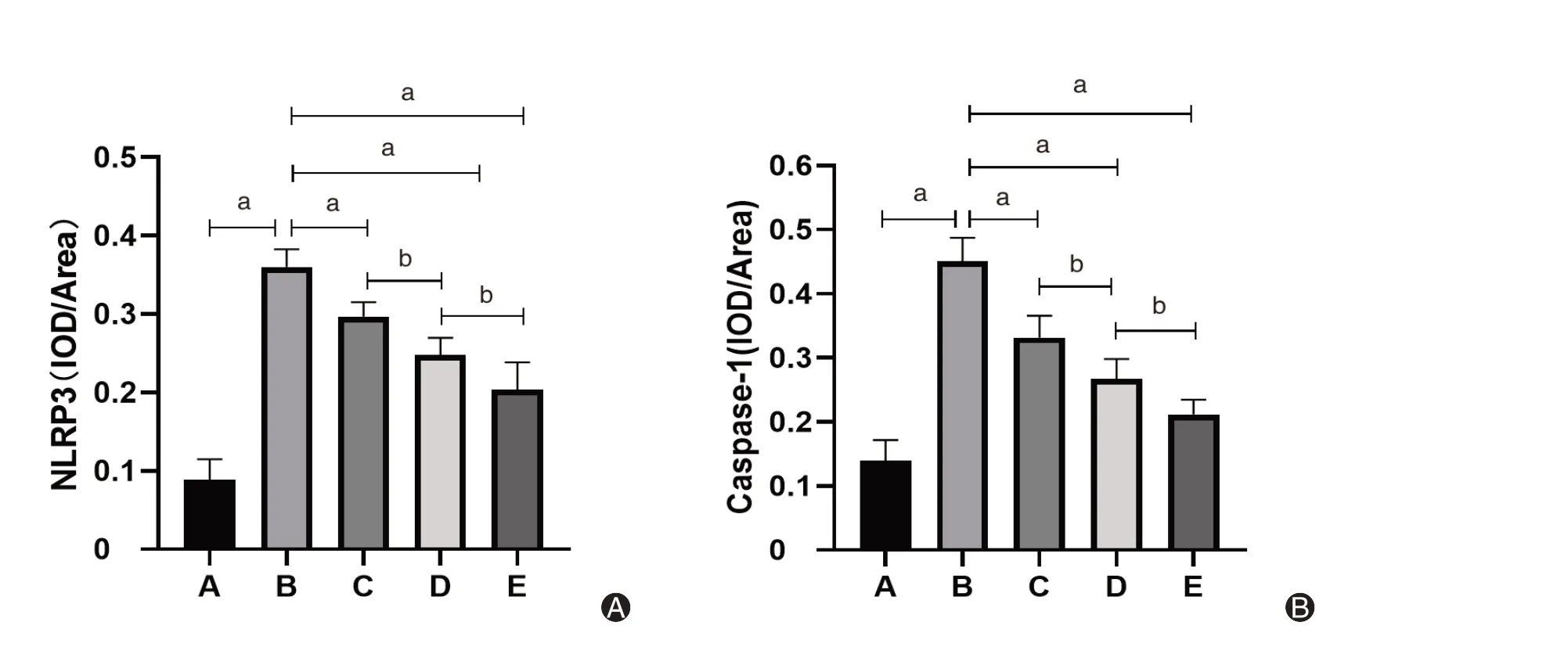
图7 各组小鼠结肠组织中NLRP3(A)、Caspase-1(B)表达量对比
5.小鼠血清中IL-1β、IL-18的含量
模型组小鼠血清中IL-1β、IL-18 的含量较正常对照组明显增多,差异均有统计学意义(均P<0.01)。各治疗组小鼠血清中IL-1β、IL-18 的含量较模型组均有不同程度下降。高良姜素组低于模型组(均P<0.05),美沙拉嗪组IL-1β、IL-18与高良姜素联合美沙拉嗪组相比,差异均有统计学意义(均P<0.05)。具体如表1。
表1 各组小鼠血清中IL-1β、IL-18的含量(ng/L,±s)
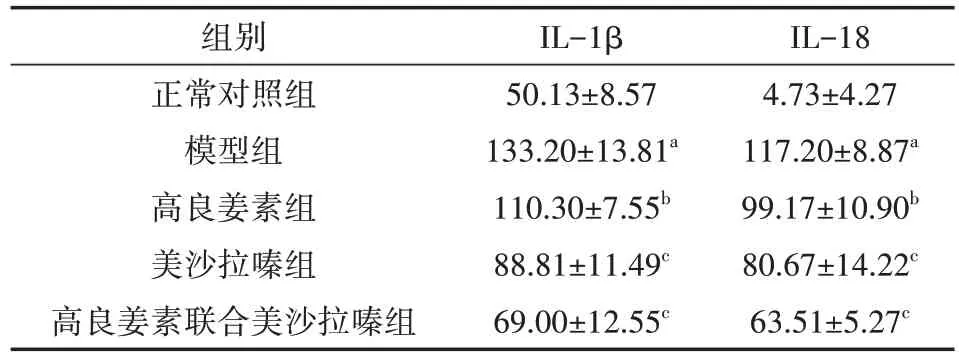
表1 各组小鼠血清中IL-1β、IL-18的含量(ng/L,±s)
注:每组6 只,分别为正常对照组、模型组、高良姜素组(40 mg·kg-1·d-1)、美沙拉嗪组(0.5 g·kg-1·d-1)、高良姜素联合美沙拉嗪组(高良姜素40 mg·kg-1·d-1、美沙拉嗪0.5 g·kg-1·d-1),均按0.1 ml/10 g灌胃给药。正常对照组小鼠自由饮用蒸馏水,无药物干预;除对照组外,其余每组小鼠从造模第1天开始自由饮用3.5%葡聚糖硫酸钠(DSS)溶液,同时给予药物灌胃,每天1次,共7 d。IL为白细胞介素。与正常对照组相比,aP<0.01;与模型组相比,bP<0.05,cP<0.01
IL-184.73±4.27117.20±8.87a 99.17±10.90b 80.67±14.22c 63.51±5.27c组别正常对照组模型组高良姜素组美沙拉嗪组高良姜素联合美沙拉嗪组IL-1β 50.13±8.57133.20±13.81a 110.30±7.55b 88.81±11.49c 69.00±12.55c
讨论
溃疡性结肠炎作为一种慢性非特异性肠道炎症性疾病,现有治疗药物只能做到临床缓解,减少疾病复发,目前尚无有效的治愈手段,治疗的目标是诱导并维持症状缓解以及促使肠黏膜愈合,防治并发症[10]。目前治疗该疾病的药物包括5-氨基水杨酸制剂、糖皮质激素、免疫抑制剂等,然而这些药物具有多种不良反应,且疾病的复发率依旧偏高,有些患者甚至可能需要外科手术来治疗[11]。溃疡性结肠炎的发病机制尚不十分明确,但炎症却始终伴随着疾病的发生发展,其中免疫失调起到了重要作用。正常的肠道黏膜免疫机制可以抵御外界致病因子,并且对于维持肠道正常菌群具有重要作用,当肠道免疫失调,肠黏膜屏障功能受损,相关致病因子会激活免疫系统,产生多种致炎因子,诱发溃疡性结肠炎。
本实验通过建造3.5% DSS 诱导的小鼠溃疡性结肠炎模型,通过药物干预,首先从实验小鼠一般情况、体质量、DAI 评分、结肠大体观、组织病理等方面,观察药物对小鼠溃疡性结肠炎的保护作用。结果表明,实验小鼠给予规定剂量的药物干预后,其症状、DAI评分、结肠长度、HI评分均较模型组有不同程度改善,且高良姜素联合美沙拉嗪组治疗效果更加显著。所以,我们推测高良姜素对溃疡性结肠炎具有一定的保护作用,并且联合美沙拉嗪可能比单用美沙拉嗪治疗效果更加显著。
细胞焦亡在促进炎症发展方面有着重要作用,与细胞坏死和凋亡不同,细胞焦亡与NLRP3 炎性小体的激活密切相关。越来越多的证据表明,NLRP3 炎性小体的激活和细胞焦亡参与了结肠炎的炎症过程[12]。细胞焦亡作用是破坏病原体感染的细胞,使其更容易被吞噬细胞吞噬和杀灭,阻止病原体在细胞内复制[13]。然而,体内细胞焦亡的异常激活可能导致各种炎性反应从而导致各种炎症性疾病。有研究表明,重症肝炎和肝纤维化与肝细胞焦亡有关,其潜在机制可能是NLRP3炎性小体的异常活化导致的[14]。肝脏X受体β与泛连接蛋白1相互作用,通过细胞焦亡的方式诱导结肠癌细胞死亡[13]。另有研究认为,细胞焦亡可能在动脉硬化的发生发展中发挥重要作用[15]。肠道上皮细胞(intestinal epithelial cells,IECs)是宿主细胞和肠道菌群之间的屏障,IECs 中过度的炎性小体激活会诱发细胞焦亡导致免疫系统和肠道菌群之间的平衡失调。因此,细胞焦亡在肠道上皮屏障功能障碍和黏膜炎症的发展中有至关重要的作用。我们的实验从细胞焦亡角度出发,以NLRP3、Caspase-1 为目标分子,探究了细胞焦亡与溃疡性结肠炎的关系,结果表明,模型组结肠组织中NLRP3 和Caspase-1 的表达量明显增高(均P<0.01),经高良姜素治疗后它们的表达下降(均P<0.05),高良姜素联合美沙拉嗪相对于单用美沙拉嗪治疗会进一步下调NLRP3 和Caspase-1 的表达(均P<0.05)。由此可见,细胞焦亡的确存在于溃疡性结肠炎中,并且高良姜素、美沙拉嗪对IECs细胞焦亡的抑制作用可能是其发挥治疗作用的机制之一。针对炎症性肠病IECs中细胞焦亡的免疫治疗可能成为一种新的治疗方法。
IL-1β 作为参与炎症性肠病发病的最重要的促炎细胞因子之一,其产生依赖于炎性小体的激活,血浆中IL-1β 水平升高与肠道炎症的严重程度和疾病活动密切相关,并且通过药物抑制IL-1β 可以成功改善实验性结肠炎模型的肠道炎症[16-17]。IL-1β 可以诱导T 细胞增殖,参与黏膜损伤、感染,并促使中性粒细胞募集到损伤部位,进一步激活NF-κB和MAPK 信号通路,促使其他炎性细胞因子释放[18]。相关临床研究表明,炎症性肠病患者血清和结肠组织中IL-1β 含量显著升高,在结肠炎动物模型中,成熟IL-1β 的产生也显著上调。与IL-1β 类似,IL-18 也是由炎性小体激活的一种多功能细胞因子。IL-18通常是一种促炎介质,它可能是炎症性肠病患者的一个关键致病因素。Chaix 等[19]研究表明,从IECs 中敲除IL-18 受体基因对DSS 诱导的小鼠结肠炎具有保护作用。IL-1β 和/或IL-18 基因缺乏小鼠对2,4-二硝基苯磺酸(DNBS)诱导的小鼠结肠炎也具有保护作用[20]。这些研究结果表明,IL-18的过量产生可能会导致肠道黏膜通透性增加,从而加剧肠道炎症。所以我们又进一步检测了实验小鼠血清中IL-1β 和IL-18 的含量,同样,模型组IL-1β 和IL-18 的含量显著升高(均P<0.01),高良姜素治疗后含量下降(均P<0.05),联合美沙拉嗪治疗后IL-1β、IL-18 的含量比单用美沙拉嗪更低(均P<0.05)。这两种细胞因子的活化依赖于Caspase-1,而免疫组化中Caspase-1 的表达也与它们有相似的趋势,这表明,高良姜素可能是NLRP3 炎性小体的抑制剂,使Caspase-1 表达下调导致GSDMD-N 形成减少,最终导致成熟的IL-1β 和IL-18 生产减少,从而减轻炎性反应。同时,美沙拉嗪组小鼠NLRP3、Caspase-1 的表达也呈下降趋势,我们推测,抑制细胞焦亡是美沙拉嗪发挥抗炎作用的机制之一。
综上所述,高良姜素对DSS 诱导的溃疡性结肠炎具有保护作用,联合美沙拉嗪保护作用更加明显。其机制可能是通过抑制NLRP3炎性小体的产生,进一步抑制细胞焦亡,减少IL-1β 和IL-18的释放,从而减轻肠道炎症。我们还发现,高良姜素联合美沙拉嗪比单用美沙拉嗪治疗效果更加,二者联合会产生更强的治疗效果,所以美沙拉嗪联合高良姜素可能成为临床治疗溃疡性结肠炎的新方法。我们的研究初步阐述了高良姜素与NLRP3 炎性小体、细胞焦亡的关系,为临床溃疡性结肠炎的治疗提供了参考。
利益冲突所有作者均声明不存在利益冲突

