基于HMGB1/NF-κB/NLRP3轴探讨褪黑素对氧诱导视网膜病变的保护作用
褚芳芳 赵岩松 赵玉泽 白晨 肖培伦 王晓莉 于树娜 蒋吉英
(1.潍坊医学院人体解剖学教研室,山东潍坊 261053;2.潍坊医学院附属医院眼科中心,山东潍坊 261031;3.潍坊医学院医学影像学院,山东潍坊 261053)
早产儿视网膜病变(retinopathy of prematurity,ROP)是一种以视网膜新生血管为特征的视网膜病变,随着早产儿存活率的提高,ROP 的发病率也显著提高,已成为儿童致盲的主要原因之一[1]。然而,ROP 的发病机制尚不明确,缺乏明确的治疗措施。因此,探索ROP 的相关机制及新的治疗方法具有重要的临床意义。氧诱导视网膜病变(oxygen-induced retinopathy,OIR)新生小鼠模型可以较好地模拟高氧刺激后视网膜血管闭塞和新生血管的形成,是研究ROP 的经典模型。以往的研究多侧重于血管新生,近年来的研究显示,核苷酸结合寡聚化结构域样受体蛋白3(nucleotidebinding oligomerization domain-like receptor protein 3,NLRP3)炎性小体介导的炎症也参与了OIR的病理进程,提示抑制炎症反应亦可作为ROP 的治疗靶点。褪黑素(melatonin,Mel)是一种具有抗炎、抗氧化、抗凋亡作用的内分泌激素[2-3],已有研究证实Mel对ROP、视网膜缺血再灌注损伤等眼部疾病有保护作用[4-5]。由此推测Mel 可能通过抑制NLRP3 炎性小体的活化减轻OIR。为验证上述假说,本研究通过建立OIR 新生小鼠模型,观察HMGB1/NF-κB/NLRP3 轴在Mel 对新生小鼠OIR 保护作用中的影响,以期为Mel在ROP中的临床应用提供实验依据。
1 材料与方法
1.1 实验分组及模型建立
健康成年C57BL/6J 小鼠20 只(山东省济南朋悦实验动物繁育有限公司),体重22~25 g,SPF级,常规鼠颗粒饲料喂养,雄鼠与雌鼠按1∶3 比例合笼。取27 只自然分娩喂养至出生后第7 天(postnatal day 7,P7)的新生小鼠进行实验,雌雄不限,体重3.13±0.16 g。将P7新生小鼠随机分为对照组(n=9)、模型组(OIR 组,n=9)与Mel 处理组(OIR+Mel 组,n=9)。参照文献[6]建立OIR 小鼠模型,即将哺乳母鼠与P7 新生小鼠置于氧气体积分数为75%±2%的氧舱(DYC-Ⅰ,武汉七〇一研究所)内饲养5 d,隔日更换母鼠和垫料、加食换水。于P12时移出氧箱,置于常氧环境继续饲养5 d。对照组小鼠在常氧环境中饲养。Mel 处理组从P12 开始,每日上午8:00 腹腔注射Mel 10 mg/kg(美国Sigma公司)[4],连续5 d,于P17时处死动物、取材。
1.2 视网膜铺片法观察视网膜新生血管
P17小鼠乙醚麻醉后固定,暴露心脏,剪开右心耳,从左心室依次注入0.9%氯化钠溶液、4%多聚甲醛溶液、5%明胶墨汁(上海晨光墨汁),以口、鼻、四肢呈黑色为灌注成功,冰上静置30 min使明胶墨汁凝固后取眼,置于4%多聚甲醛固定2 h。在体视显微镜下沿角巩膜缘剪开眼球,分离巩膜和脉络膜,去除晶状体、残存的玻璃体及色素,以视神经乳头为中心沿鼻上、鼻下、颞上、颞下4个方向将视网膜剪为四叶草形状,置于准备好的载玻片上,甘油明胶封片,研究级正置光学显微镜下观察并拍照。
1.3 标本的采集及处理
P17小鼠乙醚麻醉下摘取眼球,去除角膜及晶状体,用4%多聚甲醛固定过夜,常规石蜡包埋,连续切片(厚4 μm),每3~5 张切片取1 张切片,分别行苏木精-伊红(hematoxylin and eosin,HE)染色及免疫荧光染色;取眼后保留视网膜组织,称重,行髓过氧化物酶(myeloperoxidase,MPO)活性检测。
1.4 HE染色
石蜡切片,二甲苯脱蜡、梯度酒精水化,采用HE染色试剂盒(北京索莱宝科技有限公司)染色,苏木素染核10 min,盐酸酒精分化30 s,去离子水冲洗,伊红胞浆染色2 min,梯度酒精脱水、二甲苯透明、中性树胶封片。于光学显微镜下观察视网膜结构、计数突破内界膜的血管内皮细胞核数。
1.5 免疫荧光染色
石蜡切片,脱蜡水化、抗原修复、0.3%TritonX-100透膜、5% BSA-PBS封闭2 h,分别加入兔抗NLRP3(1∶100,英国Affinity公司)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)(1∶200,北京博奥森生物技术有限公司)、半胱氨酸蛋白水解酶-1 前体(procaspase-1)(1∶100,武汉爱博泰克生物科技有限公司)、剪切的半胱氨酸蛋白水解酶-1(cleavedcaspase-1,1∶100,英国Affinity 公司)、白细胞介素(interleukin,IL)-1β(1∶200,武汉爱博泰克生物科技有限公司)、高迁移率族蛋白B1(high mobility group box 1,HMGB1)(1∶100,上海爱必信生物科技有限公司)、核转录因子-κB(neuclear transcription factor kappa B,NF-κB)(1∶100,北京博奥森生物技术有限公司)、淋巴细胞抗原6G(lymphocyte antigen 6G,Ly-6G)(1∶200,美国CST 公司)、褪黑素受体1(melatonin receptor 1,MT1)(1∶50,美国ABBIOTEC公司)和褪黑素受体2(melatonin receptor 2,MT2)(1∶100,英国Affinity 公司)、鼠抗Toll 样受体4 (Toll-like receptor 4,TLR4)(1∶200,美国Santa 公司)、肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)(1∶100,美国Santa 公司)一抗,4℃孵育过夜;次日,37℃复温,PBS 漂洗3 次,滴加Alexa Fluor 488标记的山羊抗兔IgG或Alexa Fluor 594标记的山羊抗鼠IgG荧光二抗(1∶200,北京中杉金桥生物技术有限公司),37℃避光孵育1 h,PBS漂洗3次,用含DAPI 的荧光封片剂(美国Santa 公司)封片。正置荧光显微镜下进行观察拍照,并用Image J 软件进行分析。

图4 各组小鼠视网膜Ly-6G、TNF-α 免疫荧光染色结果(×400) Ly-6G 为中性粒细胞标志物,Ly-6G+胞浆染色为绿色,TNF-α+胞浆染色为红色,DAPI+细胞核染为蓝色。OIR+Mel组Ly-6G+、TNF-α+表达少于OIR组。[GCL]神经节细胞层;[INL]内核层;[ONL]外核层。
1.6 比色法检测MPO活性
将视网膜组织按重量体积比1∶19加匀浆介质制备成5%的组织匀浆,按MPO测定试剂盒(南京建成生物工程研究所)说明书加入试剂后混匀,60℃水浴10 min后取出,吸取200 μL于96孔板中,立即用分光光度计在450 nm 波长处测量各组的吸光度值。根据说明书提供公式,计算MPO活力。
1.7 统计学分析
采用SPSS 22.0 统计软件进行统计学分析。计量资料采用均数±标准差(xˉ±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Mel 对OIR 小鼠视网膜血管新生及视网膜形态结构的影响
视网膜铺片结果显示,OIR组视网膜血管分布被破坏,中央部出现大片无灌注区,无灌注区附近出现新生血管,新生血管呈团簇状,分布紊乱;OIR+Mel 组视网膜的无灌注区和新生血管数量减少。HE 染色结果显示,OIR 组视网膜结构排列疏松紊乱,可见细胞丢失和空泡化,内界膜不完整,突出内界膜的新生血管内皮细胞核数(25.17±1.61)较对照组(0.75±0.25)多;OIR+Mel 组视网膜的内界膜基本恢复平滑,偶见细胞出现空泡变性,突出内界膜的新生血管内皮细胞核数(4.25±0.75)较OIR组减少,各组比较,差异均具有统计学意义(F=489.006,P<0.001)。见图1。
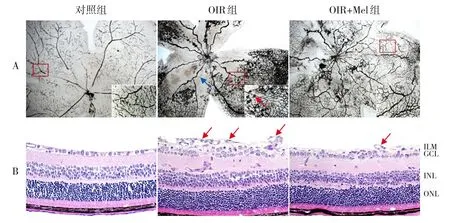
图1 各组小鼠视网膜结构和新生血管变化 A:视网膜铺片结果(光学显微镜,×40)。OIR组出现大量无灌注区和病理性新生血管,OIR+Mel组视网膜的无灌注区和新生血管数量减少。蓝色箭头指示视网膜的无灌注区,红色箭头指示新生血管。B:苏木精-伊红染色结果(×400)。OIR组大量新生血管内皮细胞突出内界膜,OIR+Mel组突出内界膜的新生血管内皮细胞核数减少。箭头指示突出内界膜的新生血管内皮细胞。[GCL]神经节细胞层;[INL]内核层;[ONL]外核层;[ILM]内界膜。
2.2 Mel对OIR小鼠视网膜NLRP3炎性小体相关因子表达的影响
免疫荧光染色显示,对照组NLRP3、ASC、pro-caspase-1、cleaved-caspase-1 和IL-1β 阳性表达少,OIR 组和OIR+Mel 组视网膜神经节细胞层(ganglion cell layer,GCL)与内核层(inner nuclear layer,INL) 均可见其阳性表达,且OIR 组NLRP3、ASC、pro-caspase-1、cleaved-caspase-1 和IL-1β 阳性表达较对照组显著升高(P<0.05),OIR+Mel 组NLRP3、ASC、pro-caspase-1、cleavedcaspase-1 和IL-1β 阳性表达较OIR 组减少(P<0.05)。见图2、表1。
表1 各组小鼠视网膜NLRP3、ASC、pro-caspase-1、cleaved-caspase-1、IL-1β平均荧光强度比较 (± s,n=3)

表1 各组小鼠视网膜NLRP3、ASC、pro-caspase-1、cleaved-caspase-1、IL-1β平均荧光强度比较 (± s,n=3)
注:a示与对照组比较,P<0.05;b示与OIR组比较,P<0.05。[NLRP3]核苷酸结合寡聚化结构域样受体蛋白3;[ASC]凋亡相关斑点样蛋白;[pro-caspase-1]半胱氨酸蛋白水解酶-1前体;[cleaved-caspase-1]剪切的半胱氨酸蛋白水解酶-1;[IL-1β]白细胞介素-1β。
?
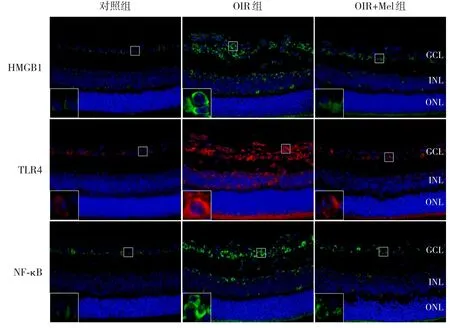
图3 各组小鼠视网膜HMGB1、TLR4、NF-κB表达的变化(免疫荧光染色,×400) HMGB1+、NF-κB+胞浆染色为绿色,TLR4+胞浆染色为红色,DAPI+细胞核染为蓝色。OIR+Mel 组HMGB1+、NF-κB+、TLR4+表达少于OIR组。[GCL]神经节细胞层;[INL]内核层;[ONL]外核层。
2.3 Mel对OIR小鼠视网膜HMGB1、TLR4、NFκB表达的影响
免疫荧光染色显示,对照组HMGB1、TLR4和NF-κB阳性表达较少,OIR组和OIR+Mel组GCL与INL 均可见其阳性表达,OIR+Mel 组HMGB1、TLR4和NF-κB阳性表达低于OIR组(P<0.05)。见图3、表2。
表2 各组小鼠视网膜HMGB1、TLR4、NF-κB平均荧光强度比较 (± s,n=3)

表2 各组小鼠视网膜HMGB1、TLR4、NF-κB平均荧光强度比较 (± s,n=3)
注:a 示与对照组比较,P<0.05;b 示与OIR 组比较,P<0.05。[HMGB1]高迁移率族蛋白B1;[TLR4]Toll 样受体4;[NF-κB]核转录因子-κB。
?
2.4 Mel 对OIR 小鼠中性粒细胞浸润和促炎因子表达的影响
免疫荧光染色显示,对照组中性粒细胞标志物Ly-6G 和TNF-α 阳性表达较少,OIR 组和OIR+Mel 组GCL 与INL 均可见Ly-6G、TNF-α 阳性表达,且OIR+Mel 组Ly-6G、TNF-α 阳性表达显著低于OIR 组(P<0.05)。MPO 活力检测结果显示,与对照组相比,OIR组MPO活力显著升高,OIR+Mel组较OIR 组MPO 活力降低(均P<0.05)。见图4、表3。
表3 各组小鼠视网膜Ly-6G、TNF-α平均荧光强度及MPO活力比较 (± s,n=3)
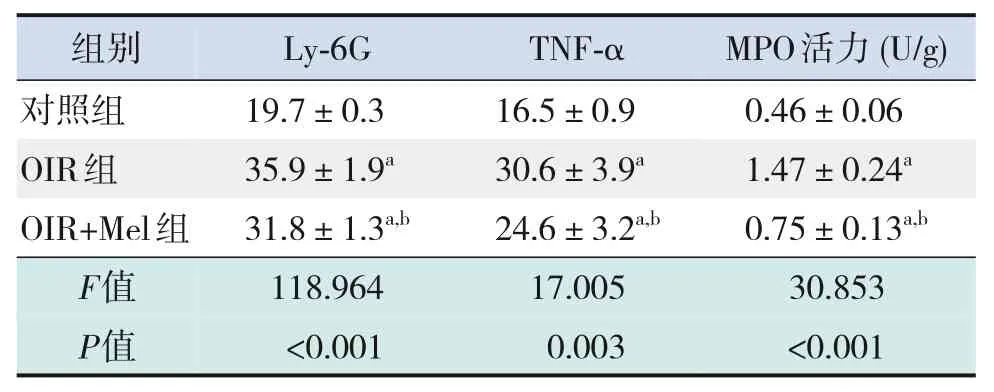
表3 各组小鼠视网膜Ly-6G、TNF-α平均荧光强度及MPO活力比较 (± s,n=3)
注:a 示与对照组比较,P<0.05;b 示与OIR 组比较,P<0.05。[Ly-6G]淋巴细胞抗原6G;[TNF-α]肿瘤坏死因子-α;[MPO]髓过氧化物酶。
?
2.5 Mel对OIR小鼠Mel受体表达的影响
免疫荧光染色显示,对照组可见MT1 和MT2的阳性表达主要位于GCL 与INL,OIR 组GCL 与INL 中MT1 和MT2 阳性表达较对照组显著减少,OIR+Mel组MT1和MT2阳性表达较OIR组增多(均P<0.05)。见表4、图5。
表4 各组小鼠视网膜MT1、MT2平均荧光强度比较(± s,n=3)
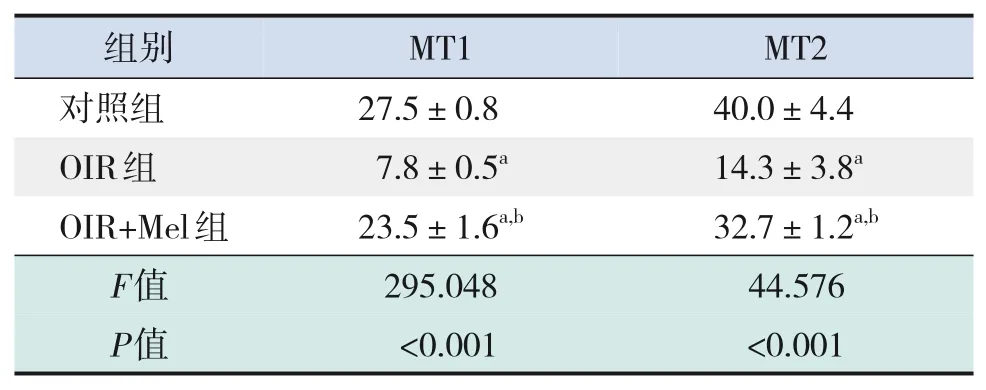
表4 各组小鼠视网膜MT1、MT2平均荧光强度比较(± s,n=3)
注:a 示与对照组比较,P<0.05;b 示与OIR 组比较,P<0.05。[MT1]褪黑素受体1;[MT2]褪黑素受体2。
?
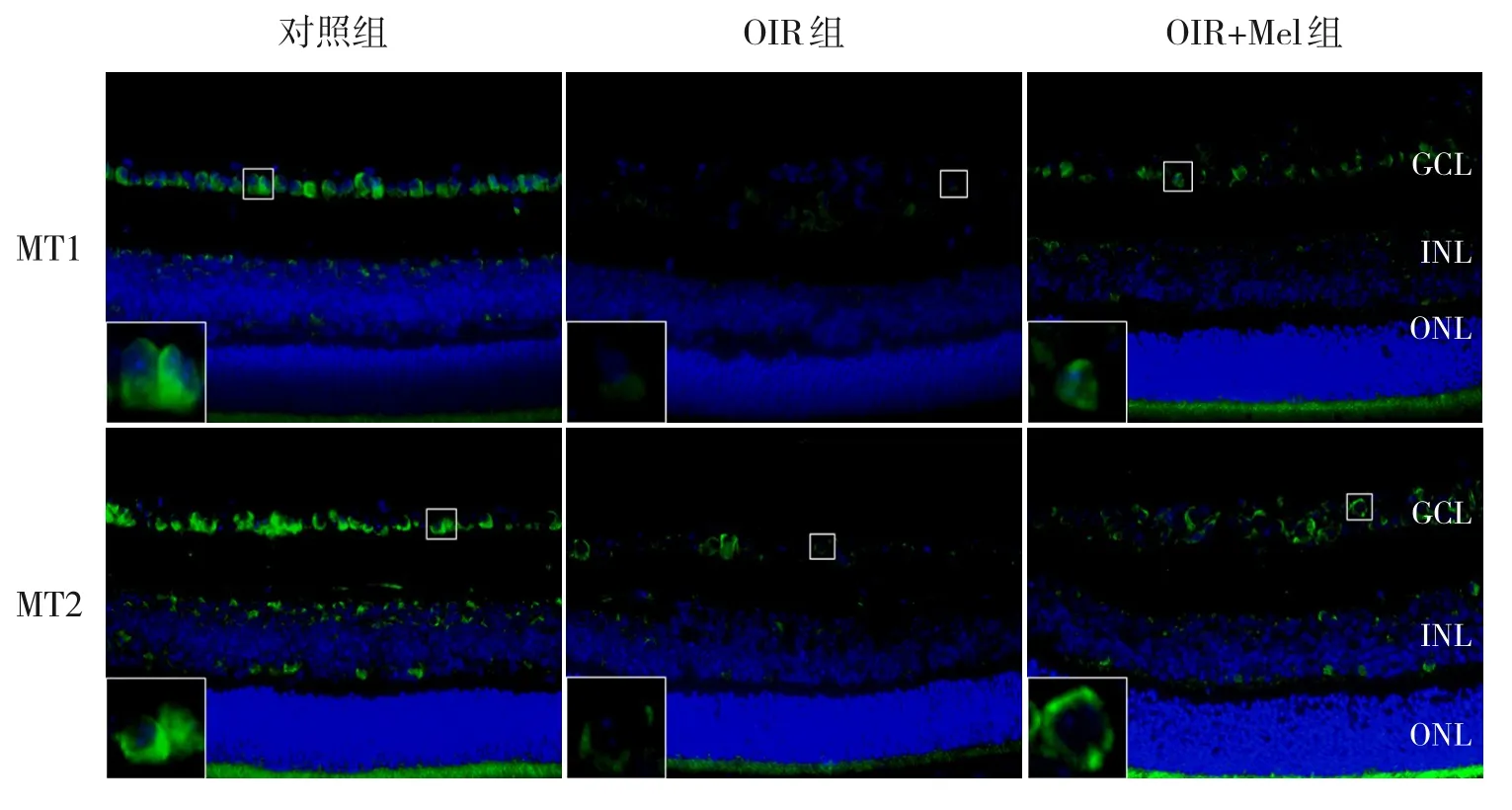
图5 各组小鼠视网膜中MT1和MT2表达变化(免疫荧光染色,×400) MT1+、MT2+胞浆染色为绿色,DAPI+细胞核染为蓝色。OIR+Mel组MT1+、MT2+表达较OIR组多。[GCL]神经节细胞层;[INL]内核层;[ONL]外核层。
3 讨论
ROP 作为一种新生血管性视网膜疾病,其发病机制尚未完全阐明,且已有研究证实高氧在诱导ROP 新生血管生成中起着关键作用,新生小鼠OIR模型已被广泛应用于ROP的研究[7]。本研究亦采用经典的Smith 等[6]设计的方法建立新生小鼠OIR模型。视网膜铺片结果显示,视网膜血管的正常分布被破坏,中央部出现大片无灌注区,无灌注区附近出现病理性新生血管;HE 染色结果显示,视网膜结构疏松、排列紊乱,内界膜不完整,可见较多的新生血管内皮细胞突破内界膜,均提示OIR模型建立成功。
Mel是松果体分泌的一种内分泌激素,除了调节昼夜节律外,还具有抗炎、抗氧化、抗凋亡及调节血管生成等多种生物学功能[8]。本实验室以往的研究已证实Mel对脑缺血再灌注损伤具有保护作用[9-10]。Xu等[4]的研究证实,Mel可通过抑制视网膜血管新生,减轻OIR 小鼠模型中的视网膜损伤。本研究发现,Mel干预后,视网膜的内界膜基本恢复平整,突出内界膜的新生血管内皮细胞核数减少,病理性新生血管显著减少,说明Mel可改善OIR新生小鼠视网膜的组织学损伤,对视网膜损伤具有保护作用。
目前的研究认为氧化应激和炎症反应可能参与了ROP 的发生发展,因此推测抑制炎症反应、清除氧自由基可能减轻OIR诱导的视网膜损伤。在各种视网膜疾病中,损伤相关的分子模式(damage associated molecular patterns,DAMPs)的释放被认为是连接细胞死亡和炎症的重要生物过程,释放到胞外的DAMPs 通过与模式识别受体结合,如Toll样受体家族、NOD样受体家族,进而将损伤信号转化为分子事件[11]。其中HMGB1是这一过程中的关键分子,通过与TLR4 结合,激活NFκB,诱导IL-1β、IL-6、TNF-α 等炎症因子和趋化因子的产生,这些炎症因子和趋化因子又可募集大量的中性粒细胞浸润,使更多细胞死亡,形成炎症级联反应,从而加重视网膜损伤[12-14]。本研究结果显示,HMGB1、TLR4、NF-κB、TNF-α、Ly-6G在OIR组小鼠视网膜的阳性表达及MPO活性较对照组显著升高,Mel 处理可使之降低。此外,活化的NF-κB 是NLRP3 的上游分子,可调控NLRP3炎性小体的组装[15-16],使pro-caspase-1募集到NLRP3-ASC 复合物上,发生自体的剪切活化,参与IL-1β 的成熟、分泌,而IL-1β 是炎症反应的重要介质[4,17-18],提示NLRP3炎性小体在OIR诱导的炎症反应中充当重要角色。Sui 等[19]的研究证明,OIR模型小鼠中NLRP3、ASC、caspase-1、IL-1β 等的表达升高,而NLRP3 的抑制剂(MCC950)使视网膜的新生血管减少、血管渗漏减轻。另有研究显示,视网膜缺血再灌注诱导的TLR4的表达先于NLRP3炎性小体的活化,并且TLR4的抑制剂吡格列酮可以抑制NLRP3 炎性小体的激活,从而减轻缺血再灌注诱导的视网膜损伤[20-21]。本研究发现,OIR 组小鼠视网膜NLRP3、ASC、procaspase-1、cleaved-caspase-1和IL-1β的阳性反应强度较对照组显著升高,Mel处理可使之降低。以上提示Mel可有效减弱小鼠OIR损伤后视网膜的炎症反应,且Mel可能通过HMGB1/TLR4/NF-κB信号通路抑制OIR 诱导的NLRP3 炎性小体的活化和中性粒细胞浸润。
Baba等[22]研究证实视网膜、角膜等多种眼部组织中均有MT1 和MT2 的表达;Jiang 等[23]报道,在实验性糖尿病视网膜病变中,Mel可以通过受体介导的信号传导对视网膜炎症发挥保护作用,表明Mel 可能通过受体途径对眼部疾病发挥保护作用。本研究结果显示,OIR组MT1、MT2表达显著减少,Mel处理后可挽救OIR诱导的受体丢失,提示Mel对小鼠OIR损伤后视网膜的保护作用可能是通过褪黑素受体途径发挥作用。
综上所述,Mel 可能通过抑制HMGB1/NF-κB/NLRP3 轴减轻OIR 诱导的视网膜损伤,且可能通过褪黑素受体途径发挥作用的。本研究仍存在一些局限性,仅使用免疫荧光染色观察了HMGB1/NF-κB/NLRP3 轴相关因子的表达,后续实验将采用实时荧光定量聚合酶链反应和Western blot技术,检测相关因子mRNA和蛋白质的表达;并观察Mel受体拮抗剂N-乙酰-2-苄基色胺或MT 小干扰RNA对Mel 保护作用的影响,进一步探讨Mel 对OIR 的保护作用的机制,为其在ROP 中的临床应用提供理论基础和实验依据。

