血小板衍生生长因子BB在川崎病血小板增多中的作用及机制研究
沈西伟 汤志远 申娴娟 赵建美
(1.南通大学附属医院儿内科,江苏南通 226001;2.南通大学医学院,江苏南通 226001;3.南通大学附属医院药剂科,江苏南通 226001;4.南通大学附属医院检验科,江苏南通 226001)
川崎病(Kawasaki disease,KD)常伴有血小板增多,好发于KD 第2~3 周。血小板升高增加冠状动脉瘤血栓形成、心肌梗死和死亡的风险[1-2]。反应性血小板增多症(reactive thrombocytosis,RT)指外周血中血小板计数>450×109/L,最常见病因是感染和KD。RT 发病机制主要是血小板生成增加,主要与血小板生成素(thrombopoietin,TPO)升高有关[2-3]。但是,Ishiguro等[4]发现KD病程中血小板计数正常的患儿TPO水平高于健康对照组;在KD 第1 周血小板计数正常时,血清TPO 水平升高;当KD 第2 周血小板计数明显升高达峰值时,TPO 水平没有下降;KD 第3 周时TPO 水平与健康对照组相当。Miura 等[5]发现KD 患儿在起病第3周血小板计数明显升高,TPO水平却在第2周时下降。Alberio[6]发现RT 与TPO 之间没有明显相关性。这些研究[4-6]表明KD 患儿血小板增多的机制尚不清楚。
血小板衍生生长因子(platelet-derived growth factor,PDGF) 成员包括PDGF-AA、PDGF-BB、PDGF-CC、PDGF-DD 等。其中,PDGF-BB 与血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)结合,促进造血干细胞、内皮细胞、平滑肌细胞等增殖,而酪氨酸酶抑制剂如伊马替尼能够抑制PDGFR 活性[7]。PDGF-BB/PDGFR-β信号通路与造血系统关系密切。Kaminski等[8]证明敲除小鼠PDGF-BB和PDGFR-β基因可诱发血小板减少症。杨默等[9]证实PDGF-BB/PDGFR-β 能促进造血干细胞增殖及血小板生成。周丽霞等[10]发现PDGF-BB/PDGFR-β 在原发性血小板增多症中高表达。然而,目前关于KD患儿血小板增多的机制尚不明确。因此,本研究首先在临床层面探究PDGF-BB 在KD 患儿急性期是否升高;其次,在动物层面验证PDGF-BB在KD小鼠中的表达情况及其在血小板生成中的作用;最后,在细胞层面探究PDGF-BB对Dami细胞生成血小板的机制,为KD诊治寻找新的策略。
1 资料与方法
1.1 研究对象
选取2020 年9 月—2022 年10 月我院儿内科住院的40 例KD 患儿为KD 组,其中男23 例(58%)、女17 例(42%);年龄从3 个月至9 岁,平均年龄为(35±23)个月。纳入标准:(1)符合KD 诊断标准[11];(2)病程7 d以内;(3)静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)2 g/kg 单次治疗后体温正常;(4)临床资料完整。排除标准:(1)入院前接受IVIG、糖皮质激素、阿司匹林治疗者;(2)肿瘤及免疫性疾病者。
选取同期在体检中心体检且无感染史的健康儿童40例为健康对照组,其中男26例(65%)、女14 例(35%);年龄从1 个月至9 岁,平均年龄为(37±24)个月。两组在年龄(t=0.438,P=0.662)、性别(χ2=0.474,P=0.491)上比较差异无统计学意义。本研究经我院伦理委员会批准(2018-K021)及家长签署知情同意书。
1.2 细胞和试剂
Dami 细胞株(北纳创联生物科技有限公司,中国);胎牛血清(北京沃卡威生物技术有限公司);CCK-8 试剂(兰杰柯科技有限公司,中国);重组人PDGF-BB(PeproTech,美国);伊马替尼(上海毕得医药科技股份有限公司,中国);Annexin Ⅴ-FITC/PI 凋亡试剂盒、FITC 标记的抗小鼠CD41抗体(武汉伊莱瑞特生物科技股份有限公司, 中国); FITC 标记的抗人CD61 抗体(eBioscience,美国);人PDGF、小鼠PDGF-BB 及肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA 试剂盒(上海源桔生物科技公司,中国);HiScript Ⅲ RT SuperMix for qPCR 、ChamQ SYBR qPCR Master PCR(南京诺唯赞生物科技股份有限公司,中国);乙酰胆碱酯酶染色试剂盒(北京索莱宝科技有限公司,中国);兔抗人Akt、p-Akt及鼠抗人β-actin 抗体(Proteintech,美国);山羊抗兔、山羊抗小鼠荧光二抗(Cell Signaling Technology,美国)。
1.3 ELISA检测PDGF表达
收集KD组入院次日清晨和健康对照组儿童空腹全血3 mL,分离上清冻存于-80℃。ELISA 试剂盒常温冷却,按说明书操作,计算PDGF浓度。
1.4 实验动物及分组
SPF 级3~4 周龄雄性C57BL/6 小鼠90 只[生产许可证号:SCXK(苏)2020-0009,使用许可证号:SYXK(苏)2017-0046],平均体重13~15 g,购于江苏华创信诺医药科技公司,饲养温度20~23℃,湿度50%~60%,12 h 明暗光交替,自由饮水与进食。获南通大学伦理委员会批准(IACUC 20220829-1001)。适应性饲养1 周后将小鼠随机分为3 组:正常组、KD 组和伊马替尼组,每组各30只。
1.5 构建KD小鼠模型
参考Duong等[12]KD造模方法。KD组于第1天以干酪乳杆菌细胞壁提取物0.25 mL(0.5 mg)腹腔注射1次。伊马替尼组于第1天以干酪乳杆菌细胞壁提取物 0.25 mL(0.5 mg)腹腔注射1 次,第2天起以伊马替尼溶液(50 mg/kg)灌胃,1 次/d,持续27 d。正常组第1天腹腔注射等量磷酸缓冲盐溶液(phosphate buffer saline,PBS),然后与KD组于第2 天起分别用等量PBS 灌胃,1 次/d,持续27 d。
1.6 心脏组织苏木精-伊红染色
第14 天每组随机取5 只小鼠的心脏组织,经固定、脱水、石蜡包埋、切片、苏木精-伊红染色后,镜下观察心脏组织,使用Image J 软件分析炎性细胞数量[13]。
1.7 小鼠血常规和细胞因子检测
每组随机取5 只小鼠分别于第0 天行眼眶取血,第3、7、14、21、28天摘眼球取血,将50 μL血样置于抗凝管中,行血常规检测;其余血样离心收集血清,保存-80℃冰箱中,ELISA 检测PDGF-BB及TNF-α。
1.8 小鼠骨髓巨核细胞集落形成单位培养及巨核细胞标记物CD41检测
第21 天每组随机取5 只小鼠颈椎脱臼法处死后,取双侧股骨,消毒后用5 mL 注射器吸取4 mL IMDM培养基冲洗骨髓腔,离心收集细胞。取骨髓细胞2×105/mL接种于6孔板中培养7 d(1 mL培养体系为IMDM 培养基0.6 mL、1%牛血清白蛋白0.1 mL、0.34 mg 氯化钙、10% 牛血浆0.1 mL、50 ng/mL TPO 10 μL)。培养结束后干燥。每孔2 mL 1%多聚甲醛固定15 min,PBS 冲洗后干燥。乙酰胆碱酯酶染色液室温染色4 h 后以50%甲醇、PBS洗涤1次,镜下计数骨髓巨核细胞集落形成单位(megakaryocyte colony forming unit,CFU-MK)。
CD41 是巨核细胞分化成熟标记物。取适量骨髓细胞,100 μL PBS 重悬,加入CD41 单抗5 μL,避光孵育20 min后上机检测。
1.9 细胞培养
Dami 细胞种植于T25 培养瓶中,用含13%胎牛血清的RPMI-1640培养基,在37℃、5%CO2培养箱中培养。
1.10 CCK-8细胞增殖实验
取对数生长期的Dami 细胞接种于96 孔板。PDGF-BB 按0、6.25、12.5、25、50、100 ng/mL 与细胞共培养,在24、48、72 h 时加入10 μL CCK-8试剂,孵育3 h 后酶标仪检测450 nm 处吸光度值。实验独立重复至少3次。
1.11 血小板生成实验及其标记物CD61检测
将PDGF-BB按0、12.5、25、50、100 ng/mL与细胞共培养24 h,PDGF-BB 25 ng/mL+伊马替尼20 μmol/L 与细胞共培养24 h。800 r/min 离心10 min 收集上清,2 500 r/min 离心10 min 收集沉淀即血小板。100 μL PBS 重悬血小板后,用自动血液细胞分析仪检测血小板数量。CD61 是血小板表面标记物。将PDGF-BB 按6.25、25、100 ng/mL 与细胞共培养24 h,用上述同样方法收集血小板,加入CD61 单抗及同型抗体各0.25 μg,避光孵育20 min后上机检测。实验独立重复至少3次。
本部分实验分为对照组、KD 组和伊马替尼组。对照组用含10%正常儿童血清的完全培养基培养;KD 组和伊马替尼组用含10% KD 急性期患儿血清的完全培养基培养,后者同时添加伊马替尼(20 μmol/L)。培养24 h后用上述同样方法收集检测血小板数量。实验独立重复至少3次。
1.12 实时定量PCR检测PDGFR mRNA表达
本部分实验分为对照组、PDGF-BB(25 ng/mL)组、伊马替尼(20 μmol/L)组和联合组(PDGFBB 25 ng/mL+伊马替尼20 μmol/L),培养细胞24 h后提取RNA。按逆转录试剂盒将RNA 逆转录为cDNA,以其为模板,按PCR 试剂盒进行PCR 反应。 引物序列如下, PDGFR- α: 上游5'-GCTTGAAGGCA-GGCACATTTACATC-3', 下游5'-AAGGTTACA-GGAGTCTCGGGATCAG-3'; PDGFRβ:上游5'-CCAGAAGCCATCAGCAGCAAGG-3',下游5'-CGAGCAGGTCAGAACGAAGGTG-3';β-actin:上游 5'-CCTGGCACCCAGCACAAT-3', 下游 5'-GGGCCGGACTCGTCATAC-3'。采用2-ΔΔCt计算结果。实验独立重复至少3次。
1.13 Western blot检测蛋白表达
本部分实验分为对照组、PDGF-BB(25 ng/mL)组、伊马替尼(20 μmol/L)组和联合组(PDGFBB 25 ng/mL+伊马替尼20 μmol/L)。培养细胞24 h后RIPA 裂解液提取蛋白,通过SDS-PAGE 电泳将蛋白转移至PVDF 膜上,快速封闭液室温封闭10 min, 加入一抗Akt、 p-Akt (浓度均为1∶5 000)、β-actin(1∶10 000),4℃过夜。洗膜后室温孵育荧光二抗(1∶10 000)1 h,洗膜后显影。实验独立重复至少3次。
1.14 统计学分析
使用GraphPad Prism 10.0软件对数据进行统计分析。计量资料以均数±标准差(xˉ±s)表示,两组间比较采用Student'st检验,多组间比较采用单因素方差分析,组间两两比较采用Tukey 检验。相关性分析采用Pearson 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组儿童血清PDGF与血常规指标比较
与健康对照组相比,KD 组血清PDGF-BB、白细胞计数、中性粒细胞绝对值及血小板计数增高(P<0.001),红细胞计数及血红蛋白水平降低(P<0.05)。两组PDGF-AA、PDGF-CC、PDGF-DD水平比较差异无统计学意义(P>0.05)。见表1。
表1 两组儿童血清PDGF与血常规指标比较 (± s)
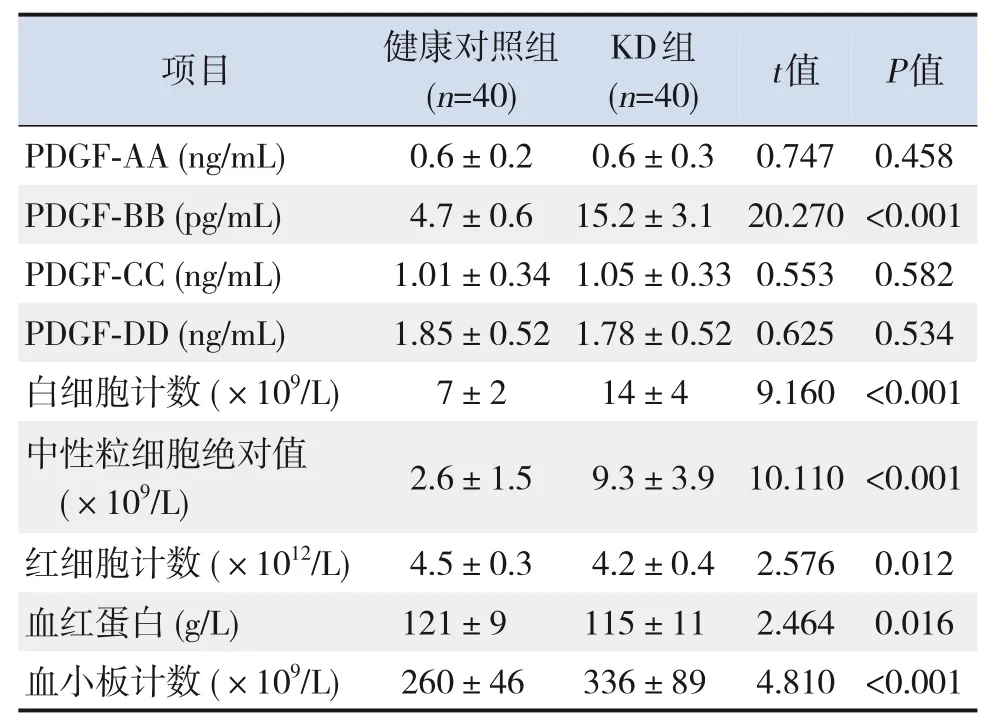
表1 两组儿童血清PDGF与血常规指标比较 (± s)
注:[PDGF]血小板衍生生长因子;[KD]川崎病。
?
2.2 KD 组患儿血清PDGF-BB 与血常规指标的相关性分析
KD组患儿急性期血清PDGF-BB与血小板计数呈正相关(r=0.397,P<0.05),见表2。
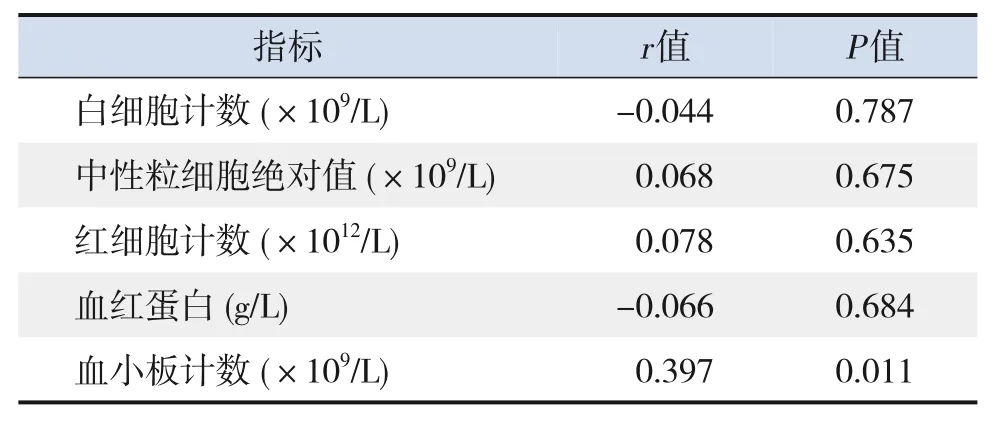
表2 KD组患儿血清PDGF-BB与血常规指标的相关性分析(n=40)
2.3 小鼠冠状动脉病理学变化
与正常组相比,KD 组冠状动脉炎症细胞数量增多(P<0.001);与KD 组相比,伊马替尼组冠状动脉炎症细胞数量变化差异无统计学意义(P>0.05)。见表3。
表3 各组小鼠冠状动脉炎症细胞数量比较 (± s,n=5)
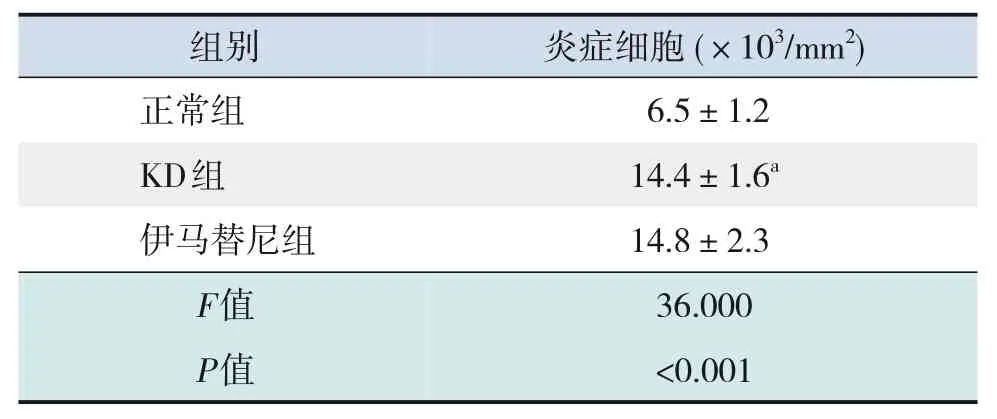
表3 各组小鼠冠状动脉炎症细胞数量比较 (± s,n=5)
注:[KD]川崎病。a示与正常组比较,P<0.05。
?
2.4 小鼠血常规及血清细胞因子比较
与正常组相比,KD组白细胞计数第3、7、14天时升高(P<0.05),血小板计数第7、14、21 天时升高(P<0.001),红细胞计数、血红蛋白水平变化差异无统计学意义(P>0.05)。与KD组相比,伊马替尼组白细胞计数、红细胞计数、血红蛋白水平变化差异无统计学意义(P>0.05),血小板计数第14、21天时降低(P<0.001)。见表4~7。
表4 各组小鼠外周血白细胞计数比较 (± s,n=5,×109/L)
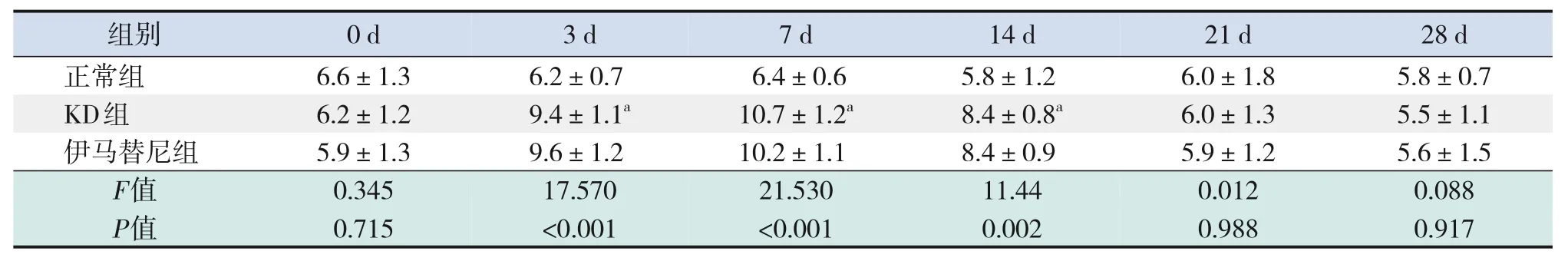
表4 各组小鼠外周血白细胞计数比较 (± s,n=5,×109/L)
注:[KD]川崎病。a示与正常组比较,P<0.05。
?
表5 各组小鼠外周血红细胞计数比较 (± s,n=5,×1012/L)
表5 各组小鼠外周血红细胞计数比较 (± s,n=5,×1012/L)
注:[KD]川崎病。
?
表6 各组小鼠外周血血红蛋白水平比较 (± s,n=5,g/L)
表6 各组小鼠外周血血红蛋白水平比较 (± s,n=5,g/L)
注:[KD]川崎病。
?
表7 各组小鼠外周血血小板计数比较 (± s,n=5,×109/L)
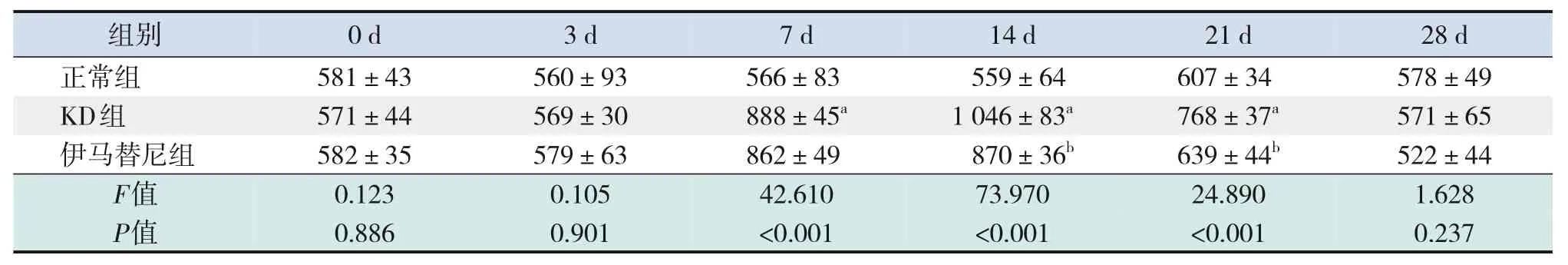
表7 各组小鼠外周血血小板计数比较 (± s,n=5,×109/L)
注:[KD]川崎病。a示与正常组比较,P<0.05;b示与KD组比较,P<0.05。
?
与正常组相比,KD 组第3、7、14、21 天时PDGF-BB、TNF-α浓度升高(P<0.05);与KD组相比,伊马替尼组PDGF-BB、TNF-α 变化差异无统计学意义(P>0.05)。见表8~9。
表8 各组小鼠血清PDGF-BB浓度比较 (± s,n=5,pg/mL)
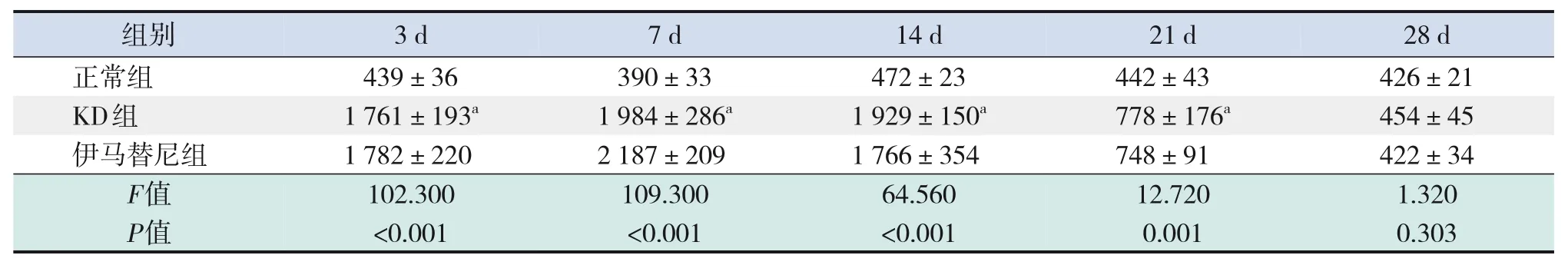
表8 各组小鼠血清PDGF-BB浓度比较 (± s,n=5,pg/mL)
注:[KD]川崎病。a示与正常组比较,P<0.05。
?
表9 各组小鼠血清TNF-α浓度比较 (± s,n=5,pg/mL)

表9 各组小鼠血清TNF-α浓度比较 (± s,n=5,pg/mL)
注:[KD]川崎病。a示与正常组比较,P<0.05。
?
2.5 各组小鼠CFU-MK 及巨核细胞标记物CD41的比较
KD 组CFU-MK 数量高于正常组(P<0.001),伊马替尼组CFU-MK 数量低于KD 组(P<0.001)。KD组CD41表达高于正常组(P<0.001),伊马替尼组CD41表达低于KD组(P<0.001)。见表10。
表10 各组小鼠CFU-MK数量、CD41表达的比较(± s)
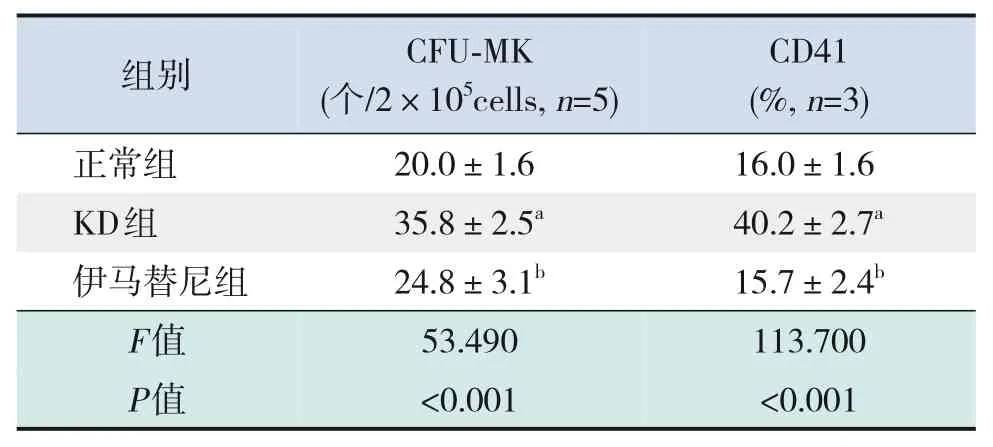
表10 各组小鼠CFU-MK数量、CD41表达的比较(± s)
注:[KD]川崎病;[CFU-MK]巨核细胞集落形成单位。a示与正常组比较,P<0.001;b示与KD组比较,P<0.001。
?
2.6 PDGF-BB对Dami细胞增殖的影响
PDGF-BB与Dami细胞共培养24、48、72 h后,PDGF-BB 对Dami 细胞的增殖作用与其浓度有关。24 h、72 h时PDGF-BB 25 ng/mL促进细胞增殖的作用最显著(P<0.05);48 h 时PDGF-BB 25 ng/mL 促进细胞增殖的作用与PDGF-BB 12.5 ng/mL 相当,优于其他浓度组(P<0.05)。见表11。
表11 不同浓度PDGF-BB对Dami细胞增殖的影响(± s,n=5)
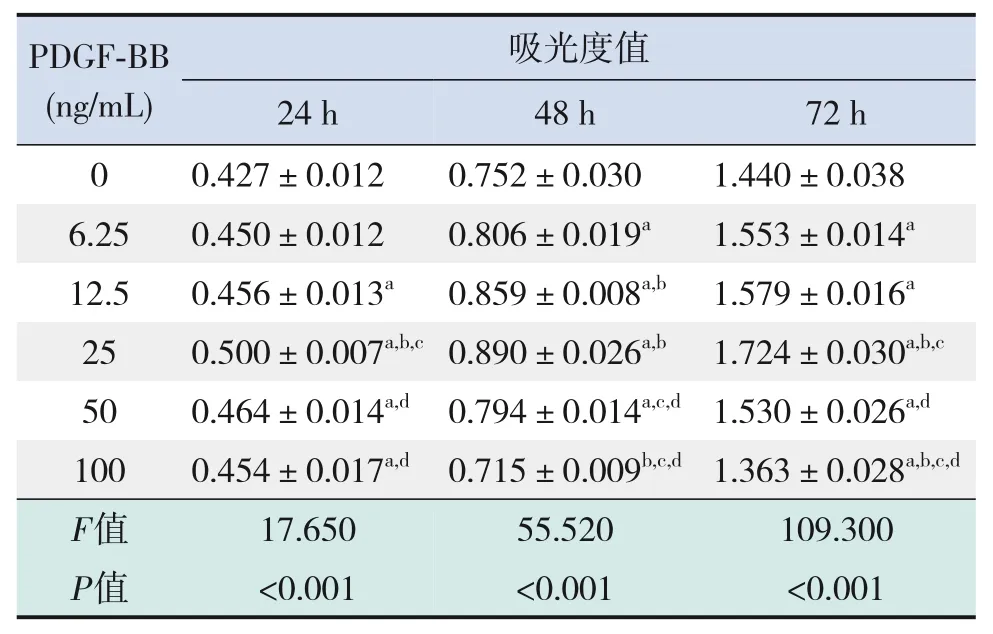
表11 不同浓度PDGF-BB对Dami细胞增殖的影响(± s,n=5)
注:[PDGF]血小板衍生生长因子。a示与0 ng/mL组比较,P<0.05;b 示与6.25 ng/mL 组比较,P<0.05;c 示与12.5 ng/mL 组比较,P<0.05;d示与25 ng/mL组比较,P<0.05。
?
2.7 KD 急性期患儿血清与PDGF-BB 对血小板生成的影响
Dami 细胞单独培养时,未检测到血小板。与对照组相比,KD组血小板生成增加,加入伊马替尼后血小板生成减少(P<0.05)。不同浓度的PDGF-BB 可诱导Dami 细胞生成血小板,PDGF-BB 25 ng/mL 加入伊马替尼后血小板生成减少(P<0.001)。见表12~13。
表12 KD急性期患儿血清对血小板生成的影响(± s,n=5)
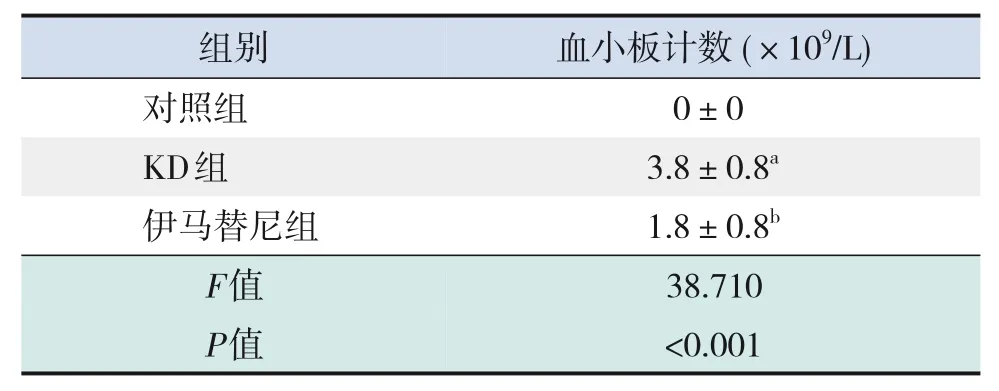
表12 KD急性期患儿血清对血小板生成的影响(± s,n=5)
注:[KD]川崎病。a 示与对照组比较,P<0.001;b 示与KD组比较,P<0.05。
?
表13 PDGF-BB对血小板生成的影响 (± s,n=5)
注:[PDGF]血小板衍生生长因子。a示与0 ng/mL组比较,P<0.001;b示与25 ng/mL组比较,P<0.001。
?
2.8 PDGF-BB对血小板标记物CD61的影响
PDGF-BB 6.25、25、100 ng/mL 作用于Dami 细胞24 h后,CD61表达比例分别为(14.4±1.2)%、(25.3±4.4)%、(18.4±1.6)%,差异有统计学意义(F=11.850,P=0.008)。经组间两两比较,25 ng/mL 组CD61 表达比例高于6.25 ng/mL 组(P<0.05)。
2.9 PDGF-BB 对Dami 细胞PDGFR mRNA 的影响
与对照组相比,PDGF-BB 组PDGFR-α mRNA表达无显著变化(P>0.05),PDGFR-β mRNA 表达增加,加入伊马替尼后PDGFR-β mRNA 表达下调(P<0.05),见表14。
表14 各组Dami细胞PDGFR mRNA相对表达量的比较(± s,n=3)
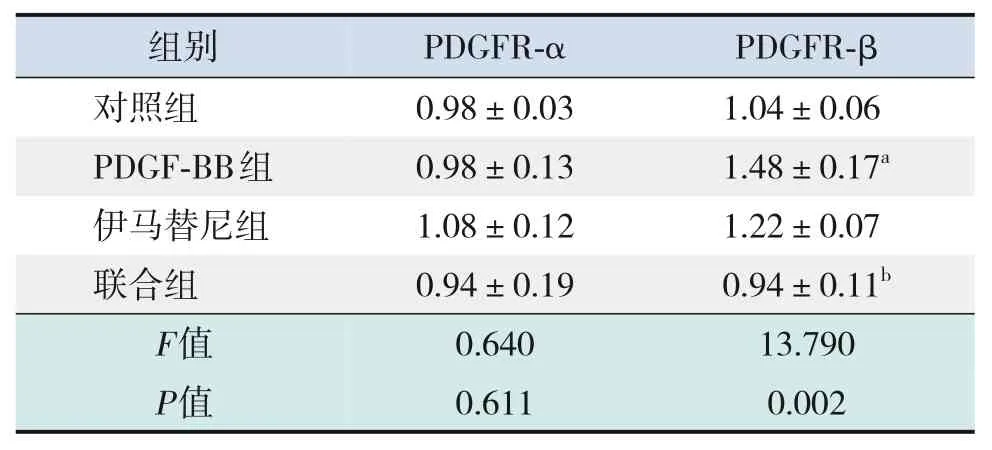
表14 各组Dami细胞PDGFR mRNA相对表达量的比较(± s,n=3)
注:[PDGF]血小板衍生生长因子;[PDGFR]血小板衍生生长因子受体。a示与对照组比较,P<0.05;b示与PDGF-BB组比较,P<0.05。
?
2.10 PDGF-BB 对Dami 细胞PI3K/Akt 通路的影响
与对照组相比,PDGF-BB组Akt蛋白表达差异无统计学意义(P>0.05),p-Akt 蛋白表达增加(P<0.05);与PDGF-BB组相比,联合组Akt蛋白表达差异无统计学意义(P>0.05),p-Akt蛋白表达下调(P<0.05)。见图1、表15。
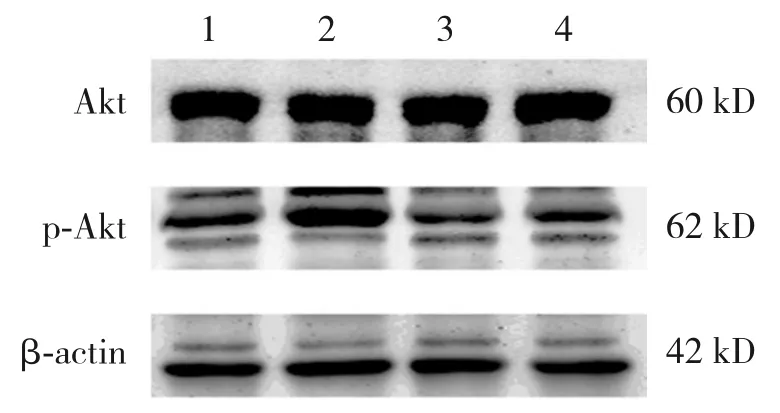
图1 Western blot 检测各组Dami 细胞中Akt、p-Akt蛋白表达电泳图 1:对照组;2:PDGF-BB 组;3:伊马替尼组;4:联合组。
表15 各组Dami细胞Akt、p-Akt蛋白相对表达量的比较(± s,n=3)
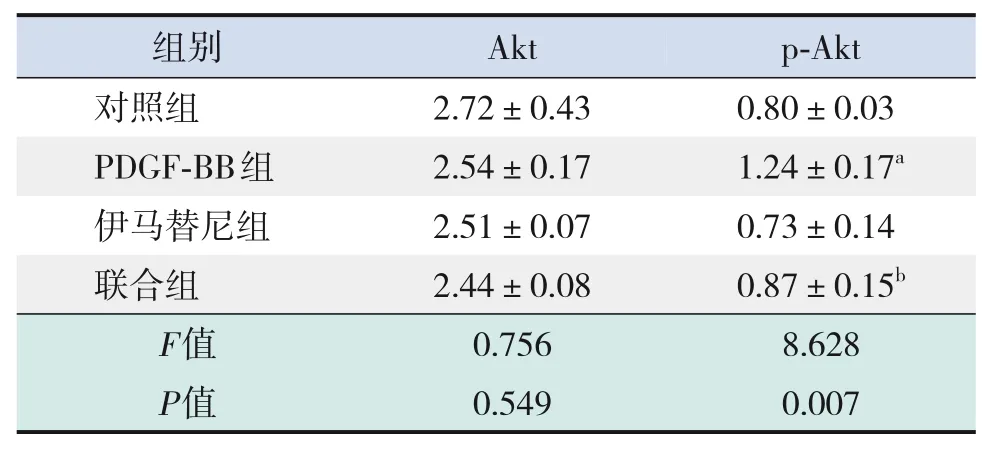
表15 各组Dami细胞Akt、p-Akt蛋白相对表达量的比较(± s,n=3)
注:[PDGF]血小板衍生生长因子。a 示与对照组比较,P<0.05;b示与PDGF-BB组比较,P<0.05。
?
3 讨论
本研究通过病例研究发现PDGF-BB在KD患儿急性期血清中高表达,与血小板计数呈正相关,提示PDGF-BB可能参与血小板生成。通过KD小鼠模型,证实PDGF-BB在KD小鼠中高表达,并促进CFU-MK形成、巨核细胞分化及血小板生成。通过细胞实验证实Dami细胞在PDGF-BB诱导下高表达PDGFR-β mRNA 及p-Akt 蛋白,伊马替尼抑制PDGFR-β 后,下调巨核细胞CD41、PDGFR-β mRNA 及p-Akt 蛋白表达,影响血小板生成。这与罗毅等[14]证实PDGF-BB在骨髓抑制小鼠模型中促进巨核细胞增殖和血小板生成的结论相符合。
PDGFR 属于受体酪氨酸酶,受到刺激时表达增加[15]。Yang 等[16]证实Dami 细胞表达PDGFR-α和PDGFR-β。当PDGFR-α 和PDGFR-β 同时存在时,PDGF-BB优先与PDGFR-β结合[17]。研究发现PDGFR 抑制剂伊马替尼可导致血小板减少[18]。机制可能是伊马替尼抑制PDGFR-β,阻滞PI3K/Akt信号通路,影响巨核细胞增殖及血小板生成[19-20]。
尽管血小板计数升高反映KD炎症与疾病的严重程度,但本研究发现抑制PDGFR 导致血小板计数减少并未减轻KD 炎症,原因可能是KD 主要由异常的免疫激活、细胞因子风暴、内皮细胞损伤等多种因素引起[1],而PDGF-BB/PDGFR 只是众多细胞因子网络通路中的一员,单独抑制PDGFR 可能不会直接减轻KD冠状动脉炎症。
综上所述,本研究通过体内外实验,初步探究了PDGF-BB在KD血小板增多中的作用。PDGFBB 可能通过与PDGFR-β 结合,激活PI3K/Akt 通路,促进巨核细胞的增殖、分化,调节血小板的生成,而伊马替尼能对抗PDGF-BB的促增殖作用、减少血小板的生成,这为KD的治疗提供了一个新的靶点。本研究仍有不足之处,由于骨髓中的巨核细胞数量非常少,无法为实验提供稳定的原代细胞来源,研究的借鉴意义相对受限;同时细胞之间的信号通路复杂有待进一步的研究。
利益冲突声明:所有作者声明无利益冲突。

