儿童重症腺病毒性肺炎风险模型的构建及静脉注射免疫球蛋白治疗时机的前瞻性研究
蔡莎 朱春晖 陈方根 刘飞 高美玲 熊艳
(江西省儿童医院感染科,江西南昌 330000)
人腺病毒(human adenovirus,HAdV)是儿童呼吸道感染常见的病原体。腺病毒性肺炎(adenoviral pneumonia,AVP)约占儿童重症肺炎的32.2%,也是导致死亡和预后不良的重要原因[1]。有报道称存活者中l4%~60%存在慢性气道和肺部疾病后遗症[2]。目前尚无特效的抗腺病毒药物,且病毒的重组、变异导致治疗难度增加。越来越多研究[3-5]指出,静脉注射免疫球蛋白(intravenous imunoglobulin,IVIG)用于重症腺病毒性肺炎(severe adenoviral pneumonia,SAP)的治疗可提高疗效,缩短病程,且在病程早期使用IVIG 可缩短发热时间,减少对机械通气的需求,降低后遗症的发生率[4]。目前尚无实用的SAP 评估方案以指导IVIG 的使用,且仍有部分患儿因治疗不及时、病情进展而死亡。本研究拟构建SAP风险评分模型,并据此模型对AVP 患儿进行个体化预测,识别SAP 的发生,并指导IVIG 的使用,以寻求IVIG的最佳治疗时机。
1 资料与方法
1.1 研究对象
回顾性纳入2010 年1 月—2019 年12 月在我院住院的AVP 患儿进行SAP 风险评分模型的构建。按此模型对前瞻性纳入的2021 年1—12 月我院收治的AVP 患儿进行SAP 风险评分,以探讨IVIG 的治疗时机及疗效。本研究已通过我院医学伦理委员会审核批准(JXSETYY-YXKY-202000127),且已获得受试者监护人知情同意并签署知情同意书。
1.2 方法
本研究包括回顾性研究和前瞻性研究两部分。
1.2.1 回顾性研究 纳入标准:(1) 年龄≤14岁;(2)AVP的诊断符合《儿童腺病毒肺炎诊疗规范(2019 年版)》中AVP 的诊断标准[6]。排除标准:临床资料缺失。根据患儿的病情严重程度分为SAP 组(重症组)[7]和非SAP 组(非重症组)。收集两组患儿的病例资料,包括性别、年龄、有无基础病(先天性心脏病、反复呼吸道感染、先天性气道发育异常、原发性免疫缺陷病、继发性免疫缺陷病)、热程、实验室检查[白细胞(white blood cell, WBC) 计数、 血红蛋白(hemoglobin,Hb)、血小板(palatelet,PLT) 计数、C 反应蛋白(C-reaction protein)、降钙素原(procalcitonin, PCT)、 谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase, AST)、 乳酸脱氢酶(lactate dehydrogenase,LDH)],以及是否合并细菌、其他病毒或不典型病原菌感染;并进行统计学分析,找出SAP 的可能危险因素,纳入回归模型并构建风险评分模型。再选取2020 年1—12 月在我院住院且符合纳入标准的102例AVP患儿为验证组,对模型进行验证。
1.2.2 前瞻性研究 纳入标准:(1)年龄≤14岁;(2)所有患儿均经呼吸道深部分泌物免疫荧光法检测显示腺病毒IgM抗原阳性且符合《儿童腺病毒肺炎诊疗规范(2019 年版)》中AVP 的诊断标准[6];(3)按照小儿危重病例评分法(Pediatric Critical Illness Score,PCIS)评价标准评定为非危重AVP[8];(4)经本研究构建的风险评分模型判定为有发展为SAP 的高危患儿。排除标准:(1) 入院时已达到重症肺炎的诊断标准[7];(2)中途放弃治疗;(3)临床资料不全。按就诊时间顺序分为A、B、C 3组。A组:仅给予对症支持治疗;B组:除对症支持治疗外,在患儿进展为SAP 前给予IVIG 静脉滴注,1 g/(kg·d),连续2 d;C组:除对症支持治疗外,在患儿进展为SAP后给予IVIG 静脉滴注,1 g/(kg·d),连续2 d。比较3 组患儿的发热时间、气促持续时间、住院时间、住院费用、治疗前及治疗3~5 d后炎症指标(WBC计数、CRP、PCT等)、治疗前及治疗3~5 d后细胞因子[白细胞介素(interleukin,IL)-1、IL-2、IL-6、IL-8、IL-10、肿瘤坏死因子α (tumor necrosis factor α,TNF-α)]、并发症发生率、结局、IVIG不良反应发生情况等。
1.2.3 定义与标准 (1)对症支持治疗指氧疗、清理呼吸道分泌物、退热、止咳祛痰平喘、抗感染等治疗。(2)PCIS评价标准:>80分为非危重;71~80 分为危重;≤70 分为极危重[8]。(3)并发症指呼吸衰竭、急性呼吸窘迫综合征、纵隔气肿或皮下气肿、胃肠功能障碍、中毒性脑病或脑炎、脓毒症、噬血细胞性淋巴组织细胞增生症。(4)疗效判断标准[3]:根据出院时的临床特征和胸部X线检查结果判定。治愈:患儿发热、咳嗽及肺部啰音等肺炎症状/体征消失,胸部X 线检查显示病灶完全吸收;好转:患儿临床症状及体征显著缓解,胸部X 线检查显示病灶明显吸收;未愈:患儿临床症状及体征无好转或加重,甚至死亡,胸部X线检查显示病灶无改善。治疗有效率=(治愈例数+好转例数)/总例数×100%。(5)IVIG 不良反应:输注IVIG 过程中及输注后出现输注部位疼痛、肿胀,以及发热、皮疹、畏寒、全身酸痛、头痛、心慌、恶心、低血压等全身不良反应[9]。
1.3 统计学分析
应用SPSS 22.0 软件进行数据处理与分析。计数资料以例数和百分率(%)表示,组间比较采用卡方检验;正态分布的计量资料以均值±标准差(±s)表示,组间比较采用单因素方差分析,多组间两两比较采用Bonfferroni检验;非正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验或Kruskal-WallisH检验,多组间两两比较采用Bonfferroni 检验。P<0.05 为差异有统计学意义。将P<0.05 的变量纳入多因素logistic 回归分析确定危险因素,对各危险因素的B值进行简化赋分,构建风险评分模型。采用受试者操作特征曲线(receiver operating characteristic curve,ROC 曲线)曲线下面积(area under the curve,AUC)评价模型区分度。采用Hosmer-Lemeshow检验评价模型校准度,P>0.05表明模型校准度较好。
2 结果
2.1 回顾性研究的研究对象纳入情况
共1 159 例符合纳入标准,其中113 例因资料缺失被排除,最终纳入1 046例AVP患儿(重症组705例,非重症组341例)。
2.2 重症组和非重症组临床特征的比较
单因素分析显示重症组和非重症组年龄、患基础病比例、热程、Hb、ALT、AST、LDH、合并细菌感染比例的比较差异有统计学意义(P<0.05),见表1。采用最大约登指数确定上述单因素分析中有统计学意义的连续变量的最佳界值(表2),以此为界点将这些连续变量转换为二分类变量。

表1 非重症组和重症组临床特征的比较
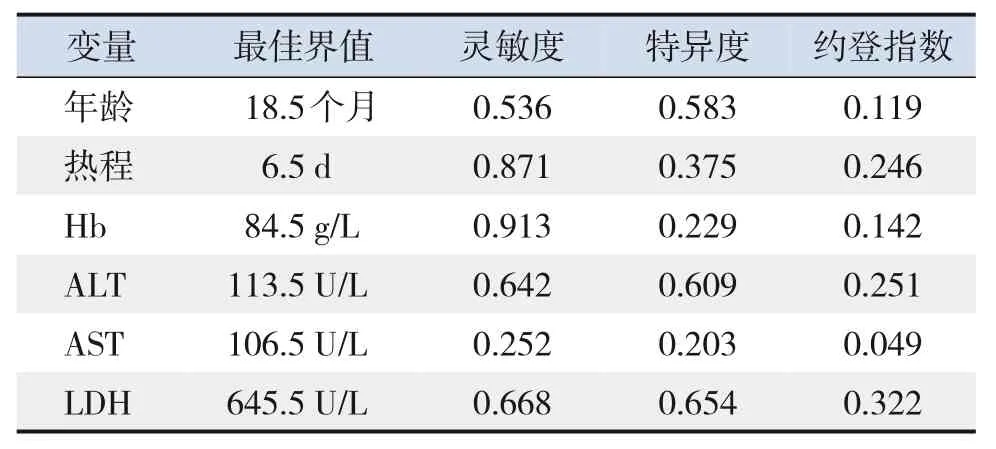
表2 连续变量的最佳界值
2.3 SAP危险因素的多因素logistic回归分析
多因素logistic 回归分析显示,年龄<18.5 个月、基础病、热程>6.5 d、Hb<84.5 g/L、ALT>113.5 U/L、合并细菌感染是发生SAP 的危险因素(P<0.05),见表3。

表3 SAP危险因素的多因素分析
2.4 构建SAP风险模型及效果评价
将年龄<18.5 个月、基础病、热程>6.5 d、Hb<84.5 g/L、ALT>113.5 U/L、合并细菌感染6个危险因素纳入模型,其中年龄<18.5 个月的B值最小(0.594),将各危险因素的B值除以0.594为各风险权重并取整数赋值,得到该模型的评分标准为:年龄<18.5 个月(1 分)、基础病(1 分)、热程>6.5 d(3分)、Hb<84.5 g/L(1分)、ALT>113.5 U/L(1分)、合并细菌感染(2分)。如存在该危险因子取相应分值,不存在则取0分,总分为9分。
该模型的AUC为0.862(95%CI:0.837~0.888,P<0.001;图1A),其最大约登指数为0.726,灵敏度和特异度分别为0.878 和0.848,最佳界值为2.5分,四舍五入取3 分。Hosmer-Lemeshow 检验显示该模型的校准度较好(χ2=2.951,P=0.937)。
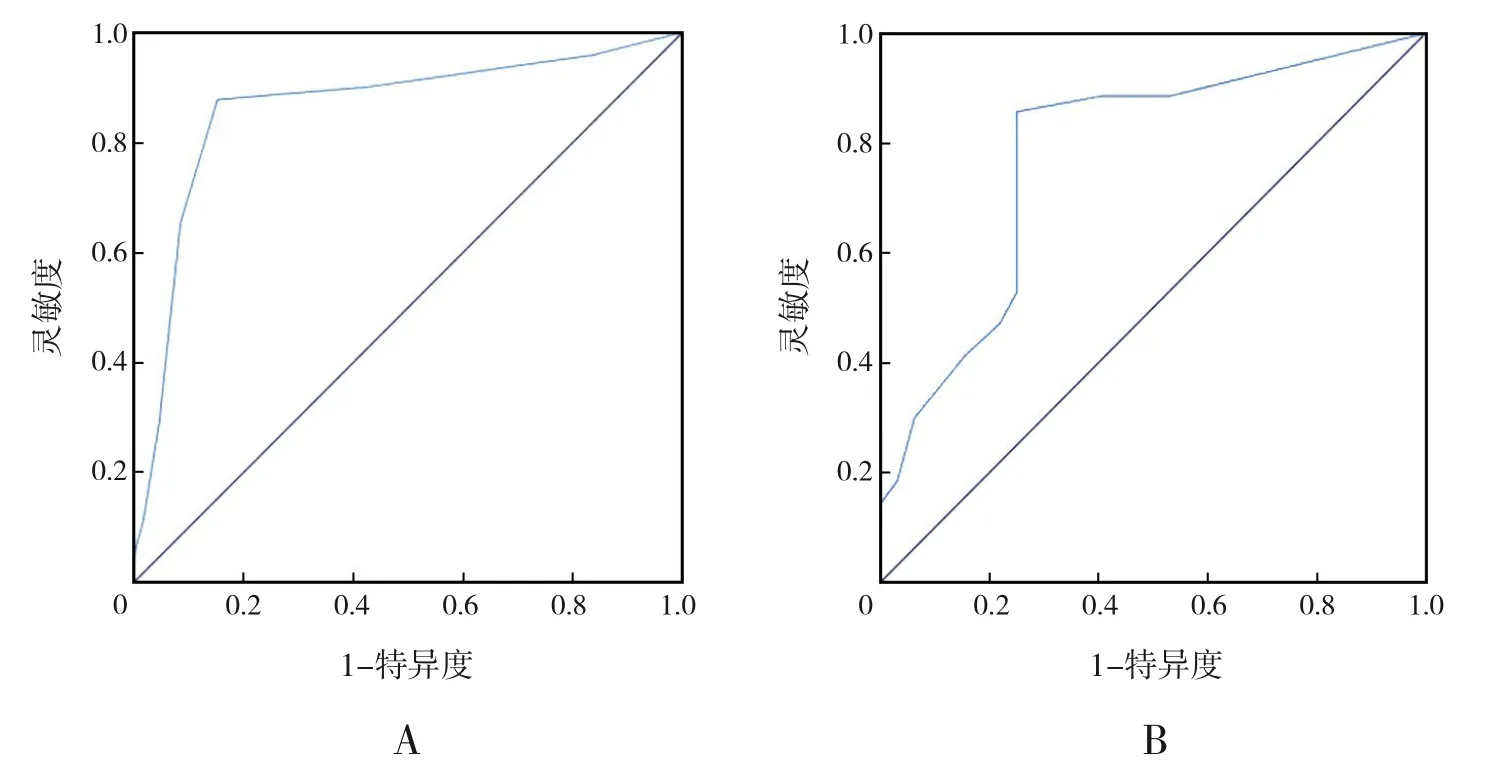
图1 模型组(图A)和验证组(图B)SAP发生风险的ROC曲线分析
2.5 SAP风险模型的验证
ROC 曲线分析显示,验证组预测SAP 发生风险模型的灵敏度为0.857,特异度为0.750,AUC为0.778(95%CI:0.676~0.881,P<0.001),见图1B。Hosmer-Lemeshow 检验显示该模型的校准度较好(χ2=6.094,P=0.637)。
2.6 前瞻性研究病例的临床特点及3 组患儿治疗前后相关指标的比较
根据本SAP 风险预测模型,有75 例患儿评定为有SAP 高危风险,其中A、B、C 3 组各25 例,病例纳入流程见图2。

图2 前瞻性研究病例纳入流程图
A、B、C 3组患儿治疗前基线资料的比较差异均无统计学意义(P>0.05),见表4。治疗后,3组患儿的发热时间、住院时间、住院费用、治疗有效率、并发症发生率、WBC 计数及CRP、IL-1、IL-2、IL-6、IL-8、IL-10、TNF-α 水平的比较差异均有统计学意义(P<0.05)。其中B 组发热时间和住院时间最短,住院费用最低,治疗有效率最高,并发症发生率最低,WBC 计数最低,IL-1、IL-2、IL-6、IL-8、IL-10 水平最低,TNF-α 水平最高。3组均无死亡病例;IVIG 后不良反应发生率的比较差异无统计学意义(P>0.05)。见表5。

表4 3组患儿的基线资料比较
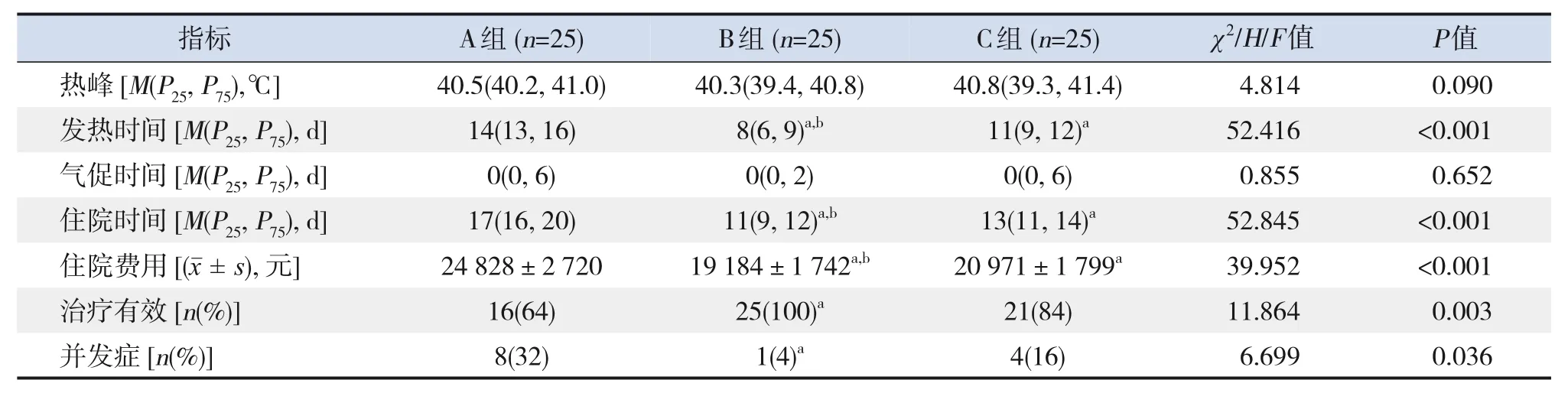
表5 治疗后3组患儿相关指标的比较
3 讨论
研究表明,5%感染HAdV 的儿童会进展为肺炎,每年约130 万儿童死于HAdV 感染[10-11],AVP的病死率为12%,未经治疗者则高达50%[12-13],30% AVP 患儿遗留不同程度的后遗症,如闭塞性细支气管炎、支气管扩张[14]。
针对SAP,目前以对症支持治疗为主,尚缺乏特异性的抗病毒药物。研究指出,IVIG 用于SAP的治疗,可明显改善临床疗效,缩短病程[3,6],但仍有患儿因治疗不及时、病情进展而死亡;而对AVP 盲目地使用IVIG,不仅增加患儿家庭的经济负担,还会导致医疗资源的浪费。因此对AVP 患儿需进行个体化治疗。
本研究通过构建SAP 风险评估模型以此探讨IVIG 的最佳使用时机,这在国内尚属罕见。有研究构建发生AVP 危险因素的预测模型,显示Hb、AST、LDH 与AVP 发生风险有关[15];单核细胞百分比、PLT、AST、IL-6、热峰、肺部大片实变、肺部斑片状阴影是SAP 发生的独立预测因子[16]。本研究单因素分析也显示,年龄、Hb、AST、LDH是SAP 发生的影响因素。这可能与小年龄儿童免疫功能不完善、贫血时营养状况差、感染易扩散有关。多因素logistic 回归分析显示年龄<18.5 个月、基础病、热程>6.5 d、Hb<84.5 g/L、ALT>113.5 U/L、合并细菌感染共6 个因素是SAP 的独立预测因子。ROC曲线分析及Hosmer-Lemeshow检验显示该模型的一致性和校准度较好,对AVP 进展为SAP 的风险有较好的预测价值。除此之外,本研究还据此构建模型对AVP 患儿进行评分,认为评分≥3 分者具有发生SAP 的风险。在前瞻性研究中,B 组患儿在进展为SAP 前给予IVIG 治疗后,与其他两组患儿比较,发热时间和住院时间均最短,住院费用最低,治疗有效率最高,并发症发生率最低。究其原因,IVIG 作为人体主要的免疫蛋白,可抑制抗原和抗原复合物的形成,可提高机体免疫力;还可阻断细胞Fc 受体,抑制细胞因子的生成和释放,中和炎症因子、毒素、相关抗原[17],减轻肺部的炎性渗出,减少肺部实变、肺不张的风险,从而减轻临床症状,缩短住院时间,减少并发症的发生。
HAdV感染的严重程度和机体免疫状态密切相关,免疫系统激活及细胞因子风暴在重症HAdV感染中起着重要作用。急性感染期,单核巨噬细胞和T 淋巴细胞会合成释放大量IL-6,还可诱导T 细胞分化,进而促进其他炎性因子的释放,导致炎症加重[18-19]。有文献报道AVP 患儿的IL-1、IL-6、IL-8、TNF-α水平高于正常儿童,且重症组高于非重症组[20]。本研究对高危组患儿在进展为SAP 前使用IVIG,治疗后WBC 计数及IL-1、IL-2、IL-6、IL-8、IL-10 水平均最低。考虑与IVIG 中存在着丰富的TNF-α、IL-1、IL-6 等自身抗体,能直接中和这些细胞因子,从而达到减轻炎症的目的。B组和C组患儿在输注IVIG后各有1例出现皮疹,二者无差异,提示在进展为SAP 前给予IVIG 治疗安全有效,未增加其不良反应的发生。
综上,本研究以年龄<18.5 个月、基础病、热程>6.5 d、Hb<84.5 g/L、ALT>113.5 U/L、合并细菌感染为预测因子构建的风险评分模型对AVP 患儿进行个体化预测、早期识别SAP 的发生,以及指导IVIG 的治疗时机有重要价值;根据风险模型评分,在AVP 患儿进展为SAP 前给予IVIG 干预,安全有效。本研究系单中心研究,结果可能存在偏倚,有必要进行多中心研究验证或进一步完善该风险评分模型,以便更好地指导临床工作。

