TIM-3、hPEBP4在多发性骨髓瘤患者BMCS中的水平及其与体内硼替佐米累积量的相关性研究*
韩东海,骈晓琴,申清云,张亚朋,高 大
内蒙古医科大学附属医院血液内科,内蒙古呼和浩特 010050
多发性骨髓瘤多发于老年人群,为浆细胞恶性增生疾病[1]。该骨髓瘤是因大量单克隆恶性浆细胞增殖引发,贫血、肾功能损伤、骨痛等为其常见并发症。多发性骨髓瘤的完全缓解率较低,患者复发率高,若不及时进行合理治疗,对患者生命健康有一定威胁[2-3]。T细胞免疫球蛋白黏蛋白(TIM)-3为新型免疫负性调控因子,为TIM基因家族成员,在T辅助细胞与细胞毒性T细胞中表达而产生抑制信号,使其细胞发生凋亡[4]。研究显示,TIM-3在多种肿瘤组织表面有表达,肿瘤组织浸润T细胞表面致使TIM-3水平升高,且与肿瘤患者预后机体T细胞功能障碍有关。磷脂酰乙醇胺结合蛋白(PEBP)为天然抑制蛋白,能调节核因子-κB等通路,调节细胞增殖分化与凋亡过程[5]。研究显示,PEBP4过度表达与肺癌、乳腺癌等发生和肿瘤细胞的放化疗抵抗有一定关联,目前关于其与多发性骨髓瘤的研究较少。目前治疗多发性骨髓瘤的方式有化疗、造血干细胞移植等,但均以化疗为基础,硼替佐米为蛋白酶体抑制剂,是根据蛋白质降解机制研发的双肽基硼酸盐衍生物,该药为首个用于治疗多发性骨髓瘤的抑制剂。硼替佐米在多发性骨髓瘤治疗中具有显著优越性,但关于其在体内累积量的相关研究较少[6]。本研究通过检测多发性骨髓瘤体内硼替佐米不同积累量患者骨髓来源细胞(BMCs)中TIM-3、人磷脂酰乙醇胺结合蛋白4(hPEBP4)水平,分析TIM-3、hPEBP4表达与硼替佐米积累量的关系。
1 资料与方法
1.1一般资料 选取2019年3月至2021年12月本院收治的126例多发性骨髓瘤患者为研究组,其中男71例,女55例;年龄为48~76岁,平均(62.48±10.06)岁。纳入标准:符合《中国多发性骨髓瘤诊治指南(2020年修订)》标准[7],确诊为多发性骨髓瘤,且经病理检查确诊为浆细胞瘤;初次治疗患者;预生存期超过半年;患者签署知情同意书。排除标准:存在化疗禁忌证;有脑血管疾病;有自身免疫性疾病;对本研究药物不耐受;肝肾功能不全;有精神疾病。同期选取30例骨质疏松患者为骨质疏松组,男17例,女13例;年龄为46~74岁,平均(58.69±10.03)岁。另选取于本院体检的50例体检健康者为对照组,其中男29例,女性21例;年龄为45~75岁,平均(59.64±9.88)岁。各组年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。本研究通过医院伦理委员会批准。
1.2仪器与试剂 仪器:高速离心机、流式细胞仪均购自美国贝克曼库尔特公司;试剂:人淋巴细胞分离液(Ficoll)购自美国sigma公司,鼠抗人CD3、CD4、CD8单克隆抗体购自美国biolelgend公司,PE标记鼠抗人TIM-3单克隆抗体购自美国R&D公司,hPEBP4试剂盒购自武汉优尔生公司;药物:注射用硼替佐米(国药准字H20193175,规格3.5 mg)购自先声药业有限公司,地塞米松磷酸钠注射液(国药准字H53020670,规格1 mL∶5 mg)购自昆药集团股份有限公司。
1.3TIM-3与hPEBP4检测方法 采集受试者BMCs中骨髓液,提取其血清后冷冻保存。使用Ficoll密度梯度离心法将单核细胞从骨髓抽吸物中分离,放于显微镜下利用牛鲍氏计数板计数,并重悬在10%胎牛血清中使细胞终浓度至1×107/mL备用。分离单核细胞中留下的血清于液氮状态下保存。用带有荧光标记素的鼠抗人单克隆抗体检测TIM-3在T细胞上的表达分子;避光下将以上抗体分离出的单核细胞染色并孵育,待抗原抗体孵育后用流式洗涤液洗涤,重悬于磷酸盐缓冲液内。使用FlowJo软件程序分析流式细胞术检测的数据:CD3+CD4+TIM-3占CD3+CD4+T细胞百分比、CD3+CD8+TIM-3占CD3+CD8+T细胞百分比。采用酶联免疫吸附试验检测血清中hPEBP4水平,hPEBP4试剂盒来源于武汉优尔生公司,检测步骤严格参照试剂盒说明书进行。
1.4硼替佐米化疗 患者行以地塞米松为主的联合化疗,方法:第1、4、8、11天分别以1.3 mg/m2标准快速注射硼替佐米;在第1~4天、第9~12天静注20 mg地塞米松,以3周为1疗程,患者持续治疗3疗程。
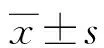
2 结 果
2.13组TIM-3、hPEBP4水平比较 研究组CD3+CD4+TIM-3、CD3+CD8+TIM-3 T细胞百分比和hPEBP4水平高于骨质疏松组、对照组(P<0.05),见表1。
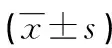
表1 3组TIM-3、hPEBP4水平比较
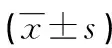
表2 低、高累积量组TIM-3、hPEBP4水平比较
2.2患者化疗后体内硼替佐米累积量 经3个疗程化疗后,患者体内硼替佐米累积量为(21.86±4.28)mg/m2。以硼替佐米中位累积量21 mg/m2为临界值[8],将累积量<21 mg/m2作为低累积量组,共54例;≥21 mg/m2作为高累积量组,共72例。
2.3低、高累积量组TIM-3、hPEBP4水平比较 高累积量组CD3+CD4+TIM-3、CD3+CD8+TIM-3 T细胞百分比和hPEBP4水平低于低累积量组(P<0.05),见表1。
2.4患者TIM-3、hPEBP4水平与体内硼替佐米累积量的相关性 经Pearson相关分析结果显示,TIM-3、hPEBP4水平与体内硼替佐米累积量呈负相关(P<0.05)。见表3。

表3 患者TIM-3、hPEBP4水平与体内硼替佐米累积量的相关性
3 讨 论
多发性骨髓瘤的发病机制复杂,目前临床尚无根治该病的方法,化疗为其主要治疗手段。VAD化疗方案(长春新碱+表柔比星+地塞米松)对癌细胞具有较强的杀伤力,但难以有效延长生存期限[9-10]。随着硼替佐米的上市,为多发性骨髓瘤治疗提供了新思路,该药物对多种类型肿瘤细胞的毒性较强,对多发性骨髓瘤治疗有确切疗效,能提高患者完全缓解率[11]。硼替佐米属于硼酸二肽衍生物,是一种人工合成的靶向药物,能降低细胞因子水平,可逆性结合26S蛋白酶体以抑制其活性,能阻断细胞中大多蛋白降解途径,诱导癌细胞凋亡以发挥抑制癌细胞扩散与生长作用[12-13]。
TIM-3为免疫负性调控因子,该物质在细胞免疫调节与肿瘤免疫逃逸等过程中有重要作用,是目前临床中研究的热点因子[14]。该因子均表达于T细胞表面,与其配体相互作用,使T细胞发生负性调控活化,共同作用后对肿瘤发生具有促进作用[15]。不同血液系统肿瘤中以免疫检查点变化为基础的免疫抑制具有明显差异,其中以TIM-3变化最为显著。本研究中多发性骨髓瘤患者体内CD3+CD4+TIM-3、CD3+CD8+TIM-3 T细胞百分比高于骨质疏松组、对照组,提示TIM-3参与多发性骨髓瘤的发生。TIM-3高表达可抑制多发性骨髓瘤患者T细胞功能,经化疗后患者体内硼替佐米累积量越高,其体内TIM-3水平越低。hPEBP4为磷脂酰乙醇胺下游物质,可连接糖脂代谢和细胞凋亡、信号转导[16]。钙蛋白最早发现于牛大脑中,是在进化上较为保守的蛋白分子,对膜成分磷脂酰乙醇胺具有较强的亲和力。hPEBP4为新型肿瘤抗凋亡分子,在乳腺癌、肺癌等多肿瘤中高表达,可参与癌症发生发展[17]。本研究中多发性骨髓瘤患者hPEBP4水平高于对照组,证实该蛋白可在多发性骨髓瘤发展中发挥作用;化疗后患者体内硼替佐米累积量越高者hPEBP4水平越低。将硼替佐米累积量进行相关性分析,结果显示TIM-3、hPEBP4水平表达与其呈负相关,表明通过监测体内硼替佐米累积量和TIM-3、hPEBP4水平对临床疗效评估具有促进作用,可为下一步治疗提供依据[18]。由于本研究的样本量相对较少,结果可能有偏差,后续需进一步扩大样本再次研究。
综上所述,在多发性骨髓瘤患者BMCs中TIM-3、hPEBP4水平相对于健康人群较高,经硼替佐米化疗后,药物在其体内逐渐积累,且TIM-3、hPEBP4水平与硼替佐米积累量呈负相关,临床可通过监测体内TIM-3、hPEBP4水平以评估治疗效果。

