高毒力肺炎克雷伯菌的微生物学特征与毒力因子研究进展*
董秀涛,崔晓笛,石晓红 综述,郝明巨△ 审校
1.山东第一医科大学第一附属医院/山东省千佛山医院检验科/山东省医药卫生临床检验诊断学重点实验室,山东济南 250014;2.济宁医学院临床医学院,山东济宁 272067
肺炎克雷伯菌是一种机会性致病的病原体,能够引起多种感染,如引起免疫力低下患者的肺炎,尿路感染和菌血症等[1]。肺炎克雷伯菌有3个亚种,具有同源DNA但生化反应不同,包括肺炎亚种、臭鼻亚种和硬鼻结亚种。在过去的几十年中,高毒力肺炎克雷伯菌(hvKp)已成为一种重要的病原体,能够引起社区获得性感染和医源性感染[2]。在亚洲,hvKp最初被认为是化脓性肝脓肿的病因[3]。肺炎克雷伯菌中hvKp的检出率存在地区差异,在hvKp流行地区,检出率在12%~45%[4]。近年来,随着抗菌药物的广泛使用,这些菌株已呈现出对多种抗菌药物耐药的现象。本文主要讨论hvKp血清型及基因分型,与侵袭性相关的微生物学特征,主要毒力因子及相关的分子基础。
1 hvKp血清型及基因分型
1.1hvKp的血清型 hvKp通常具有典型的荚膜表型。荚膜是由肺炎克雷伯菌合成的一种多糖成分,可作为细菌外部的保护层,抑制宿主补体介导的炎症反应[5]。荚膜多糖的核酸序列为荚膜分型的分子基础,不同的多糖变异体等位基因(wzi)编码不同的荚膜抗原,可根据血清学对其进行分类。当前,wzi基因的测序较血清学分型的方法更为常用,已通过该方法鉴定出至少134种荚膜基因座[6]。hvKp最常见的wzi基因座是荚膜1型,其次是荚膜2、5、57型[7]。通常认为,hvKp的荚膜可防止宿主的吞噬作用从而增加hvKp的毒性。其机制是巨噬细胞凝集素受体识别病原体表面重复的甘露糖或鼠李糖以诱导吞噬作用,但荚膜1、2、5、57型的hvKp菌株缺少这些糖分子,因此有助于其逃避凝集性介导的吞噬作用[8]。另有研究发现,荚膜1型抵抗嗜中性粒细胞的杀灭作用更强,这可进一步加剧其致病风险[9]。
1.2hvKp的序列类型(ST) 大多数hvKp菌株克隆群分布较为局限,CG23是最主要的克隆群,包括许多ST,如ST23、ST26、ST57和ST1633等[10]。其中,ST23菌株是引起肝脓肿的主要分型[11-12]。CG23与荚膜1型和多种毒力因子密切相关,包括大肠杆菌毒素、微菌素E492、铁载体捕获系统(气杆菌素、耶尔森杆菌素和沙门菌素)等[13]。尽管ST23是hvKp分离株中的主要ST,但最近在许多地区也发现了引起感染的其他ST[14]。因此,荚膜1型ST23 hvKp菌株虽然在最开始被发现时占主导地位,但其分离率正在呈下降趋势,在全球范围内有许多不同的荚膜类型也同样属于hvKp菌株。
2 hvKp与侵袭性相关的微生物学特征
2.1hvKp的高黏液表型 hvKp的临床侵袭性常与其黏液性特征有关。hvKp的主要特征是在琼脂平板上呈现出高黏液表型,属于高黏液性肺炎克雷伯菌,表现为拉丝实验阳性,即用接菌环粘取菌落可拉伸至少5 mm;因此,可以通过拉丝实验对hvKp进行初步识别[15]。通常认为,hvKp的高黏液表型与胞外荚膜产量过多有关;具有高黏液表型或荚膜多糖产生过多的菌株,对补体介导的血清杀伤抵抗能力明显增强[15]。hvKp胞外多糖网由染色体上的荚膜多糖基因簇(cps)编码,受毒性质粒携带的某些基因[包括黏液表型调节基因(rmp)A、rmpA2和黏液相关基因A(magA)等][16]正向调节。
2.2hvKp在肠道内定植是引起人群流行和感染的重要因素 hvKp是肠道微生物组的成员,这可能有助于其在社区和医院中的传播。在哺乳动物中,肺炎克雷伯菌为肠道的常见定植菌。另外,在人体黏膜表面、污水污染的水源和医院的表面物体中也常常分离到该菌[17]。患者肠道定植的肺炎克雷伯菌往往是引起人类感染的主要来源[18]。研究发现,在住院患者中,肺炎克雷伯菌的肠道定植率在19%~38%[19]。
引起hvKp在肠道内定植的环境来源尚不清楚,在hvKp高流行地区,hvKp进入肠道定植后,通过粪-口途径传播可能是引起社区传播的一种重要途径。有研究发现,胃肠道定植与肝脓肿之间存在很强的相关性[20]。在韩国,5%的健康成年人中携带hvKp[20],在接受调查的近千名亚洲地区的华人成年人中,这一比例为6%[21]。这些研究结果提示,肺炎克雷伯菌感染很可能源于肠道内定植。此外,使用小鼠肠道定植模型,已经确定了hvKp在肠道内定植相关所需的基因,这表明hvKp可能使用特定的毒力决定因素进入肝脏[22]。总之,hvKp易于在肠道内定殖的特性促进了其在人群之间的传播,并可能在疾病期间从肠道扩散到其他器官引起播散性感染。
3 hvKp的毒力因子
3.1hvKp中的毒性质粒 hvKp的高毒性通常由其所携带的高毒力质粒介导,质粒编码的铁载体系统和黏液表型相关基因是hvKp菌株的关键毒力因子[2]。当前,由NTUH2044携带的pK2044[23]和CG43携带的pLVPK[24]是研究最为深入的hvKp毒力质粒,大小约为220 kb,二者的基因序列高度相似(图1)。毒性质粒中携带多种毒性基因和重金属抗性基因座,包括黏液样调节基因rmpA、rmpA2、rmpD,铁捕获基因(iut、iro),介导对金属碲、铜等抗性的ter和pco耐药基因(图1)。尽管如此,在这些毒力质粒编码的基因中,大约2/3的基因功能仍然未知。
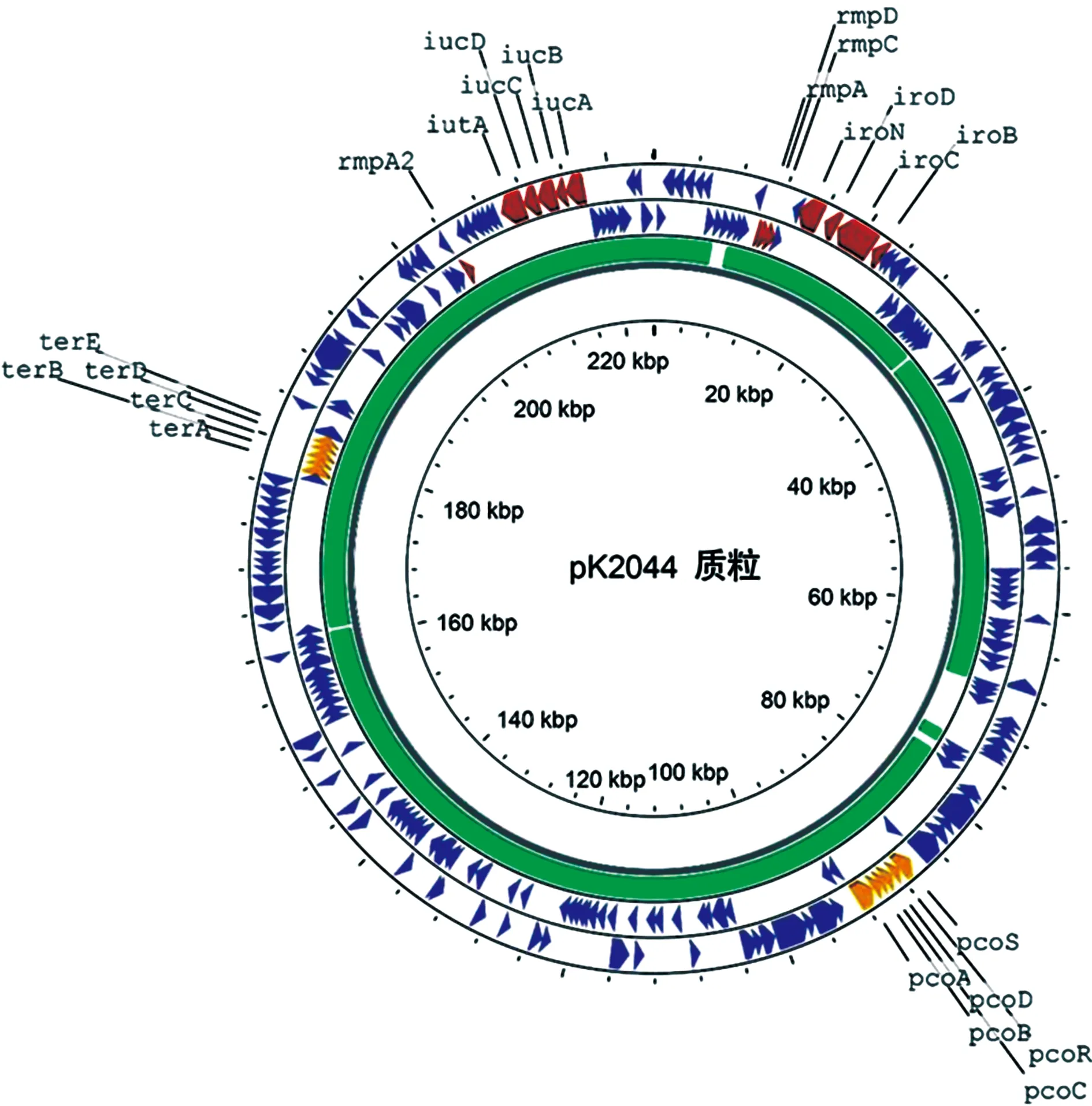
注:质粒中带有的毒性基因(rmp、iuc、iro)、重金属抗性基因(pco、ter)及与pLVPK质粒Blast比对结果见图中标注。图1 pK2044毒性质粒示意图
rmp基因:质粒编码的rmpA和rmpA2可调控位于细菌染色体上的荚膜基因cps表达,以增加荚膜外多糖的合成和产生高黏液表型[2]。rmpA基因见于90%有高黏液表型的分离株,然而,无高黏液表型的分离株中也有22%菌株同样携带rmpA基因,但在这些rmpA阳性分离株中,rmpA基因多存在突变(插入或缺失)而失去活性,这可能是导致其不出现黏液表型和低毒力的原因之一[25]。虽然有研究支持hvKp的高黏液表型与胞外荚膜产量过多有关,但也有研究认为荚膜产量与黏液表型分属不同的生物学特征,并无相关性,比如在毒力质粒中存在一种cps调节基因rmpC,当敲除后导致cps表达明显降低,但是细菌依然呈现出高黏液状态[25]。研究者继而发现了一种新的调节基因rmpD与黏液表型密切相关,但其并不影响cps的表达[26]。因此,对于不同的hvKp菌株,其黏液性表型的机制可能并不相同,这有待于进一步的研究。
铁捕获相关毒力因子:铁是许多细菌和人类的细胞所需的重要元素,铁的捕获是hvKp形成毒力的关键组成部分。铁的可利用性通常受到机体多种蛋白质的限制,在感染过程中,这些蛋白质能够限制细菌对铁的利用,这一过程称为营养免疫[27],如宿主免疫蛋白lipocalin-2可以结合细菌产生的肠杆菌素并阻止其返回细胞,从而阻止细菌对铁的吸收[28]。然而,hvKp能够通过编码高亲和力的铁捕获系统,抵消宿主的营养免疫过程。例如,hvKp编码的ybt、iuc和iro铁捕获系统对lipocalin-2具有抗性,能够克服lipocalin-2营养免疫的限制[29-30],而且iro和iuc基因座的共存趋势很强,对hvKp在体内生存和致病性发挥重要作用[31]。除了毒性质粒中编码的铁载体之外,hvKp染色体上含有编码肠杆菌素和耶尔森菌素铁载体系统,可进一步增强细菌对铁的摄取能力。以上铁载体系统中,气杆菌素iuc对于hvKp获取铁最为重要,也是关键的毒力因子,因此,它已被用作抗hvKp毒素治疗的靶标之一[32]。
3.2整合和共轭元件(ICEs) 除毒力质粒外,hvKp菌株还通过染色体中的ICEs移动遗传元件获得了其他毒力基因。ICEs在hvKp谱系中极为流行,存在于近90%的CG23[33]和接近75%的hvKp菌株中[34]。hvKp中共有14种不同类型的ICEs,ICEKp1在ST23型NTUH-K2044菌株中首先被发现。然而在其他的ST23型hvKp菌株中,ICEKp10是最为多见的一种ICEs类型[13]。含有编码铁载体耶尔森菌素的基因是肺炎克雷伯菌和hvKp菌株中大多数ICEs的共同特征[33]。除耶尔森菌素基因外,一些ICEs还携带其他毒力基因,如ICEKp1含有编码rmpA和铁载体沙门菌素的基因,而ICEKp10含有编码大肠菌素合成的基因[35]。
3.3magA magA基因编码一种相对分子质量为43×103的外膜蛋白,与荚膜1型血清型密切相关。该基因位于荚膜1型血清型cps基因簇的特异性操纵子内[35],从而使细菌具有荚膜1型血清型[36]。magA与荚膜1型血清型的hvKp的毒性也密切相关,一项采用转座子诱变技术识别候选毒力基因的研究显示,magA阳性菌株有黏液性胞外多糖网,具有抗吞噬作用,能够引起小鼠动物模型的肝脓肿和脑膜炎,而magA阴性突变株缺乏胞外多糖网,易被吞噬,没有毒性[37]。对magA基因侧翼区进一步测序发现,magA基因是cps操纵子中聚合酶wzy基因位点的等位基因,因为magA为荚膜1型抗原特异性聚合酶,所以有人提出将magA重命名为wzyKpK1,即荚膜1型血清型肺炎克雷伯菌特异性荚膜聚合酶[38]。其他血清型(荚膜2、5、20、54、57型)及新的荚膜N1型在wzy基因位点有不同的等位基因,它们编码不同血清型的cps基因簇特异性荚膜聚合酶[39]。
3.4大肠菌素 hvKp的另一个重要的分子特征是合成大肠菌素的能力。大肠菌素是通过非核糖体肽合成酶、聚酮化合物合酶和其他酶(pks基因)进行催化,作为次级代谢的一部分而合成[40]。相对于肺炎克雷伯菌分离株,pks基因座在hvKp中过度表达,在大多数荚膜1型分离株中,通常以染色体整合和结合元件编码[41-42]。大肠菌素会破坏DNA并破坏宿主细胞周期,但对其中的确切机制尚不清楚。在一项肠道定植hvKp菌株的小鼠模型的研究中显示,抑制大肠菌素的合成能够降低hvKp菌株在体内的传播和转移能力[43]。因此,大肠菌素是hvKp重要的毒力因子并有助于hvKp在肠道内的定植。
3.5其他hvKp毒力因子 脂多糖:脂多糖由脂质A、核心寡糖和O抗原组成,也即革兰阴性菌的内毒素。肺炎克雷伯菌脂多糖O侧链可阻碍补体C1q或C3b结合细菌胞膜,从而保护细菌免于补体介导的膜损伤和细胞死亡[44]。O1抗原是经典的肺炎克雷伯菌最常见的亚型,其缺失能够明显抑制细菌毒力。而荚膜1型hvKp菌株中的O1抗原通常被荚膜所掩盖,其抑制补体激活的途径通常与厚的荚膜有关。肺炎克雷伯菌属脂多糖还可能通过其他机制提高毒力,包括触发细胞因子的大量分泌而导致脓毒综合征或脓毒性休克而增加肺部感染的致死性[45]。
菌毛:肺炎克雷伯菌能够表达1型和3型菌毛。1型菌毛是所有肠杆菌科细菌产生的杂多聚甘露糖结合纤维,介导对多种类型上皮细胞(如膀胱上皮细胞)的黏附。3型菌毛中的黏附蛋白(MrkD黏附素)能够促进肺炎克雷伯菌附着于宿主细胞(如泌尿生殖道、呼吸道和肠道细胞)、塑料和人胞外基质表面,从而促进在人体腔道内,以及体内留置管(如静脉导管和导尿管)表面的定植[46-47]。表1中总结了hvKp主要毒力因子及致病性机制。

表1 hvKp含有的主要毒力因子
4 hvKp的耐药性趋势
随着抗菌药物的广泛使用,hvKp已从最初的对多数抗菌药物敏感呈现出耐药率增长的趋势,出现了越来越多的耐碳青霉烯类hvKp(CR-hvKp),其引起的感染给临床治疗带来很大困难[46-47]。有研究报道了一种CR-hvKp引起的呼吸机相关性肺炎的致命性暴发[48]。国内一项多中心研究显示,CR-hvKp的检出率呈逐年升高的趋势,在产KPC-2的ST11型肺炎克雷伯菌株中尤为明显[49]。笔者最近的一项关于CR-hvKp的多中心研究分析表明,几乎所有分离株均携带高毒力质粒和blaKPC-2耐药基因[50]。除了blaKPC-2基因,携带blaNDM和blaOXA48型耐药基因的hvKp相继被发现[51-53]。不仅如此,对多黏菌素耐药[54]和替甲环素不敏感的CR-hvKp[55],甚至同时对多黏菌素、替甲环素和碳青霉烯类耐药的“超级hvKp”[56]相继在中国被报道。因此,在细菌耐药现象日益严重的背景下,如何应对hvKp带来的挑战,已成为一项十分紧急的公共卫生问题。
5 小 结
继在亚洲的早期报道之后,hvKp已开始在全球范围内广泛传播,为了在临床中快速鉴定hvKp,需要基于细菌血清型、ST分型、毒力基因检测等多种诊断方法。hvKp中毒性质粒、ICEs及染色体中含有rmpA、rmpA2、铁载体(iro、iuc)等是hvKp的关键毒力因子,对于hvKp的高致病性发挥重要作用,也常用作hvKp毒力鉴定标记。rmpA基因是荚膜外多糖合成的正性调节因子,可以通过促进cps高表达诱导荚膜形成从而形成高毒力,但某些hvKp菌株黏液表型与cps高表达无关。另外,多药耐药性的hvKp菌株尤其是CR-hvKp的出现须引起足够重视,亟须寻求新的策略来应对这种高毒力与高耐药性的CR-hvKp引起的感染,临床上必须快速有效地对hvKp进行鉴定,从而为临床诊疗提供依据。

