川楝素抑制AKT/GSK-3β/β-catenin通路对恶性黑色素瘤细胞增殖、凋亡和上皮间质转化的影响
皮庆友,赵 媛,陈 璐
山东省立第三医院皮肤科,山东济南 250031
恶性黑色素瘤(MM)是一种起源于黑色素细胞且恶性程度极高的肿瘤,已经成为世界上发病率增长最快的恶性肿瘤之一[1]。MM可发生于皮肤、黏膜、内脏等部位,特别是在易摩擦部位具有更高发病率和致命性[2]。目前手术切除恶性组织认为是治疗MM的最佳疗法,但其具有较高的复发率和死亡率,因此探寻MM的发病机制以寻求更好的治疗手段迫在眉睫。上皮间质转化(EMT)可使上皮细胞转化为间充质细胞,导致多种恶性肿瘤包括MM的迁移与侵袭[3]。蛋白激酶B(AKT)可调节EMT过程,糖原合成酶激酶3β(GSK-3β)是AKT的下游靶基因,受磷酸化AKT(p-AKT)调节,进而影响信号通路分子β-链环蛋白(β-catenin)参与一系列细胞进程,介导EMT的发生[4]。已有研究证明,通过抑制AKT/GSK-3β/β-catenin通路的活化可抑制胃癌细胞EMT过程[5]。川楝素(TSN)是三萜类化合物,具有镇痛、抗炎、抗肿瘤等作用,其中TSN能通过抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、抑制肿瘤细胞EMT等多方面发挥抗肿瘤效果[6]。已有研究表明,TSN通过抑制AKT/GSK-3β/β-catenin通路来抑制结直肠癌细胞的生长并诱导其凋亡[7]。然而,关于TSN对MM细胞的作用及其机制的报道较少,因此本研究对此进行分析。
1 材料与方法
1.1实验材料 人恶性黑色素瘤细胞A375购自美国ACCT细胞库。
1.2仪器与试剂 TSN(纯度≥99%)购自中国食品药品检定研究院;胰蛋白酶、胎牛血清(FBS)、DMEM培养基购自美国Gibco公司;AKT激活剂(SC79)、GSK-3β抑制剂(CP21R7)购自美国Selleck Chemicals公司;CCK-8检测试剂盒、Annexin V-FITC/PI检测试剂盒购自上海碧云天公司;Transwell小室购自美国Coster公司;TRIzol试剂盒购自沈阳万类生物公司;一抗B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、酶切含半胱氨酸的天冬氨酸蛋白水解酶-3(C-caspase-3)、波形蛋白(Vimentin)、上皮钙黏蛋白(E-cadherin)、神经钙黏蛋白(N-cadherin)、AKT、p-AKT Ser473、GSK-3β、磷酸化GSK-3β(p-GSK-3β) Ser9、β-catenin和β-微管蛋白(β-actin)抗体购自美国赛默飞公司;二抗山羊抗兔IgG-辣根过氧化物酶(HRP)购自美国Santa公司。流式细胞仪购自北京安诺伦公司;光学倒置显微镜购自德国Zeiss公司;蛋白电泳仪购自美国Bio-rad公司;全自动酶标仪购自上海天能公司。
1.3方法
1.3.1细胞复苏培养 将A375细胞在添加10% PBS的DMEM培养基中培养,并置于37 ℃、5% CO2培养箱中,当细胞复苏至80%时,胰蛋白酶消化传代,每2~3天传代一次。
1.3.2细胞毒性试验 将A357细胞接种于96孔板中,每孔5×103个细胞,培养24 h后,用不同浓度(0、1、5、10、20、40、60 μmol/L)的TSN处理细胞,继续培养24 h后,加入10% CCK-8溶液(10 μL)在37 ℃孵育2 h,酶标仪于450 nm处测量吸光度,计算细胞活力和半数抑制浓度(IC50)。
1.3.3细胞分组与处理 将细胞分为5组,对照(NC)组(正常培养)、TSN低剂量组(10 μmol/L)、TSN中剂量组(20 μmol/L)、TSN高剂量组(40 μmol/L)[8]、SC79组(TSN 40 μmol/L+SC79 10 nmol/L)、SC79+CP21R7组(TSN 40 μmol/L+SC79 10 nmol/L+CP21R7 10 nmol/L)。
1.3.4流式细胞术检测细胞凋亡 将处理过的各组细胞分别接种于6孔板中,每孔5×105个细胞,培养24 h,PBS冲洗两遍后,按照Annexin V-FITC/PI细胞凋亡双染试剂盒说明书逐步进行染色,用流式细胞仪检测细胞凋亡,确定细胞凋亡率。
1.3.5划痕实验检测细胞迁移 将处理过的各组细胞分别接种于6孔板中,每孔5×105个细胞,培养24 h,用200 μL移液器枪头进行“一”线性划痕,在显微镜下观察0 h和24 h的划痕宽度,记为W0和W24,迁移率=(W0-W24)/W0×100%。
1.3.6Transwell实验检测细胞侵袭 将基质胶包被在Transwell小室底膜上室,接种处理后的各组细胞(5×104个/毫升),下室加入含有10 % FBS的DMEM培养基,在37 ℃、5% CO2中培养24 h。取出Transwell小室,弃去上室培养基,擦去上室细胞后,PBS洗涤、多聚甲醛固定、结晶紫染色,在光学倒置显微镜下计数。
1.3.7蛋白质印迹法(Western blot)检测 将各组细胞破碎后提取总蛋白,用BCA试剂盒进行定量,按步骤将蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、转膜,于5%脱脂奶粉中封闭2 h,在4 ℃下加入一抗Bcl-2、Bax、C-caspase-3、Vimentin、E-cadherin、N-cadherin、AKT、p-AKT、GSK-3β、p-GSK-3β、β-catenin(1∶2 000)和β-actin 4 ℃孵育过夜,清洗,在室温下加入二抗山羊抗兔IgG(1∶1 000),孵育2 h。用ECL发光显影,观察并拍照。各条带灰度值用Image J软件处理分析。
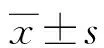
2 结 果
2.1TSN对A357细胞的毒性作用 CCK-8结果显示,与无TSN(0 μmol/L)时比较,A357细胞活力随着TSN浓度的升高而逐渐降低(P<0.05),见表1。TSN对A357细胞的IC50为43.67 μmol/L。因此,选择10、20和40 μmol/L作为后续TSN的实验浓度。
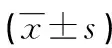
表1 不同浓度TSN对A357细胞的毒性作用
2.2各组细胞凋亡情况 与NC组比较,TSN低剂量组、TSN中剂量组、TSN高剂量组细胞凋亡率升高(P<0.05);与TSN高剂量组比较,SC79组细胞凋亡率降低(P<0.05);SC79+CP21R7组与TSN高剂量组细胞凋亡率差异无统计学意义(P>0.05);与SC79组比较,SC79+CP21R7组细胞凋亡率升高(P<0.05)。见表2。

表2 各组细胞凋亡率比较
2.3各组细胞凋亡和EMT相关蛋白水平比较 与NC组比较,TSN低剂量组、TSN中剂量组、TSN高剂量组Bcl-2、N-cadherin、Vimentin水平降低,Bax、C-caspase-3、E-cadherin水平升高(P<0.05);与TSN高剂量组比较,SC79组Bcl-2、N-cadherin、Vimentin水平升高,Bax、C-caspase-3、E-cadherin水平降低(P<0.05);SC79+CP21R7组与TSN高剂量组各蛋白水平差异无统计学意义(P>0.05);与SC79组比较,SC79+CP21R7组Bcl-2、N-cadherin、Vimentin蛋白水平降低(P<0.05),Bax、C-caspase-3、E-cadherin水平升高(P<0.05)。见图1、表3。

注:A为NC组;B为TSN低剂量组;C为TSN中剂量组;D为TSN高剂量组;E为SC79组;F为SC79+CP21R7组。图1 各组细胞凋亡和EMT相关蛋白水平变化
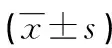
表3 各组细胞凋亡和EMT相关蛋白水平比较
2.4各组细胞迁移能力比较 与NC组比较,TSN低剂量组、TSN中剂量组、TSN高剂量组细胞划痕愈合率降低(P<0.05);与TSN高剂量组比较,SC79组细胞划痕愈合率升高(P<0.05);SC79+CP21R7组与TSN高剂量组划痕愈合率差异无统计学意义(P>0.05);与SC79组比较,SC79+CP21R7组细胞划痕愈合率降低(P<0.05)。见图2、表4。

注:A1、A2为NC组;B1、B2为TSN低剂量组;C1、C2为TSN中剂量组;D1、D2为TSN高剂量组;E1、E2为SC79组;F1、F2为SC79+CP21R7组。图2 划痕实验检测各组细胞迁移能力

表4 各组细胞划痕愈合率比较
2.5各组细胞侵袭能力比较 与NC组比较,TSN低剂量组、TSN中剂量组、TSN高剂量组细胞侵袭数目减少(P<0.05);与TSN高剂量组比较,SC79组细胞侵袭数目增加(P<0.05);SC79+CP21R7组与TSN高剂量组细胞侵袭数目差异无统计学意义(P>0.05);与SC79组比较,SC79+CP21R7组细胞侵袭数目减少(P<0.05)。见图3、表5。

注:A为NC组;B为TSN低剂量组;C为TSN中剂量组;D为TSN高剂量组;E为SC79组;F为SC79+CP21R7组。图3 各组细胞侵袭能力比较(结晶紫染色,×200)

表5 各组细胞侵袭能力比较个)
2.6各组细胞通路蛋白水平比较 与NC组比较,TSN低剂量组、TSN中剂量组、TSN高剂量组p-AKT Ser473、p-GSK-3β Ser9、β-catenin蛋白水平降低(P<0.05);与TSN高剂量组比较,SC79组p-AKT Ser473、p-GSK-3β Ser9、β-catenin蛋白水平升高(P<0.05);SC79+CP21R7组与TSN高剂量组各蛋白水平差异无统计学意义(P>0.05);与SC79组比较,SC79+CP21R7组pAKT Ser473、p-GSK-3β Ser9、β-catenin蛋白水平降低(P<0.05)。见图4、表6。
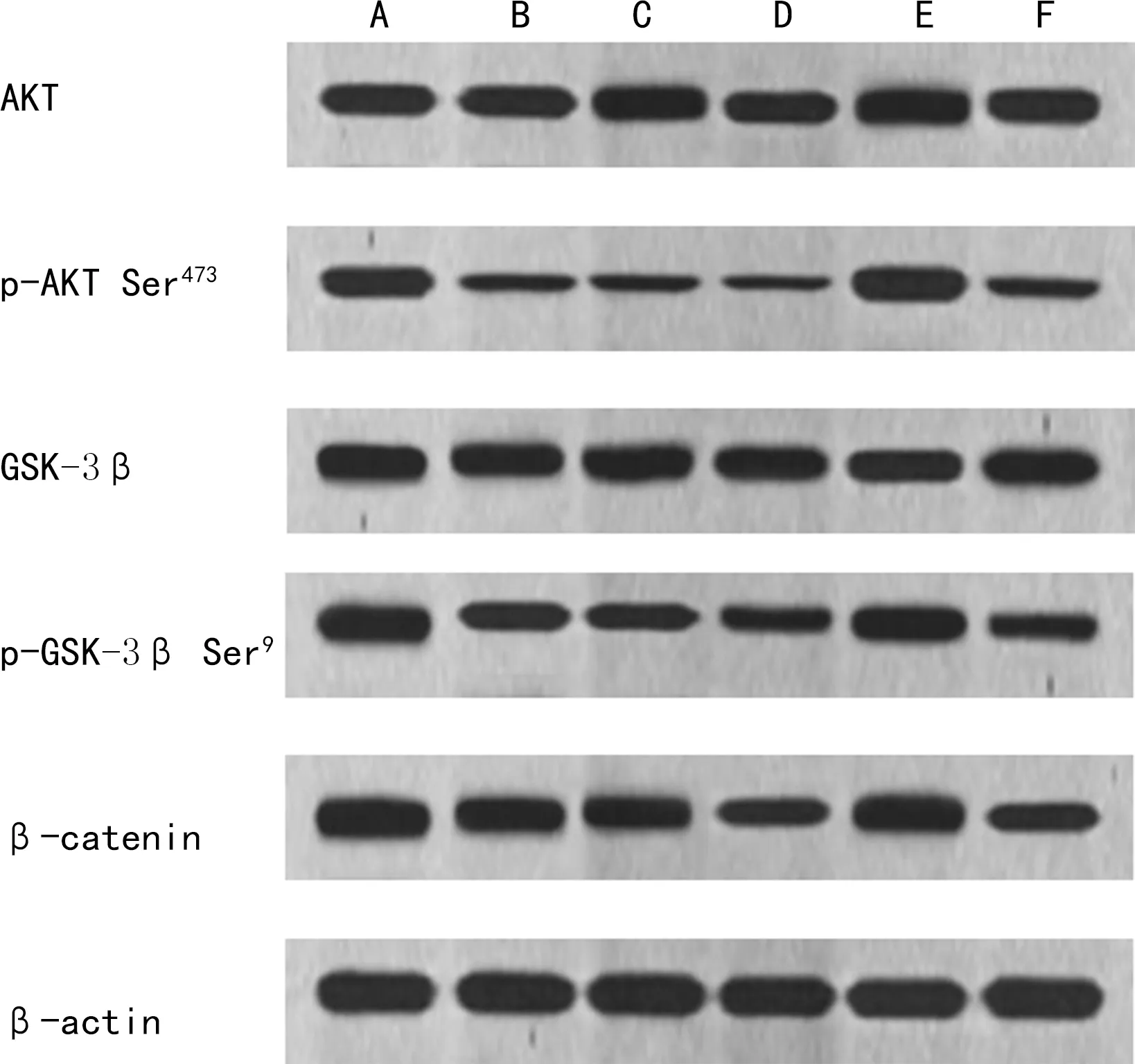
注:A为NC组;B为TSN低剂量组;C为TSN中剂量组;D为TSN高剂量组;E为SC79组;F为SC79+CP21R7组。图4 各组细胞通路蛋白水平比较
表6 各组细胞通路蛋白水平比较
3 讨 论
MM是皮肤癌致死的主要原因,目前MM的标准治疗方法主要包括化疗、放疗、免疫治疗和生物治疗,但因其侵袭性强、预后差、对化疗或放疗耐药等特征,治疗效果并不理想,因此应积极探索新的药物和治疗方法[9]。Bcl-2与Bax是两个凋亡相关的调节蛋白,Bcl-2作为抗凋亡蛋白与促凋亡蛋白Bax共同作用,决定细胞是否凋亡;caspase-3是caspase家族直接诱导细胞凋亡的蛋白之一,间接影响其他凋亡因子诱导细胞凋亡[10]。TSN在诱导细胞周期停滞和凋亡、抑制多种癌症方面具有良好的作用。时俊宇等[11]发现,TSN能体外抑制人卵巢癌SKOV3细胞增殖、迁移和侵袭的作用。此外,SHAO等[12]发现,TSN诱导MKN-45人胃癌细胞凋亡是通过介导Bcl-2的激活来实现的。同时,WANG等[13]发现,TSN还可以抑制胶质瘤细胞的增殖、迁移,促进细胞凋亡。因此,TSN是一种疗效显著的抗肿瘤药物,然而其在MM治疗中的作用机制尚未阐明。本研究中,TSN可抑制MM细胞活力,促进凋亡,使Bcl-2蛋白表达水平降低,Bax、C-caspase-3水平升高,与上述研究报道一致。
EMT在肿瘤侵袭和转移过程中起着至关重要的作用,特别是在早期阶段。在EMT过程中,细胞失去上皮特性获得间充质特性,其分子机制与上皮标志物E-cadherin的下调和间充质标志物N-cadherin、Vimentin的上调有关,细胞间黏附能力降低导致肿瘤细胞迁移和侵袭性增强[14]。EMT是一种可逆的生物学过程,可以调节人类MM细胞的迁移和侵袭。MM细胞在未发生侵袭和迁移时,E-cadherin高表达,细胞间黏附性较强,可阻止MM细胞逃逸;当发生侵袭和迁移时,N-cadherin、Vimentin高表达,E-cadherin则低表达,MM细胞向周围转移扩散[15]。向桂琼等[16]发现,全反式维甲酸能抑制MM细胞的侵袭、转移,其机制与抑制EMT现象有关。LI等[17]发现,灯盏花乙素可通过抑制EMT来抑制MM细胞的迁移、侵袭。因此,EMT有可能成为治疗MM的途径。TSN作为抗肿瘤药物能抑制细胞EMT过程,如TSN通过抑制EMT来抑制人卵巢癌细胞的迁移和侵袭[18]。在本研究中,TSN治疗后划痕愈合率、细胞侵袭能力、N-cadherin、Vimentin蛋白水平降低,E-cadherin水平升高,表明TSN有可能抑制间充质标志物N-cadherin、Vimentin蛋白表达,提高E-cadherin蛋白水平,来减少EMT发生。
Wnt/β-catenin通路能影响癌细胞增殖和转移,且在不同肿瘤中诱导EMT,是EMT的关键途径[19]。GSK-3β是Wnt/β-catenin通路的关键因子,可直接调节β-catenin蛋白在细胞质中的稳定性[20]。AKT是一种丝氨酸/苏氨酸激酶,参与细胞存活、分化和运动,其中AKT通过磷酸化Ser9位点使GSK-3β的非活性形式激活,影响β-catenin的稳定,导致β-catenin的积累和易位,从而促进恶性癌细胞EMT过程的发展[21]。已有研究发现,TSN通过AKT/GSK-3β/β-catenin通路影响细胞的增殖和凋亡[7]。在本研究中,TSN能同时降低p-AKT Ser473、p-GSK-3β Ser9、β-catenin蛋白的表达,而AKT激动剂SC79升高p-AKT Ser473、p-GSK-3β Ser9、β-catenin蛋白的表达,减弱TSN对MM细胞增殖的抑制,降低凋亡率,增强侵袭和迁移能力,促进EMT进程。GSK-3β抑制剂CP21R7与TSN、SC79共同作用,能拮抗SC79对TSN治疗的抑制作用,促进MM细胞凋亡,抑制细胞增殖、迁移、侵袭和EMT的发生。
综上所述,TSN能抑制MM细胞增殖,促进凋亡,抑制EMT发生,其作用机制可能与抑制AKT/GSK-3β/β-catenin通路激活有关。本研究为治疗MM提供了新的方法和思路,但缺少体内和临床试验,后续需继续探索。

