细辛化学成分和药理作用研究进展及其质量标志物(Q-Marker)预测分析
华新振,刘丛颖,贺梦媛,于小钧,高 鹏,丛竹凤, 3*
·综 述·
细辛化学成分和药理作用研究进展及其质量标志物(Q-Marker)预测分析
华新振1,刘丛颖1,贺梦媛1,于小钧1,高 鹏2*,丛竹凤1, 3*
1. 山东中医药大学药学院,山东 济南 250355 2. 山东中医药大学药物研究院,山东 济南 250355 3. 山东第一医科大学附属肿瘤医院,山东 济南 250117
细辛et首载于《神农本草经》,具有解表散寒、祛风止痛、通窍、温肺化饮的功效,主要化学成分包括木脂素类、挥发油类、酸类、苷类、含氮化合物等。现代药理学研究表明,细辛具有抗炎镇痛、止咳平喘、抗菌、抗病毒等多种药理作用。通过对近10年细辛的化学成分、药理作用、临床应用和安全性进行综述,从植物亲缘、药效、药性、配伍、化学成分可测性等方面预测分析细辛质量标志物(quality marker,Q-Marker),初步预测细辛脂素、芝麻脂素、甲基丁香酚、β-细辛醚、阿魏酸、十二碳四烯酰胺A和十二碳四烯酰胺B等可作为其Q-Marker,为建立和完善细辛质量评价体系提供参考。
细辛;质量标志物;细辛脂素;芝麻脂素;甲基丁香酚;β-细辛醚;阿魏酸;十二碳四烯酰胺A;十二碳四烯酰胺B
细辛来源于马兜铃科植物北细辛Fr. Schmidt var.(Maxim.) Kitag.、汉城细辛Miq. var.Nakai或华细辛Miq.的干燥根和根茎,首载于《神农本草经》,列为上品。细辛性温,味辛,归心、肺、肾经,有解表散寒、祛风止痛、通窍、温肺化饮之功效,临床上常用于风寒感冒、头痛、鼻塞流涕、鼻鼽、鼻渊、风湿痹痛、痰饮喘咳[1]。宋代《证类本草》记载细辛“生华阴山谷”。臣禹锡等谨按范子云:“细辛出华阴,色白者善”。《图经》曰:“细辛,生华山山谷,今处处有之,然他处所出者,不及华州者真”[2]。可见古时细辛产地以华阴(今陕西华阴)为主,全国各地亦有产出。当前细辛的主要产地包括东北、陕西等地,其中东北地区主产北细辛、辽宁主产汉城细辛、陕西主产华细辛[3]。
细辛的质量与生长年限、炮制工艺和药材产地等息息相关[4-6],但现行的质量标准评价方法仅以细辛脂素和挥发油总含量为指标,对细辛质量整体评价较为单一,而且挥发油总含量范围过于宽泛。因此,建立精准全面的质量标准体系尤为重要。刘昌孝院士[7-8]提出的中药质量标志物(quality marker,Q-Marker)为中药质量研究提供了理论依据,实现了高效和可量化的质量评价。本文通过整理近10年文献资料,对细辛化学成分、药理作用、临床应用和安全性进行综述,并对细辛Q-Marker进行预测分析,以期建立更加科学、完善且具有专属性的质量评价体系。
1 化学成分
细辛含有丰富的化学成分,包括木脂素类、挥发油类、酸类、苷类、含氮化合物和其他类成分。其中,木脂素类和挥发油类成分被认为是其主要活性成分。
1.1 木脂素类
细辛中富含木脂素类化合物,芝麻脂素(1)[9-12]和细辛脂素(2)[10-11]是其中主要的2种成分,细辛脂素为历版药典收录的细辛含量测定指标成分。木脂素类成分主要存在于北细辛中,其成分见表1,化学结构见图1。
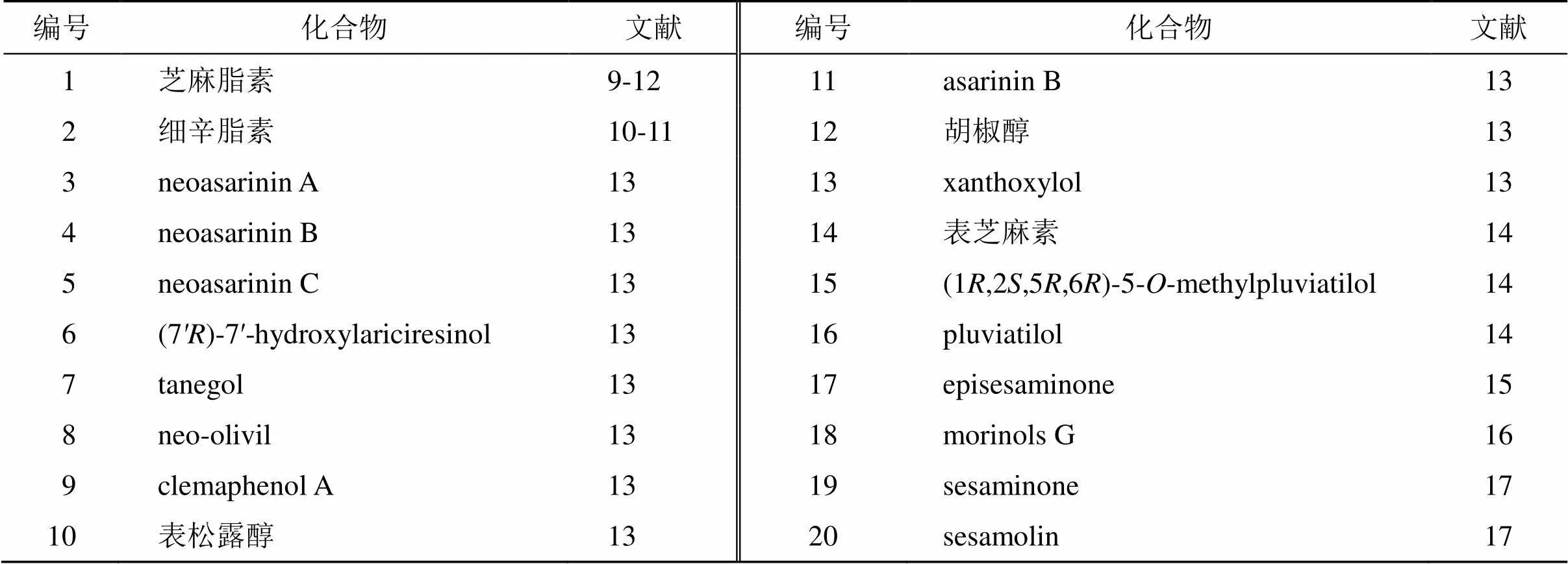
表1 细辛中木脂素类成分
1.2 挥发油类
挥发油是细辛的重要成分,具有多种药理活性。现代研究已分离鉴定出多种单体成分,分为单萜(21~51)、倍半萜(52~71)、芳香族(72~103)和脂肪族(104~133)4类。具体成分见表2,化学结构见图2。
1.3 酸类
细辛中含有酸类成分[14,21,26],其中阿魏酸(141)具有良好的抗氧化作用,亚油酸(137)有抗炎作用。酸类化学成分(134~141)见表3、化学结构见图3。
1.4 苷类
细辛中含多种苷类成分[13,23,25,27-29],特别是黄酮苷类成分具有抗炎镇痛、抗菌、抗病毒及增强免疫等药理活性,其化学成分(142~155)见表4,化学结构见图4。
1.5 含氮化合物
细辛中含有部分含氮化合物[13-14,22-23,27],具有抗炎、平喘和抗氧化等作用。根据结构分为酰胺类生物碱(156~163)、菲类生物碱(164~177)、硝基菲羧酸(178~183),其化学成分见表5,化学结构见图5。

图1 细辛中木脂素类成分化学结构
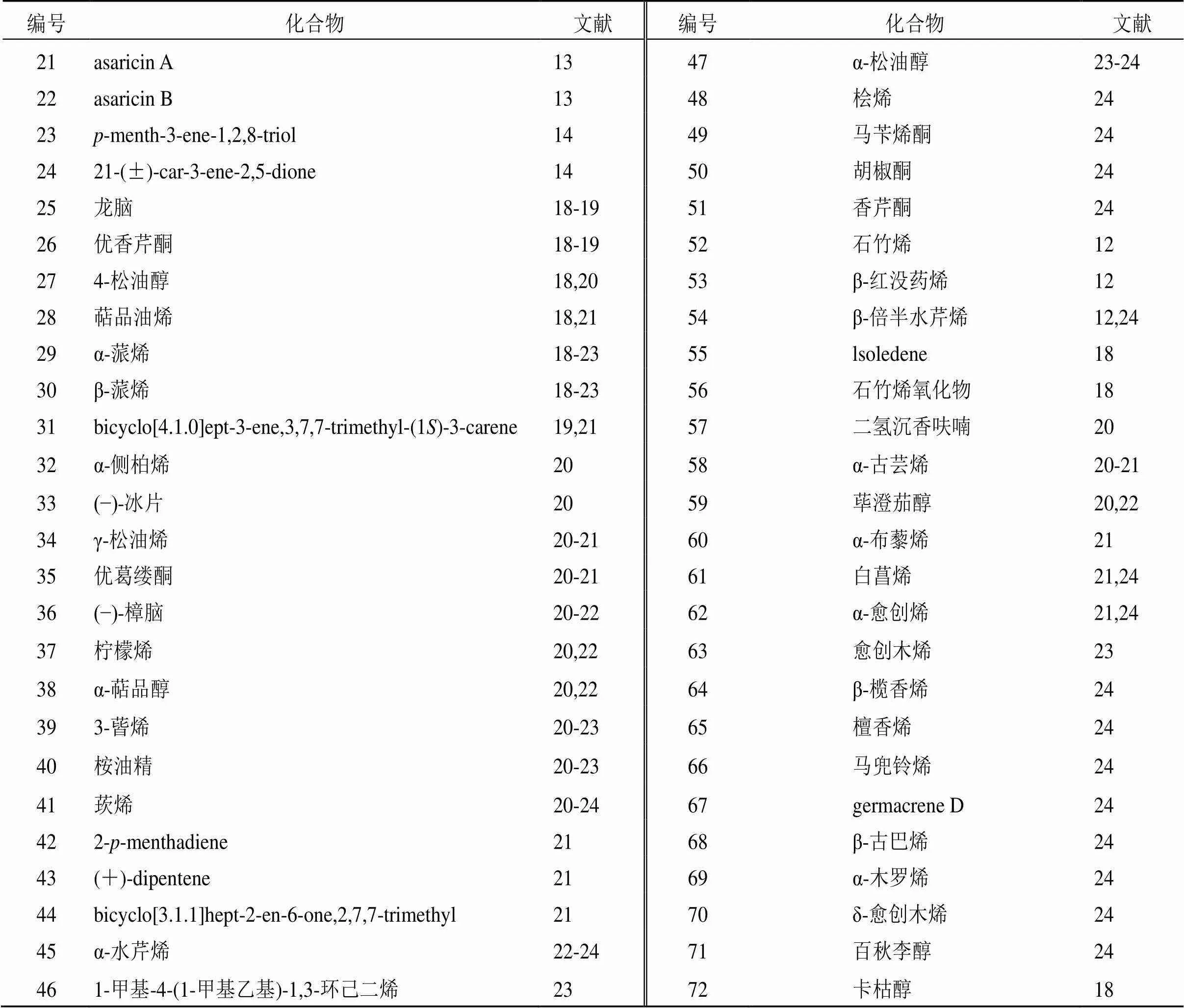
表2 细辛中挥发油类成分

续表2
1.6 其他类
除上述成分外,细辛还含有甾体类化合物如β-谷甾醇[25,30],香豆素类化合物如3-甲基-6-羟基-8-甲氧基-3,4-二氢异香豆素[25]、2-氢-1-苯并吡喃-2-酮[12]、咖啡酸甲酯[30]、多糖[31]及少量黄酮类成分[32]。近年来,有研究报道细辛中还含有马兜铃酸等具有毒性的化合物[27,33]。
2 药理作用
细辛具有抗炎镇痛、止咳平喘、抗菌、抗病毒、调节心血管和神经系统等作用,还有抗氧化、抗衰老、镇静、免疫调节和抗癌等药理作用。活性成分主要为挥发油类、木脂素类及酰胺类生物碱等成分。
2.1 抗炎镇痛
细辛提取物可降低二甲苯致小鼠耳廓和蛋清所致大鼠足跖肿胀的肿胀度[34-35],表现出显著的抗炎活性。刘杰等[36]应用网络药理学方法发现细辛的抗炎作用机制为多靶点协同作用,细辛脂素、芝麻脂素、甲基丁香酚(78)等成分通过抑制环氧合酶-1(cyclooxygenase-1,COX-1)、COX-2、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、丝裂原活化蛋白激酶14(mitogen-activated protein kinase 14,MAPK14)和白三烯A4水解酶(leukotriene A4 hydrolase,LTA4H)等靶点表达发挥抗炎活性。芝麻脂素、十二碳四烯酰胺(160、161)和派立托胺(158)可通过抑制p38 MAPK和核因子-κB(nuclear factor-κB,NF-κB)的激活抑制BV-2小胶质细胞中白细胞介素-6(interleukin-6,IL-6)和一氧化氮的产生[30,37-38],从而预防或治疗炎症。甲基丁香酚可促进大鼠鼻黏膜水通道蛋白5表达,缓解变应性鼻炎大鼠的炎症反应[39]。此外,黄酮类成分(2)-柚皮素-7--β--吡喃葡萄糖苷和(2)-柚皮素-5,7-二--β--吡喃葡萄糖苷可通过抑制多形核白细胞中β-葡萄糖醛酸酶的释放发挥抗炎作用[13]。

图2 细辛中挥发油成分化学结构

表3 细辛中酸类成分

图3 细辛中酸类成分化学结构

表4 细辛中苷类成分
机体的炎症反应往往伴随疼痛,除抗炎外,细辛提取物还有显著的镇痛活性。Wang等[40]通过醋酸扭体法、热板法、福尔马林法测试发现细辛提取物具有明显的镇痛作用。刘甜甜等[41]发现细辛镇痛作用的可能机制:触发瞬时感受器电位香草素受体会产生痛感,细辛醇提物可触发瞬时受体电位香草酸亚型1(transient receptor potential vanilloid member 1,TRPV1)热敏通道功能障碍产生痛觉过敏发挥镇痛作用;热敏通道具有交叉脱敏性质[42],细辛醇提物能逆转瞬时感受器电位锚蛋白1(transient receptor potential ankyrin 1,TRPA1)活化引起的疼痛表现出镇痛活性。杨华等[43]研究发现甲基丁香酚通过激活γ-氨基丁酸A型受体,抑制一氧化氮-环磷鸟苷信号通路减少一氧化氮的释放发挥镇痛作用。Dal等[44]研究表明丁香酚(90)通过作用于阿片样物质系统,调节谷氨酸能受体,抑制肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)表现出镇痛活性。
2.2 止咳平喘
细辛中多种成分通过作用于多种受体信号通路发挥抗炎和抑制气道重塑等方式发挥止咳平喘的功效[45]。赵晔等[46]研究发现细辛可有效调节冷哮型大鼠的通气障碍和二氧化碳潴留,且对该种大鼠的肺组织损伤有保护与修复作用,在细辛复方中该作用更为明显。张会宗等[47]通过豚鼠引喘潜伏期实验证明细辛水提液具有良好的平喘效果。现代药理学研究发现,细辛中发挥止咳平喘作用的主要是挥发油,其中甲基丁香酚效果显著[48-50]。挥发油中的β-细辛醚(102)也具有良好的作用,通过拮抗H1受体和M受体直接作用于支气管平滑肌,整体治疗支气管哮喘疾病,并通过抑制延髓呼吸神经元网络中的神经传递起到平喘功效[51]。

图4 细辛中苷类成分化学结构

表5 细辛中含氮化合物

图5 细辛中含氮化合物结构
2.3 抗菌、抗病毒
研究发现,细辛挥发油是细辛抗菌的主要成分,可抑制多种细菌和真菌的活性,特别是挥发油中甲基丁香酚具有广泛的抗菌谱,对、、等病原菌均表现出较好的抑制作用[52-54]。除挥发油外,细辛中的芝麻脂素、细辛脂素、卡枯醇(72)和派立托胺也展现出良好的的抗菌活性,对白色念珠菌、大肠埃希氏菌、肺炎克雷伯杆菌和金黄色葡萄球菌等均具有一定的抗菌活性,使细菌产生不同程度的物理损伤和形态学改变[55-56]。
细辛多糖可升高病毒性流感小鼠肺组织中γ-干扰素(可激活多种免疫细胞的一种抗病毒因子)的含量[57],增强TNF-α的表达,增强免疫功能体现抗病毒活性。杨佳等[58]应用实时无标记细胞分析技术测定感染病毒细胞上清液中病毒含量,发现不同浓度细辛多糖均可显著降低上清液中病毒含量,证明其有较强的抑制病毒引起细胞病变的作用。此外,细辛中的细辛脂素可直接作用于人体细胞,提高机体免疫力,阻挡病毒侵袭[59]。
2.4 治疗心血管类疾病作用
在治疗心血管类疾病方面,芝麻脂素具有显著的功效。芝麻脂素能通过激活多种血管生成酶来刺激血管生成,且不诱发血管炎症,可用于治疗缺血性疾病[60]。Ku等[61]发现芝麻脂素可通过抑制p38 MAPK,细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)和c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)抑制TNF-α转化酶的表达,从而减少丙二醇甲醚乙酸酯、TNF-α、IL-1β和盲肠结扎穿孔介导的内皮细胞蛋白C受体脱落治疗严重血管炎症性疾病(如败血症和败血性休克)。Pham等[62]发现芝麻脂素可增强胞内磷脂酰肌醇激酶、钙调素依赖性蛋白激酶II等多种信号传导,增加内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)活性,提高细胞内钙和一氧化氮水平起到治疗心血管疾病作用。石含秀等[63]研究发现细辛中的多种成分可增强心肌细胞钠通道电流产生增强激活心肌细胞作用。Ku等[64]的实验结果表明派立托胺通过抑制静脉内皮细胞中活化X因子(factor Xa,FXa)和凝血酶的产生,凝血酶催化的纤维蛋白聚合和血小板聚集显示出抗凝活性。细辛多糖可抑制主动脉平滑肌细胞凋亡[31],保护心血管。
2.5 神经系统作用
细辛中挥发油成分可作用于神经系统发挥药理活性。Park等[65]研究发现细辛挥发油1.0 g/kg可显著降低小鼠室旁核中促肾上腺皮质激素释放因子蓝斑中酪氨酸羟化酶阳性神经元的表达而起到抗抑郁的作用。β-细辛醚与左旋多巴联合用药可调节多巴胺相关酶[二羟基苯丙氨酸脱羧酶(dopa decarboxylase,DDC)、儿茶酚--甲基转移酶(catechol--methyl transferase,COMT)] 的表达,促进左旋多巴转化,提高多巴胺水平,起到抗帕金森的作用[66]。朱彩霞等[67]发现β-细辛醚还可增加中脑和纹状体中5-羟色胺(5-hydroxytryptamine,5-HT)、5-羟基吲哚乙酸(5-hydroxyindole acetic acid,5-HIAA)、多巴胺的含量起到抗抑郁作用。张洁等[68]发现甲基丁香酚可通过调控NAD-依赖性去乙酰化酶sirtuin-1-单胺氧化酶A信号通路影响5-HT的代谢,影响COMT、乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)和醛糖还原酶(aldose reductase,AR)的活性,发挥抗焦虑的作用。
2.6 其他作用
细辛多糖、细辛脂素、芝麻脂素、甲基丁香酚等细辛提取物均有较强的抗氧化能力,可延缓细胞衰老,抑制细胞凋亡[69-71]。细辛挥发油可作用于α1肾上腺素能受体等靶点发挥抗过敏作用[72-74],研究发现细辛挥发油还具有镇静作用[75-77]。细辛脂素和细辛多糖可通过影响免疫细胞的增殖发挥免疫调节作用[78-80]。近年来大量研究表明多种细辛成分具有抗癌活性,细辛乙醇提取物二氯甲烷组分可抑制人口腔表皮样KB细胞的增殖[81]。细辛脂素可通过激活半胱氨酸天冬氨酸蛋白酶-3、8和9诱导人卵巢癌细胞的凋亡[82]。Xanthoxylol(13)对人乳腺癌细胞表现出细胞毒性[83]。马兜铃内酰胺III(166)对肺癌人类肺泡基底上皮细胞、人恶性黑色素瘤细胞、人卵巢腺癌细胞有明显的细胞毒性[27]。α-蒎烯(29)可通过激活多种酶通路,促进颗粒酶B蛋白扩散到癌细胞内诱导其凋亡[84]。
细辛药理作用及作用机制见图6。
3 临床应用
细辛在临床上多以复方形式入药,与其他中药配伍治疗多种病证[85],包括呼吸系统疾病、头痛、心脏疾病、血管炎症、肿瘤疾病等,在治疗呼吸系统疾病方面应用最为广泛。研究发现经方中细辛治疗咳逆,多配伍干姜、五味子、附子等散寒化饮、敛肺止咳[86]。加味运用麻黄附子细辛汤治疗44例小儿支气管肺炎,临床疗效总有效率为95.45%[87]。该方加减还可用于治疗新型冠状病毒性肺炎引起的发热[88]。加味苓甘五味姜辛汤治疗47例支气管哮喘慢性持续期痰哮证患者的中医证候总有效率和哮喘控制率分别为95.74%和93.62%,高于常规西医治疗[89]。在西医治疗基础上联合加味小青龙汤治疗57例慢性支气管炎,可有效抑制气道重塑及炎症反应有效率为96.49%[90-91]。詹成思[92]对40例慢性心律失常患者应用麻黄附子细辛汤加减治疗,治疗总有效率为97.50%。研究表明,当归四逆汤对多种类型的心脏病及心力衰竭均有疗效[93],加味当归四逆汤治疗肺心病疗效良好,可显著改善心力衰竭患者的心功能与供血指标[94]。赤丸在临床上用于治疗冠心病、血管闭塞性脉管炎等疾病[95]。乌梅丸联合针刺还能升高失眠患者血清中的5-HT、脑源性神经营养因子水平,改善睡眠、缓解焦虑[96]。除细辛复方外,研究发现细辛脂素、阿魏酸能下调IL-1受体关联激酶1、p38及基因的表达来防治结直肠肿瘤,并且可以缓解肠黏膜的破坏[97],β-谷甾醇临床可用于抗炎止咳,左旋芝麻脂素具有抗病毒、抗气管炎作用[98]。此外,细辛中含氮化合物多数为马兜铃酸类物质,临床表现出肾损伤及致癌性。

图6 细辛药理作用及作用机制
4 安全性评价
自明朝就有“细辛不过钱”一说,表明古人对细辛毒性已有初步认识[99],但截至当前,细辛并无全面的安全性评估系统。宗时宇等[100]通过文献总结表明长期服用细辛对肺、肝、肾等重要脏器产生一定程度的毒性反应。细辛的主要毒性成分为黄樟醚(76),不仅具有呼吸麻痹作用,而且是毒性较大的致肝癌物质。马兜铃酸类成分也具有致癌和肾损害作用[101]。细辛肺、肝、肾毒性机制与能量代谢、氨基酸代谢、脂质代谢等途径密切相关,其共有机制为谷氨酸代谢途径,通过提高谷氨酸受体的表达,对肺肝肾组织产生神经兴奋毒性[102]。
4.1 毒性研究
4.1.1 呼吸系统毒性 宋代《本草别说》载:“细辛,若单用末,不可过半钱匕,多则气闷塞不通者死”。现代药理学研究发现,细辛根和全草散剂的半数致死量(median lethal dose,LD50)分别为6.522 9、11.705 2 g/kg。小鼠ig细辛散剂后出现呼吸困难、紫绀、抽搐,严重时出现死亡[103]。细辛挥发油的LD50为1.7 mL/kg[3],小鼠ig细辛挥发油后很快出现呼吸困难,翻正反射消失等症状,甚至死亡。细辛挥发油和去油水煎液等剂量用于小鼠时,细辛挥发油组内有70%死亡,而去油水煎液组内均正常存活[104],证明细辛挥发油毒性强于其他成分,具体致死表现为呼吸系统毒性。研究发现细辛肺毒性的机制可能影响差异表达基因,上调单磷酸腺苷蛋白激酶、IL-1、IL-20、膜型丝氨酸蛋白酶2抗体、NF-κB,下调B淋巴细胞瘤-2基因在肺中的表达导致免疫损伤激活炎症反应,改变体内能量代谢的平衡产生肺毒性[105-106]。
4.1.2 肝毒性 对细辛进行长期毒性实验研究发现,细辛散剂可损害大鼠的肝功能,导致肝脏的卵圆细胞增生及肝脏透明细胞灶,提示肝脏可能是细辛散剂长期毒性的靶器官[107]。将鼠饲料掺入0.5%黄樟醚饲养大鼠2年,28%的大鼠检测出肝癌[108]。此外,细辛中可致肝损害的化学成分还有桉油精(40)、肉豆蔻醚(75),它们产生的活性代谢中间体等与细胞色素1A2酶形成稳定复合物而在体内积聚产生肝毒性[109]。研究发现细辛对肝脏的毒性作用机制与胆汁酸代谢、氨基酸代谢、磷酸肌醇代谢、半乳糖代谢、昼夜节律、p53信号传导途径密切相关[110]。
4.1.3 肾毒性 正常大鼠ig细辛散剂后,与肾功能损伤有关的血肌酐、尿素氮等指标明显升高,且呈剂量相关性[100,107,111]。细辛中含有的少量马兜铃酸类成分,具有明显肾毒性,对人肾小管上皮细胞产生毒性作用,临床上马兜铃酸会导致严重的肾衰竭,主要发病特征为造成肾小管损伤、肾小管上皮细胞凋亡,进而引起肾小管坏死、萎缩和不可逆转的肾间质纤维化[112-115]。研究发现细辛的肾毒性主要表现在促进氨基酸代谢、能量代谢、脂质代谢等多种途径,增加机体氧化损伤、放大炎症效应产生细胞毒性[116]。
4.2 减毒研究
4.2.1 炮制减毒 严建业等[117]对细辛生品及10种炮制品中的黄樟醚、马兜铃酸A的量进行检测,发现细辛炮制后,二者的量均不同程度降低,对细辛的10种炮制方法进行考察,发现所有炮制方法均可降低毒性成分的含量,炒焦炮制,可去除细辛中55%以上的毒性成分,且能较好地保留有效成分甲基丁香酚和细辛脂素。细辛碱制后,马兜铃酸I(178)的去除率达到85%以上,显著降低急性毒性,并增强抗炎镇痛作用[118-119]。
4.2.2 久煎减毒 细辛汤剂先煎或久煎可有效减少毒性成分,随着煎煮时间的延长,水煎液中黄樟醚等毒性成分的含量不断下降[120]。细辛“不过钱”是针对散剂而言,入汤剂时可通过先煎或久煎增加细辛用量。
4.2.3 配伍减毒 细辛与其他药配伍使用能减毒增效。明代倪朱谟言:“细辛,佐姜、桂能驱脏腑之寒,佐附子能散诸疾之冷,佐独活能除少阴头痛,细辛若用于热证,则必须伍寒凉药,且用量宜轻”[121]。细辛配伍附子、白芍能显著降低细辛的急性毒性;甘草具有调和诸药的作用,细辛与甘草配伍,也可显著降低细辛毒性[122]。
4.2.4 剂量控制 细辛散剂不可使用大剂量,大量必须入汤药。细辛若以单方研末吞服,以1~3 g为宜[123]。入汤剂煎服,可用6~10 g或更多;入复方使用,相应剂量可增加。细辛应用需“辨证施量”,用于治疗头面部的疾患如风寒头痛、过敏性鼻炎、三叉神经痛等,一般煎服或粉末用量在1~3 g,煎服时应将细辛与其他药同煮不少于30 min;若治疗心绞痛等,煎服时用量可为3~6 g,方中可适当加入白芍、甘草等配伍减毒;若用于治疗咳嗽等肺系疾病,可将细辛炒制后配伍甘草或白芍减毒入复方煎服,煎服时用量可为6~9 g;若用于寒痹症及腰腿疼痛等顽疾时,煎服时可考虑从小剂量开始逐渐增至9~15 g,煎煮时将细辛先煎一段时间,并打开砂锅锅盖,利于毒性成分的挥发[122]。因此,细辛的临床剂量应综合考察其入药形式、主治病证及患者身体状况。
5 Q-Marker预测分析
Q-Marker是存在于中药材和中药产品(如中药饮片、中药提取物、中成药制剂)中专属的、与临床疗效相关的、可被监测的化学成分,Q-Marker的核心内容为基于特有性、可测性、有效性、传递性和中医药理论关联性的“五要素”,既反映了与有效性、安全性的关联,又体现了中药成分的专属性、差异性特征[124-125]。
5.1 基于植物亲缘学及化学成分特有性的Q-Marker预测分析
细辛在全世界约有90种,我国有30种、4变种和1变型。从本属中分离的各种成分中,除木脂素、多糖等成分外,挥发油类分布广泛、化学结构类型丰富、药理活性显著[126]。细辛挥发油中以甲基丁香酚最为重要[127],其生物合成途径[128]见图7。挥发油中还含有黄樟醚、β-细辛醚、3,5-二甲氧基甲苯(77)等多种化学成分[18-23]。王志清等[19]研究发现,不同产地、表型的样品间化合物的含量存在差异,以细辛脂素和挥发油含量为指标,不同产地细辛的细辛脂素含量相差可达20倍以上,挥发油含量辽宁、吉林、黑龙江、山东4地高于其余产地,黑龙江地区含量最高,整体评价辽细辛质量优于华细辛[6]。药效方面,不同基原、产地的细辛也有差异,北细辛抗炎作用强于华细辛,吉林产的北细辛镇痛作用强于所有华细辛,辽宁产的北细辛弱于陕西产的华细辛,不同产地同一品种的细辛镇痛抗炎作用也有显著差异[37]。综上,细辛中细辛脂素和挥发油成分如甲基丁香酚、黄樟醚、β-细辛醚、3,5-二甲氧基甲苯等可能是其潜在的Q-Marker。

图7 甲基丁香酚的合成路径
5.2 基于成分与传统功效相关性的Q-Marker预测分析
中药传统功效是临床用药的理论依据,与功效相关的化学成分是筛选Q-Marker的重要指标。细辛首载于《神农本草经》:“主咳逆,头痛脑动,百节拘挛,风湿痹痛,死肌。”《本草纲目》载:“风寒风湿头痛、痰饮、胸中滞气、惊痫者,宜用之。”《中国药典》2020年版载其“解表散寒、祛风止痛、通窍、温肺化饮。用于风寒感冒、头痛、牙痛、鼻塞流涕、鼻鼽、鼻渊、风湿痹痛、痰饮喘咳。”古今记载均表明细辛具有镇痛、镇静、止咳平喘之效。现代研究发现,细辛挥发油具有良好的抗炎、抑菌、抗病毒、抗氧化作用,尤以甲基丁香酚效果显著[39,53-54,71],甲基丁香酚和β-细辛醚还是细辛发挥止咳平喘作用的重要成分[49-51]。芝麻脂素可促进血管再生[60-62],细辛脂素具有抗氧化、抗癌等活性[69,82],β-细辛醚还可用于治疗某些神经系统性疾病[47,67]。十二碳四烯酰胺A和十二碳四烯酰胺B是具有代表性的2个酰胺类成分,具有抗炎止咳等活性[38,129]。综上,细辛中的细辛脂素、芝麻脂素、十二碳四烯酰胺A和十二碳四烯酰胺B和挥发油中甲基丁香酚、β-细辛醚等可能是其潜在的Q-Marker。
5.3 基于传统药性的Q-Marker预测分析
药性是中药的特有性质,与临床用药息息相关。细辛性温味辛,归心、肺、肾经,属辛温解表药[130]。辛味药能散能行、能温能升、能润能化,其物质基础包括挥发油、萜类、黄酮类、苷类,其中挥发油作用强于其他成分[131]。辛温入肺经,在苷类、挥发油类、黄酮类等成分作用下发挥散除表邪、行气利水、散化痰饮、通窍行血的功效,李亚敏等[132]研究发现,细辛入肺经体现在激活G蛋白偶联受体蛋白途径和化学小分子探测途径,进而通过激活嗅觉受体途径来影响肺脏的生理及病理反应;辛温入心经,挥发油类、黄酮类、酸类发挥扩张冠状动脉、抗心律不齐、活血通络、止痛抗炎等药效[133-134]。综上,细辛具有止咳平喘、抗炎镇痛、治疗心血管疾病等药理作用与其性味归经一致,细辛中黄酮类、苷类和挥发油成分是其性味的主要物质基础和来源,因此,上述几类成分可为细辛的Q-Marker选择提供参考。
5.4 基于复方配伍环境的Q-Marker预测分析
细辛在临床上根据疾病不同和不同药物进行配伍应用[135]。小青龙汤中细辛配伍半夏治疗咳嗽、肺炎等呼吸系统疾病,方中细辛挥发油起镇咳祛痰的作用[49,136];麻黄附子细辛汤中细辛配伍麻黄附子,治疗素体阳虚、外感风寒、无汗恶寒、发热蜷卧、苔白者,现代研究表明该方有抗炎、抗心率失常等作用[137],并可缓解新冠肺炎引起的发热症状[88],研究表明该方中细辛挥发油成分具有显著的活性[138];当归四逆汤中细辛配伍当归桂枝,用于治疗痛经、类风湿性关节炎等疾病,该方中细辛挥发油、细辛脂素、阿魏酸具有显著的药理活性,具有抗炎镇痛、抗菌、抗病毒等作用[139]。综上,细辛在复方配伍中发挥着与现代药理学研究相同的作用,细辛中的挥发油、木脂素和酸类成分可以为细辛Q-Marker的选择提供参考。
5.5 基于成分可测性的Q-Marker预测分析
化学成分稳定可测是Q-Marker的一个重要特征。研究表明可通过高效液相色谱法(high performance liquid chromatography,HPLC)对细辛中甲基丁香酚、芝麻脂素、细辛脂素、黄樟醚进行测定[140-141]。采用HPLC-四级杆-飞行时间质谱技术可以实现对细辛脂素的定性定量分析[142]。许金国等[143]应用HPLC建立当归四逆汤的指纹图谱,确认方中细辛的药效成分为细辛脂素和阿魏酸。应用HPLC-离子阱-飞行时间质谱技术可对细辛中十二碳四烯酰胺A、B 2种酰胺成分进行定性鉴别,应用超高效液相色谱-二极管阵列检测器技术可对二者进行含量测定[140]。此外,李君辉等[144]和王维等[145]应用气相色谱-质谱法对细辛挥发油成分进行定性分析,分别鉴定出55、73种化学成分。柴士伟等[146]研究表明甲基丁香酚、黄樟醚是细辛挥发油中主要的化学成分。综上,细辛中挥发油成分甲基丁香酚、3,5-二甲氧基甲苯、β-细辛醚、黄樟醚等,酸类成分阿魏酸,酰胺类成分十二碳四烯酰胺A、B及木脂素类成分芝麻脂素、细辛脂素等有望成为细辛潜在的Q-Marker。
6 结语与展望
细辛作为传统中药,在我国已有上千年的应用历史,多年的用药历史探索出针对不同病证可应用多种配伍复方进行治疗,但相关药物相互作用的研究很少。细辛活性成分中的高含量挥发油和木脂素展现出良好的药理活性,表现出显著的抗炎、抗病毒、止咳平喘等作用,但细辛中存在的一些非指示性成分如黄酮类、多糖类、酰胺类等,对其药理活性的研究有限,因此,这些成分在细辛药用中的作用仍有待阐明,未来对这些化合物的相关研究可为细辛的临床应用和新药开发提供新见解。随着现代技术的发展,对细辛深入研究后发现细辛临床应用范围拓宽,可用于治疗神经系统疾病、抗癌等新方向,亦有细辛方剂治疗新型冠状病毒引起的疾病报道,但细辛在其中的作用机制仍有待深入研究。此外,细辛的轻微毒性可能归因于某些挥发油或马兜铃酸类成分,应建立合理的评价方法,并结合毒性剂量和目标体系进行说明,有利于细辛的合理安全使用。
细辛成分复杂,现今的质量控制方式缺乏专属性和特有性,质控体系不够全面。本文对细辛化学成分、药理作用、临床应用及安全性评价进行综述,并从植物亲缘学、传统功效、传统药性、复方配伍、成分可测性等方面对细辛Q-Marker进行预测分析,初步建议以细辛脂素、芝麻脂素、甲基丁香酚、β-细辛醚、阿魏酸、十二碳四烯酰胺A和十二碳四烯酰胺B作为其Q-Marker,为细辛Q-Marker研究及建立系统的质控体系提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 240.
[2] 周祯祥. 细辛的基源与性状鉴别 [A] // 第二届临床中药学学术研讨会论文集 [C]. 南宁: 中华中医药学会, 2009: 328-331.
[3] 江苏新医学院. 中药大辞典 (下册) [M]. 上海: 上海科学技术出版社, 1977: 1477-1479.
[4] 于营, 张浩, 鲁海坤, 等. 不同生长年限北细辛产量和内在质量比较研究 [J]. 中华中医药杂志, 2021, 36(5): 2941-2945.
[5] 王元清, 江星明, 王智, 等. 细辛炮制品HPLC指纹图谱定性与有效成分定量分析研究 [J]. 中药材, 2015, 38(7): 1388-1392.
[6] 宗时宇, 刘洋, 张红, 等. 不同基原与产地的细辛质量评价及肝毒性化学成分定量分析 [J]. 时珍国医国药, 2021, 32(6): 1351-1353.
[7] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[8] 刘昌孝. 中药质量标志物 (Q-Marker) 研究发展的5年回顾 [J]. 中草药, 2021, 52(9): 2511-2518.
[9] 潘红亮, 欧阳天贽. 水蒸气蒸馏法和超声辅助提取法提取华细辛挥发油的比较 [J]. 食品科学, 2011, 32(10): 190-193.
[10] 蔡少青, 王禾, 陈世忠. 北细辛非挥发性化学成分的研究 [J]. 北京医科大学学报, 1996(3): 228-230.
[11] 吕帅, 许磊, 黄健, 等. 辽细辛地下部分化学成分的分离与鉴定 [J]. 沈阳药科大学学报, 2008, 25(9): 702-704.
[12] 曾虹燕, 金永钟, 包罗涛, 等. 不同方法提取的辽细辛挥发油指纹图谱分析 [J]. 测试技术学报, 2004, 18(3): 232-236.
[13] Jing Y, Zhang Y F, Shang M Y,. Chemical constituents from the roots and rhizomes ofvar.and theanti-inflammatory activity [J]., 2017, 22(1): 125.
[14] Quang T H, Ngan N T, Minh C V,. Anti-inflammatory and PPAR transactivational effects of secondary metabolites from the roots of[J]., 2012, 22(7): 2527-2533.
[15] Marchand P A, Kato M J, Lewis N G. (+)-episesaminone, afurofuran lignan. Isolation and hemisynthesis [J]., 1997, 60(11): 1189-1192.
[16] Cutillo F, D’Abrosca B, DellaGreca M,. Lignans and neolignans from: Effects on seed germination and plant growth [J]., 2003, 51(21): 6165-6172.
[17] Huang J, Wang H Q, Zhang C,. A new tetrahydrofuran-type lignan with anti-inflammatory activity fromFr. Schmidt var.[J]., 2014, 16(4): 387-392.
[18] 刘东吉, 刘春生. 不同产地栽培辽细辛的挥发油研究 [J]. 中国实验方剂学杂志, 2010, 16(9): 79-82.
[19] 王志清, 宋佳, 马海琴, 等. 不同产地细辛中主要有效成分含量测定与比较 [J]. 中草药, 2020, 51(3): 748-756.
[20] 张浅, 朱华旭, 唐志书, 等. 蒸汽渗透技术用于细辛挥发油含油水体分离的可行性研究 [J]. 中草药, 2019, 50(8): 1795-1803.
[21] 王波, 蒋斌, 沈夕坤, 等. 细辛挥发性成分的气相色谱/质谱分析 [J]. 中华中医药学刊, 2014, 32(11): 2726-2729.
[22] 赵静, 倪美萍, 景绍君, 等. 离子液体顶空微萃取-气相色谱/质谱法研究细辛挥发油中的化学成分 [J]. 时珍国医国药, 2015, 26(2): 296-298.
[23] 陈燕銮, 刘秋琼, 王建壮, 等. 三种不同方法提取北细辛挥发油的成分分析 [J]. 中药材, 2013, 36(9): 1447-1451.
[24] 王风, 李楠, 李雪, 等. HS-SPME/GC-MS法测定北细辛挥发性成分 [J]. 日用化学工业, 2021, 51(11): 1150-1157.
[25] 齐文, 王莉莉, 温浩, 等. 辽细辛根及根茎化学成分的分离与鉴定 [J]. 沈阳药科大学学报, 2014, 31(9): 681-686.
[26] 李俊, 李甫, 陆园园, 等. 满山香子抗炎成分研究 [J]. 中国药学杂志, 2007, 42(4): 255-257.
[27] Liu H Z, Wang C H. The genus: A review on phytochemistry, ethnopharmacology, toxicology and pharmacokinetics [J]., 2022, 282: 114642.
[28] Morikawa T, Wang L B, Nakamura S,. Medicinal flowers. XXVII. New flavanone and chalcone glycosides, arenariumosides I, II, III, and IV, and tumor necrosis factor-alpha inhibitors from everlasting, flowers of[J]., 2009, 57(4): 361-367.
[29] Thanh Le T, Ha M T, Han K H,. Anti-inflammatory lignans from the roots ofvar.and their mechanism of action [J]., 2022, 19(6): e202100986.
[30] 董玉启, 于华, 王春华, 等. 北细辛根化学成分研究 [J]. 天津中医药, 2017, 34(12): 845-848.
[31] 任婷, 宋天一, 牟莹莹, 等. 细辛多糖的提取工艺优化及细胞衰老保护作用 [J]. 食品工业科技, 2019, 40(11): 33-39.
[32] 温浩. 细辛药材质量评价的研究[D]. 沈阳: 沈阳药科大学, 2016.
[33] 欧爱芬, 黄嘉乐, 董杨静, 等. 超高效液相色谱-串联三重四极杆串联质谱法测定细辛中的4种马兜铃酸 [J]. 现代食品科技, 2022, 38(5): 296-303.
[34] 贾羲, 付智慧, 茹庆国, 等. 不同剂量细辛水煎液抗炎镇痛与肾毒性研究 [J]. 中医药信息, 2022, 39(11): 55-59.
[35] 聂安政, 茹庆国, 付智慧. 细辛水煎液抗炎镇痛作用研究 [J]. 中医药信息, 2021, 38(7): 40-42.
[36] 刘杰, 刘广学, 尚明英, 等. 华细辛和北细辛HPLC特征图谱识别与抗炎靶点及抗炎成分分析 [J]. 中国中药杂志, 2020, 45(6): 1374-1383.
[37] Phitak T, Pothacharoen P, Settakorn J,. Chondroprotective and anti-inflammatory effects of sesamin [J]., 2012, 80: 77-88.
[38] Lee W, Ku S K, Min B W,. Vascular barrier protective effects of pellitorine in LPS-induced inflammationand[J]., 2014, 92: 177-187.
[39] 武楠, 张秀丽, 候赟, 等. 甲基丁香酚对变应性鼻炎大鼠鼻黏膜水通道蛋白5的影响 [J]. 北京大学学报: 医学版, 2019, 51(6): 1036-1041.
[40] Wang B B, Yuan D. Comparative study of chemical composition, antinociceptive effect and acute toxicity of the essential oils of threedrugs [J]., 2014, 23(7): 480-489.
[41] 刘甜甜, 赵红霞, 高蔚, 等. 细辛醇提物对瞬时感受器电位香草素受体1的干预作用及改善小鼠神经性疼痛的机制研究 [J]. 中华中医药杂志, 2021, 36(8): 4998-5001.
[42] 杨桢, 高琳, 赵红霞, 等. 热敏通道:“寒者热之, 热者寒之”的细胞和分子生物学意义 [J]. 中国中医基础医学杂志, 2014, 20(10): 1358-1361.
[43] 杨华, 徐风, 万丹, 等. 甲基丁香酚镇痛抗炎作用及机制研究 [J]. 中药新药与临床药理, 2017, 28(3): 292-297.
[44] Dal Bó W, Luiz A P, Martins D F,. Eugenol reduces acute pain in mice by modulating the glutamatergic and tumor necrosis factor alpha (TNF-α) pathways [J]., 2013, 27(5): 517-525.
[45] 曲中原, 吴双, 邹翔, 等. 基于网络药理学的干姜-细辛-五味子止咳平喘作用机制探究 [J]. 哈尔滨医科大学学报, 2020, 54(5): 457-463.
[46] 赵晔, 柴茂山. 细辛及小青龙汤对冷哮大鼠呼吸与神经系统损伤的保护作用 [J]. 中药材, 2021, 44(5): 1234-1238.
[47] 张会宗, 向绍杰, 孟莉, 等. 中药细辛不同提取物平喘活性分析 [J]. 辽宁中医杂志, 2011, 38(3): 551-552.
[48] 吴建兵, 褚襄萍, 张永煜, 等. 五味子-细辛药对抗哮喘活性部位筛选 [J]. 中华中医药学刊, 2013, 31(1): 121-123.
[49] 刘晶, 孟莉, 袁子民, 等. 细辛止咳平喘药效物质基础初步研究 [J]. 医药导报, 2012, 31(11): 1412-1415.
[50] 啜飞飞, 张会宗, 袁子民, 等. 止咳平喘凝胶剂质量标准研究 [J]. 中华中医药学刊, 2014, 32(3): 590-592.
[51] Qiu D Y, Hou L L, Chen Y H,. Beta-asarone inhibits synaptic inputs to airway preganglionic parasympathetic motoneurons [J]., 2011, 177(3): 313-319.
[52] 于婷婷, 李强, 王茂青, 等. 北细辛挥发油对5种镰刀菌的抑菌活性及其成分分析 [J]. 天然产物研究与开发, 2015, 27(7): 1225-1231.
[53] Haque A S M T, Moon J N, Saravana P S,. Composition ofvar.radix oil from different extraction methods and activities against human body odor-producing bacteria [J]., 2016, 24(4): 813-821.
[54] Dan Y, Liu H Y, Gao W W,. Activities of essential oils fromvar.against five phytopathogens [J]., 2010, 29(3): 295-299.
[55] 张磊. 辽细辛非挥发性化学成分、质量控制和抗菌活性研究 [D]. 沈阳: 沈阳药科大学, 2008.
[56] Perumalsamy H, Jung M Y, Hong S M,. Growth-Inhibiting and morphostructural effects of constituents identified inroot on human intestinal bacteria [J]., 2013, 13: 245.
[57] 夏琦, 邓时贵, 卢传坚, 等. 土茯苓对环孢素A诱导的免疫抑制小鼠免疫功能的影响 [J]. 中国现代应用药学, 2019, 36(21): 2638-2642.
[58] 杨佳, 付业佩, 杜宝香, 等. 细辛多糖对流感病毒H1N1型感染的保护作用及对炎症因子表达水平的影响 [J]. 中国中药杂志, 2021, 46(2): 412-419.
[59] 吴昊, 王佳琪, 杨雨薇, 等. 基于网络药理学和分子对接技术初步探索“清肺排毒汤”抗新型冠状病毒肺炎作用机制 [J]. 药学学报, 2020, 55(3): 374-383.
[60] Chung B H, Lee J J, Kim J D,. Angiogenic activity of sesamin through the activation of multiple signal pathways [J]., 2010, 391(1): 254-260.
[61] Ku S K, Lee W, Yoo H,. Inhibitory effects of-sesamin on endothelial protein C receptor sheddingand[J]., 2013, 62(10): 895-902.
[62] Pham T H, Jin S W, Lee G H,. Sesamin induces endothelial nitric oxide synthase activation via transient receptor potential vanilloid type 1 [J]., 2020, 68(11): 3474-3484.
[63] 石含秀, 韩林, 贾波, 等. 细辛含药血清对大鼠心肌细胞钠通道的影响 [J]. 浙江中西医结合杂志, 2009, 19(10): 599-602.
[64] Ku S K, Lee I C, Kim J A,. Antithrombotic activities of pellitorineand[J]., 2013, 91: 1-8.
[65] Park H J, Lim E J, Zhao R J,. Effect of the fragrance inhalation of essential oil fromon depression-like behaviors in mice [J]., 2015, 15: 43.
[66] 黄丽平, 周中流, 宁百乐, 等. β-细辛醚联合左旋多巴对帕金森病大鼠单胺类神经递质的影响 [J]. 中成药, 2021, 43(10): 2800-2804.
[67] 朱彩霞, 黄丽, 方永奇, 等. β-细辛醚对慢性不可预见性轻度刺激小鼠模型的行为学和单胺类神经递质的影响 [J]. 时珍国医国药, 2017, 28(4): 833-836.
[68] 张洁, 王强, 梁雨璐, 等. 丁香酚与甲基丁香酚的抗焦虑作用机制研究 [J]. 药物评价研究, 2021, 44(6): 1259-1265.
[69] 刘帅. 芝麻素转化为细辛素条件的研究及其抗衰老应用 [D]. 郑州: 河南工业大学, 2016.
[70] 滕坤, 沈鹏, 孙健, 等. 响应面法优化超声波辅助提取细辛中抗氧化活性成分的工艺基础研究 [J]. 中国药学杂志, 2020, 55(18): 1499-1504.
[71] 匡柏成, 张季, 王梦琴, 等. 甲基丁香酚的生物学活性及其作用机制的研究进展[J]. 现代药物与临床, 2021, 36(7): 1533-1536.
[72] 梁少瑜. 麻黄附子细辛汤抗过敏性鼻炎药效物质基础的研究 [D]. 广州: 南方医科大学, 2012.
[73] 唐锋. 基于网络药理学的麻黄附子细辛汤组方药材抗过敏性鼻炎物质基础的研究[D]. 广州: 南方医科大学, 2015.
[74] 高皓, 贾党生, 郝俊霞, 等. 基于网络分析细辛毒理学 [J]. 中国实验方剂学杂志, 2019, 25(10): 180-187.
[75] 王文轩. 细辛有效成分甲基丁香酚对大鼠癫痫模型及海马神经元放电的影响 [D]. 济南: 山东中医药大学, 2017.
[76] Woo J, Yang H, Yoon M,. 3-carene, a phytoncide from pine tree has a sleep-enhancing effect by targeting the GABAA-benzodiazepine receptors [J]., 2019, 28(5): 593-601.
[77] Woo J, Lee C J. Sleep-enhancing effects of phytoncide via behavioral, electrophysiological, and molecular modeling approaches [J]., 2020, 29(2): 120-129.
[78] Gu J, Zhang L, Wang Z,. The effect of Asarinin on Toll-like pathway in rats after cardiac allograft implantation [J]., 2015, 47(2): 545-548.
[79] 张丽丽, 于波, 杨宝峰. 细辛脂素+供鼠脾/骨髓细胞诱导的免疫耐受对大鼠心脏移植存活的影响 [J]. 心脏杂志, 2010, 22(1): 16-19.
[80] Li J J, Ji L, Sun L,. Analysis of herba asari polysaccharides and their immunological activity [J]., 2012, 87(1): 551-556.
[81] Guo H F, Wang M H. Dichloromethane fraction ofinduces S phase arrest and apoptosis in KB oral epithelial carcinoma cells [J]., 2017, 89: 559-564.
[82] Jeong M, Kim H M, Lee J S,. (−)-Asarinin from the roots ofinduces apoptotic cell death via caspase activation in human ovarian cancer cells [J]., 2018, 23(8): 1849.
[83] Kim E, Kim H J, Oh H N,. Cytotoxic constituents from the roots ofin human breast cancer cells [J]., 2019, 25(1): 72.
[84] Jo H, Cha B, Kim H,. α-Pinene enhances the anticancer activity of natural killer cells via ERK/Akt pathway [J]., 2021, 22(2): 656.
[85] 姜峰. 细辛在经方中的应用规律浅析 [J]. 中国中医基础医学杂志, 2014, 20(2): 244.
[86] 沈晓敏, 袁红霞. 《神农本草经》与经方应用之细辛篇 [J]. 山东中医药大学学报, 2022, 46(2): 143-147.
[87] 孔群, 丛丽娜. 麻黄附子细辛汤治疗小儿支气管肺炎临床疗效分析 [J]. 中医临床研究, 2019, 11(34): 74-76.
[88] 安颂歌, 陈琳, 魏方, 等. 麻黄附子细辛汤治疗轻型新型冠状病毒性肺炎反复发热举隅 [J]. 中国中医药现代远程教育, 2020, 18(5): 22-24.
[89] 屈媛媛, 韩富红, 杨柳. 加味苓甘五味姜辛汤治疗支气管哮喘慢性持续期痰哮证对患者抗氧化活性酶的变化研究 [J]. 中华中医药学刊, 2022, 40(10): 148-151.
[90] 罗乐, 户海宁, 王盛龙.穴位敷贴联合加味小青龙汤治疗支气管哮喘急性发作期的效果[J/OL]. 辽宁中医杂志, [2022-12-17]. http://kns.cnki.net/kcms/detail/21.1128. R.20221031.1355.022.html.
[91] 林彩战. 小青龙汤加减联合盐酸左氧氟沙星片治疗慢性支气管炎的疗效观察 [J]. 内蒙古中医药, 2022, 41(10): 11-13.
[92] 詹成思. 麻黄附子细辛汤加减治疗慢性心律失常的临床效果 [J]. 临床合理用药杂志, 2022, 15(34): 38-41.
[93] 陈安凤, 谈勇. 加味当归四逆汤治疗慢性肺源性心脏病30例疗效观察 [J]. 陕西中医药大学学报, 2016, 39(2): 35-37.
[94] 王强, 史航, 霍艳明. 当归四逆汤治疗心衰的临床验案 [J]. 辽宁中医杂志, 2021, 48(5): 55-57.
[95] 刘宾, 郑明常, 王付. 赤丸临床应用进展 [J]. 中医临床研究, 2012, 4(7): 57.
[96] 茅利玉, 徐新亚. 乌梅丸联合针刺疗法对失眠症患者血清5-HT、BDNF及SAS积分影响研究 [J]. 中华中医药学刊, 2017, 35(12): 3187-3189.
[97] 金虹, 庞雪莹, 刘小外, 等. 乌梅丸治疗恶性肿瘤的研究进展 [J]. 实用临床医药杂志, 2021, 25(8): 129-132.
[98] 栾永福, 李晓骄阳, 孙蓉. 基于功效和物质基础的细辛毒性研究进展 [J]. 中国药物警戒, 2012, 9(3): 170-173.
[99] 王莉, 吴波, 王绍印. 正确认识“细辛不过钱” [J]. 天津中医药大学学报, 2018, 37(5): 366-368.
[100]宗时宇, 刘洋, 孙婷婷, 等. 细辛毒性及其控制方法研究进展 [J]. 中国药师, 2020, 23(5): 942-945.
[101]强小娟, 尹玎, 朱智慧. 细辛炮制历史沿革和研究进展 [J]. 中国中医药信息杂志, 2017, 24(10): 130-132.
[102]刘金伟. 基于网络药理学与1H-NMR代谢组学的细辛肺肝肾毒性机制研究 [D]. 武汉: 湖北中医药大学, 2022.
[103]钱深思, 刘美怡, 容蓉, 等. 细辛挥发油的化学成分及其药理和毒理现代研究进展 [J]. 中国药物警戒, 2021, 18(4): 388-395.
[104]费可, 胡瑕瑜, 邹璐, 等. 细辛临床应用与药理作用研究进展 [J]. 上海中医药大学学报, 2010, 24(6): 87-90.
[105]李亚敏. 基于网络药理学和多组学的细辛肺毒性机制研究 [D]. 武汉: 湖北中医药大学, 2019.
[106]Li Y M, Han L T, Huang C H,. New contributions topowder on immunology related toxicity effects in lung [J]., 2018, 2018: 1054032.
[107]徐建兵. 细辛毒性靶器官研究 [D]. 成都: 成都中医药大学, 2013.
[108]黄顺旺. 细辛的药理毒理和临床应用[J]. 安徽医药, 2003(6): 477-479.
[109]于俏, 陈雨虹, 琚辉, 等. 细辛挥发油成分与CYP1A2酶的分子对接分析 [J]. 中国实验方剂学杂志, 2020, 26(9): 202-207.
[110]曹洒. 基于代谢组学和转录组学的细辛散剂肝毒性机制研究 [D]. 武汉: 湖北中医药大学, 2020.
[111]张令悦, 苏励. 基于“有故无殒”理论的细辛肾毒性研究 [J]. 中华中医药学刊, 2021, 39(10): 78-81.
[112]梁爱华, 高月, 张伯礼. 含马兜铃酸中药的安全性问题及对策 [J]. 中国食品药品监管, 2017(11): 17-20.
[113]王懿, 黄伟, 孙蓉. 基于功效和毒性的细辛化学成分研究进展 [J]. 中国药物警戒, 2013, 10(1): 36-38.
[114]Huang T C, Chen S M, Li Y C,. Increased renal semicarbazide-sensitive amine oxidase activity and methylglyoxal levels in aristolochic acid-induced nephrotoxicity [J]., 2014, 114(1): 4-11.
[115]Li Y, Wang Z H, Wang S,. Gremlin-mediated decrease in bone morphogenetic protein signaling promotes aristolochic acid-induced epithelial-to-mesenchymal transition (EMT) in HK-2 cells [J]., 2012, 297(1/2/3): 68-75.
[116]刘金伟, 韩林涛, 黄芳, 等. 基于1H-NMR代谢组学细辛肝肾毒性的机制研究 [J]. 中药药理与临床, 2020, 36(4): 131-136.
[117]严建业, 王元清, 王炜, 等. 细辛中马兜铃酸A与黄樟醚的炮制减毒方法研究 [J]. 中草药, 2015, 46(2): 216-220.
[118]王雪, 李连坤, 张彦飞, 等. 细辛炮制前后的药效学及毒理学研究 [J]. 中国医药导报, 2015, 12(22): 36-39.
[119]黄鲛. 细辛毒/效成分的含量测定及炮制对毒/效成分影响的研究 [D]. 成都: 成都中医药大学, 2013.
[120]黄鲛, 易进海, 刘玉红, 等. 细辛煎煮过程中甲基丁香酚、黄樟醚和细辛脂素的变化研究 [J]. 中成药, 2012, 34(10): 1971-1974.
[121]晏和国, 杨博, 侯建婷, 等. “细辛不过钱”释疑 [J]. 中医药通报, 2016, 15(6): 44-45.
[122]聂安政, 赵雪睿, 朱春胜, 等. 细辛用药沿革与合理用药思考 [J]. 中草药, 2018, 49(23): 5719-5723.
[123]胡子贤, 傅延龄. 《本草别说》之前细辛临床用量文献研究 [J]. 江苏中医药, 2019, 51(4): 69-71.
[124]Liu C X, Cheng Y Y, Guo D A,. A new concept on quality marker for quality assessment and process control of Chinese medicines [J]., 2017, 9(1): 3-13.
[125]Wang Y L, Cui T, Li Y Z,. Prediction of quality markers of traditional Chinese medicines based on network pharmacology [J]., 2019, 11(4): 349-356.
[126]中国植物志编辑委员会. 中国植物志 (第二十四卷) [M]. 北京: 科学出版社, 1988: 176.
[127]潘磊, 郑柳, 牛卉, 等. 细辛挥发油成分提取与甲基丁香酚含量测定的研究进展 [J]. 时珍国医国药, 2015, 26(4): 967-970.
[128]刘津, 于思礼, 马雅婷, 等. 天然木脂素的代谢工程和合成生物学研究进展 [J]. 中草药, 2016, 47(14): 2556-2562.
[129]谢德媚, 刘广学, 徐风, 等. 辽细辛中十二碳四烯酰胺A, B的定性及定量分析研究 [J]. 中国中药杂志, 2015, 40(4): 691-699.
[130]张恺, 丁丽琴, 邱峰, 等. 基于代谢组学的解表、清热、泻下类单味中药研究进展[J]. 中草药, 2021, 52(2): 585-593.
[131]周复辉, 易增兴, 罗亨凡. 辛味中药化学成分的分析 [J]. 安徽农业科学, 2006, 34(12): 2760.
[132]李亚敏, 周祯祥, 韩林涛, 等. 细辛启动大鼠嗅觉识别体系与归肺经相关性研究 [J]. 中华中医药杂志, 2019, 34(12): 5911-5914.
[133]王小雪, 卢杉, 郑思悦, 等. 归经中药化学成分、药理作用及临床应用的实证分析 [J]. 中华中医药杂志, 2018, 33(11): 5193-5197.
[134]孙坤坤, 王加锋. 辛味药药性理论及归经应用 [J]. 山东中医药大学学报, 2021, 45(4): 458-461.
[135]林家冉, 柳红芳, 邸莎, 等. 细辛的临床应用及其用量探究 [J]. 吉林中医药, 2021, 41(2): 259-263.
[136]龚李萍, 王玉兰, 郭超峰. 小青龙汤的临床应用研究进展 [J]. 长春中医药大学学报, 2021, 37(2): 468-472.
[137]高鹏辉, 梁文华. 麻黄附子细辛汤临床应用研究进展 [J]. 中国中医药现代远程教育, 2022, 20(17): 206-208.
[138]梁少瑜, 谭晓梅, 陈飞龙, 等. 麻黄附子细辛汤及组方药材挥发油GC-MS比较分析 [J]. 中药材, 2011, 34(6): 896-901.
[139]余玖霞, 梅茜, 许金国, 等. 当归四逆汤中细辛的药效成分及其毒性研究 [J]. 中国医院用药评价与分析, 2022, 22(8): 915-919.
[140]李妍, 何文媛, 王康宇, 等. 基于HPLC多指标成分测定及指纹图谱多模式识别方法的北细辛质量分析 [J]. 中草药, 2022, 53(1): 238-243.
[141]黄鲛, 易进海, 刘玉红, 等. 炒制对细辛中黄樟醚、甲基丁香酚和细辛脂素含量的影响 [J]. 中国实验方剂学杂志, 2013, 19(19): 90-92.
[142]陈闪闪, 杨欣怡, 戴国梁, 等. 高效液相-四级杆-飞行时间质谱法定性与定量分析麻黄附子细辛汤成分 [J]. 中国医院药学杂志, 2022, 42(6): 601-606.
[143]许金国, 夏金鑫, 梅茜, 等. 经典名方当归四逆汤指纹图谱及功效关联物质预测分析 [J]. 中草药, 2021, 52(15): 4507-4518.
[144]李君辉, 闫微, 崔恩姬, 等. 不同产地细辛挥发油成分的GC-MS分析 [J]. 时珍国医国药, 2019, 30(1): 188-190.
[145]王维, 贾晓华, 高梦园, 等. 水蒸气蒸馏与顶空进样GC-MS法分析细辛挥发性成分 [J]. 天津中医药, 2021, 38(5): 654-658.
[146]柴士伟, 苗欣欣, 姚广哲, 等. 不同产地细辛中挥发油GC-MS指纹图谱的建立及其化学模式识别研究[J]. 现代药物与临床, 2023, 38(1): 71-76.
Research progress on chemical composition and pharmacological effects ofetand predictive analysis on quality marker
HUA Xin-zhen1, LIU Cong-ying1, HE Meng-yuan1, YU Xiao-jun1, GAO Peng2, CONG Zhu-feng1, 3
1. College of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China 2. Institute of Pharmaceutical Research, Shandong University of Traditional Chinese Medicine, Jinan 250355, China 3. Cancer Hospital Affiliated to Shandong First Medical University, Jinan 250117, China
Xixin (et) was first recorded in’. It has the effects of relieving exterior and dispersing cold, dispelling wind and relieving pain, opening orifices, and warming lungs and resolving fluid retention. The main chemical components include lignans, volatile oils, acids, glycosides, nitrogen compounds, etc. Modern pharmacology indicates thatethas various pharmacological effects such as anti-inflammatory and analgesic, cough relieving and asthma relieving, antibacterial, and antiviral. Through a review of the chemical composition, pharmacological effects, clinical applications, and safety ofetin the past decade, quality marker (Q-marker) prediction analysis was conducted onetfrom aspects of plant affinity, efficacy, pharmacological properties, compatibility, and chemical component testability. Asarinin, sesamin, methyl eugenol, β-asarone, ferulic acid, dodecatetraenamide A, and dodecatetraenamide B can be used as its Q-Marker through the preliminary predictions, with view to providing reference for the establishment and improvement of quality evaluation system of.
et; quality marker; asarinin; sesamin; methyl eugenol; β-asarone; ferulic acid; dodecatetraenamide A; dodecatetraenamide B
R284
A
0253 - 2670(2023)12 - 4019 - 17
10.7501/j.issn.0253-2670.2023.12.028
2023-01-10
山东省重点研发计划项目(2020CXGC010505-06);山东省高校青年创新团队(人才引育计划)
华新振(1998—),男,硕士研究生,研究方向为中药制剂学。E-mail: hxz15163973952@163.com
通信作者:高 鹏(1978—),教授,博士生导师,从事中药创新药物现代研究。E-mail: gaopeng@sdutcm.edu.cn
丛竹凤(1978—),医学硕士,执业药师,从事创新药物开发研究。E-mail: congzhufeng@163.com
[责任编辑 赵慧亮]

