羟基红花黄色素A对MCAO大鼠脑组织XIAP蛋白及细胞凋亡的调节作用
郭莉琛,杜鑫苑,许海英,梁冰,张彤,袁庆,胡利民
天津中医药大学中医药研究院/组分中药国家重点实验室/天津市中药药理学重点实验室/方剂学教育部重点实验室,天津 301617
缺血性脑卒中是临床常见的一种卒中类型,具有发病率高、致残率高、病死率高的特点[1]。目前,缺血性脑卒中的治疗方法主要为药物溶栓和机械取栓,但伴随着治疗窗窄、出血并发症风险高等限制因素,因此,探索新的有效缓解脑缺血损伤的药物成为当务之急。中药红花是菊科植物红花的干燥花,性辛、温,归心、肝经,具有活血通经,散瘀止痛之效[2]。现代药理研究表明,羟基红花黄色素A作为中药红花的主要活性成分,在调节氧化应激、炎症反应、糖脂代谢、血管功能方面发挥重要作用,在治疗心脑血管疾病方面有广阔的应用前景[3-6]。X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)是凋亡抑制蛋白(Inhibitor of apoptosis proteins,IAPs)家族中抑制Caspase 活性能力最强的因子,是调节细胞凋亡的重要蛋白[7]。研究表明,XIAP参与凋亡、自噬、焦亡等多种细胞程序性死亡方式的调节[8-10]。缺血性脑卒中发生后,由于供血不足能量代谢异常引发的一系列级联反应造成细胞大量死亡,因此,细胞凋亡机制的调节对疾病的治疗有重要意义[11]。目前,内源性XIAP在缺血性脑卒中中的细胞凋亡调节机制尚不明确。本文以细胞凋亡为出发点,研究羟基红花黄色素A对脑缺血后XIAP蛋白的调节作用及细胞凋亡的影响,以探讨羟基红花黄色素A治疗缺血性脑卒中的可能机制。
1 材料
1.1 动物75只SPF级Wistar雄性大鼠,体质量250~280 g,购自北京维通利华实验动物公司,许可证号:SCXK(京)2021-0006,饲养于天津中医药大学实验动物中心,自由进食进水,室温20~25 ℃,相对湿度56%~60%。动物实验获得天津中医药大学伦理委员会批准(审批号:TCM-LAEC2022119)。
1.2 药物与试剂羟基红花黄色素A(广州悦康生物制药有限公司,规格:25 mg/瓶,批号:200901);B淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)抗体、Bcl-2同源二聚体X(Bcl-2-Associated X,Bax)抗体、β-actin抗体(英国Abcam公司,货号:ab196495、ab199677、ab179467);Caspase-3抗体(美国Cell Signaling Technology公司,货号:9662S);XIAP抗体(美国Bioworld公司,货号:CAS75122);HE染色试剂盒及Nissl染色试剂盒、RIPA裂解液(北京索莱宝科技有限公司,货号:C0105、G1430、R0020);TUNEL凋亡检测试剂盒(上海碧云天生物技术有限公司,货号:C1088);超氧化物歧化酶(superoxide dismutase,SOD)测试盒(羟胺法)、丙二醛(malondialdehyde,MDA)测定试剂盒(TBA法)(南京建成生物工程研究所,货号:A001-1、A003-1);2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC,美国Sigma-Aldrich公司,货号:T8877)。
1.3 仪器HCM100-Pro型恒温震荡金属浴(大龙实验仪器公司);1658001型Western-blot电泳仪(美国Bio-Rad公司);trans-blot®型转膜仪(美国Invitrogen 公司);RM2135型病理切片机、Leica 750型生物显微镜(德国LEICA公司);Amersham imager 600型超灵敏多功能成像仪(美国General Electric 公司);Eclipse Ti型倒置荧光显微镜(日本Nikon公司);FlexStation3型多功能酶标仪(美国MD公司)。
2 方法
2.1 动物分组、建模及给药成年健康Wistar大鼠随机分为假手术组、永久性大脑中动脉梗塞模型组(permanent middle cerebral artery occlusion,pMCAO)、羟基红花黄色素A低剂量组(2.5 mg·kg-1)、羟基红花黄色素A中剂量组(5.0 mg·kg-1)、羟基红花黄色素A高剂量组(7.5 mg·kg-1),每组15只。除假手术组外,其余大鼠建立永久性大脑中动脉梗塞模型[12],具体操作如下:术前大鼠禁食12 h,3%异氟烷麻醉大鼠,手术过程电热毯维持大鼠体温,使得大鼠肛温为(37.0±0.5) ℃,保持室温25 ℃。备皮消毒后,纵向切开颈部皮肤,分离颈总动脉、颈外动脉和颈内动脉,结扎颈内动脉远心端,夹闭颈总动脉和颈内动脉,在颈外动脉近心端剪口,沿着颈外动脉向颈内动脉插入线栓,有轻微阻力感时停止,深约1.8~2.0 cm。结扎血管固定好线栓,皮肤缝合并消毒。假手术组不做插线栓处理。术后以Longa评分法[13]对大鼠进行初步神经行为学评分,具体评分原则见表1,评分为1分和2分的造模大鼠视为模型建立成功,纳入后续实验。造模3 h后,各组大鼠尾静脉注射给予相应药物,假手术组和模型组给予同体积生理盐水,每日1次,连续3 d,末次给药2 h后取材。

表1 Longa评分细则
2.2 神经功能缺损评分在造模72 h后,通过改良大鼠神经严重程度评分法(modified neurological severity score,mNSS)对大鼠运动、感觉、反射和平衡功能进行评估[14]。运动测试、平衡木测试及发射测试具体评分方法见表2;感觉测试包括放置实验和本体感觉实验,各计1分;发射测试包括耳廓反射、角膜反射、惊恐反射,各计1分;异常运动涉及癫痫、肌阵挛后肌张力障碍,计1分。各项评分加和为mNSS 评价得分,总分18分。

表2 mNSS评分表
2.3 TTC染色末次给药2 h后,每组取5只大鼠异氟烷麻醉后处死。取大鼠大脑去除小脑、脑干和嗅球后置于脑槽中连续切厚度为2 mm的冠状切片。脑组织切片按照顺序置于2% TTC溶液中 37 ℃ 避光孵育10 min。根据染色情况评估脑梗死体积。用Image J图像分析软件分析各组脑梗死体积,公式如下:脑梗死体积=(6张脑片缺血对侧面积之和-6张脑片缺血侧未梗死面积)×2 mm/(6张脑片缺血对侧总面积×2 mm×100%)。
2.4 HE染色及Nissl染色异氟烷麻醉大鼠后,对大鼠进行心脏灌流生理盐水,取出的脑组织在体积分数4%多聚甲醛溶液中固定,经脱水、石蜡包埋及切片处理后,进行后续染色处理。染色前将石蜡切片分别于二甲苯、无水乙醇、体积分数95%乙醇、体积分数80%乙醇、体积分数70%乙醇、超纯水中浸泡脱蜡。HE染色:用苏木素染液浸泡切片 5 min,流水清洗,盐酸乙醇分化液分化30 s后,自来水浸泡15 min。滴加伊红染液染色1 min,流水清洗。Nissl染色:切片滴加焦油紫染色液,并置于 56 ℃ 恒温箱1 h。超纯水冲洗5 min;尼氏染色分化液分化30 s,显微镜下观察至背景接近于无色为止。染色结束后,采用梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察拍片。
2.5 氧化应激指标检测大鼠末次给药2 h后,异氟烷麻醉大鼠,打开腹腔,用含抗凝剂的采血管通过腹主动脉取血。血液室温静置30 min后,4 ℃,3 000 r·min-1离心10 min,收集上清,即得到血浆,于-80 ℃冰箱保存。取各组大鼠血浆参照MAD和SOD检测试剂盒说明进行检测,用酶标仪检测吸光度,计算各样品MDA、SOD水平。MDA检测:取200 μL待测血浆加入离心管中,按顺序分别加入试剂一、试剂二、试剂三各200 μL,保鲜膜封口,95 ℃ 水浴加热40 min。流水冷却,4 000 r·min-1离心10 min。取上清,于532 nm波长检测吸光度。标准品管和空白管分别用10 nmol·mL-1标准品和无水乙醇代替血浆样品进行检测。MDA含量(μmol·L-1)=(样品吸光度-空白吸光度)/(标准品吸光度-空白吸光度)×标准品浓度。SOD检测:将50 μL待测血浆加入含1 mL试剂一的离心管中,分别加入试剂二、试剂三、试剂四各100 μL,涡旋混匀,37 ℃恒温水浴40 min。加入2 mL显色剂,室温放置10 min,于550 nm波长检测吸光度。对照管用50 μL蒸馏水代替血浆样品进行检测。
SOD活力=(对照吸光度-样品吸光度)/对照吸光度÷50%×反应体系稀释倍数
2.6 TUNEL染色石蜡切片用含0.5% Triton的PBS溶液室温孵育30 min;放入装有煮沸的 0.01 mol·L-1柠檬酸钠抗原修复液(pH 6.0)高压锅里进行抗原修复;滴加正常山羊血清工作液室温封闭1 h,PBS溶液漂洗3次;室温避光滴加DAPI孵育10 min,PBS溶液漂洗3次;避光条件下,每个组织切片滴加100 μL TUNEL检测液,37 ℃避光孵育60 min,PBS洗涤3次。抗荧光淬灭封片剂封片,在倒置荧光显微镜下观察缺血半暗带TUNEL阳性细胞,于倒置荧光显微镜下观察缺血半暗带细胞凋亡情况。
细胞凋亡率=凋亡细胞数量/总细胞数量×100%
2.7 Western blot实验用含10%蛋白酶抑制剂的RIPA裂解液超声破碎提取大鼠脑组织蛋白,12 000×g离心10 min取上清液。BCA蛋白检测试剂盒测定蛋白浓度,100 ℃沸水浴加热10 min使蛋白变性。用4%~12% SDS-PAGE进行电泳,170 V 电泳40 min;然后转移到PVDF膜上,PVDF膜在5%脱脂牛奶中封闭2 h,并用TBST缓冲液洗涤3次,滴加稀释好的一抗(稀释比例为1:1 000),4 ℃孵育过夜。用与HRP结合的二抗(稀释比例为1:10 000)孵育1 h,显影。使用Image J软件分析目的蛋白灰度值。
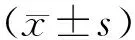
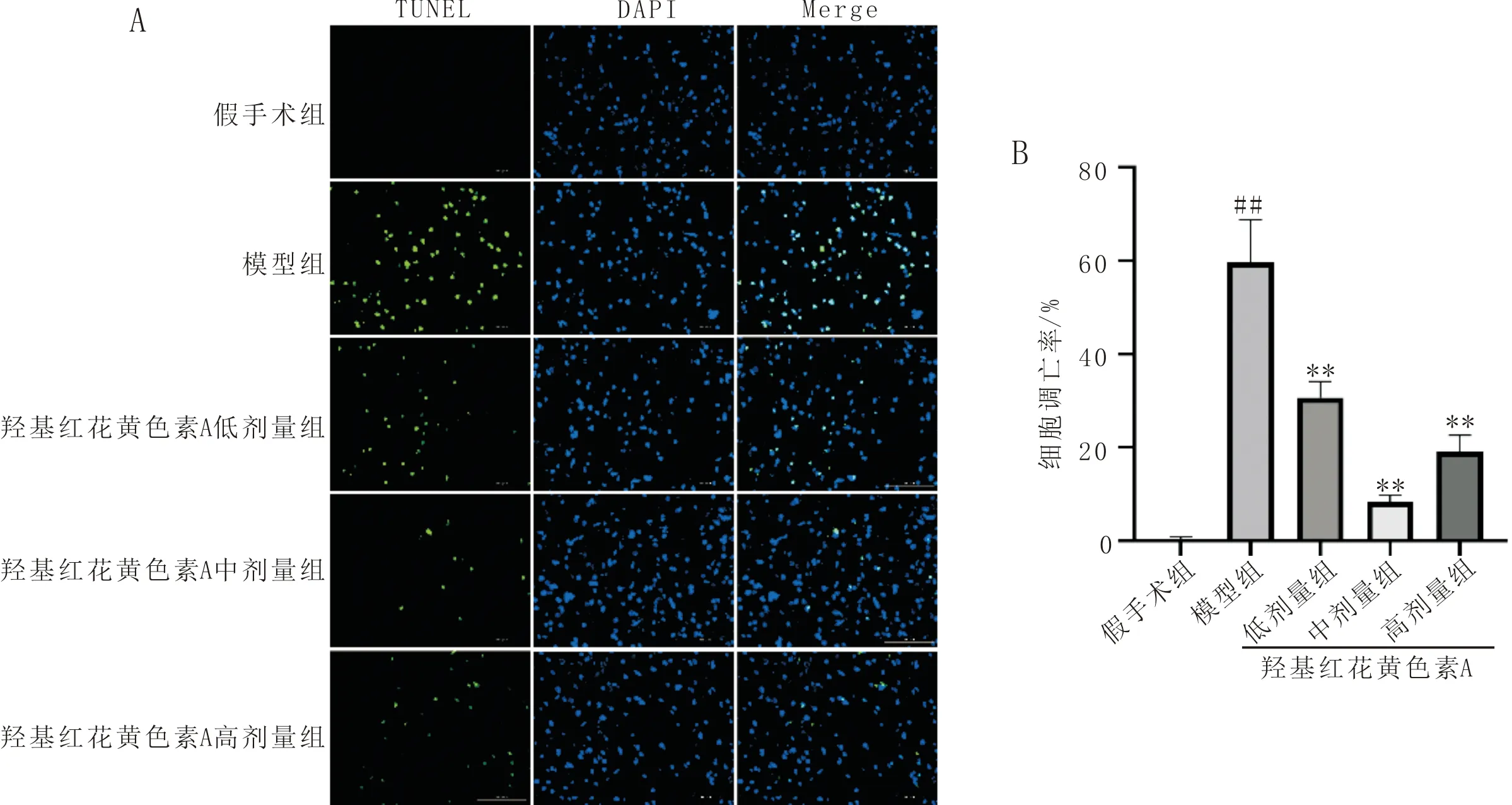
3 结果
3.1 羟基红花黄色素A对pMCAO大鼠神经功能障碍的影响与假手术组比较,模型组大鼠的mNSS评分明显升高(P<0.01);与模型组比较,羟基红花黄色素A低、中、高剂量组大鼠的mNSS神经功能评分显著降低(P<0.05)。见图1。

注:与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。图1 各组大鼠mNSS神经功能评分
3.2 羟基红花黄色素A对pMCAO大鼠脑梗死体积的影响与假手术组比较,模型组可见明显梗死灶,脑梗死体积显著增加(P<0.01)。与模型组比较,羟基红花黄色素A中、高剂量组脑梗死体积显著减少(P<0.05)。见图2。
注:与假手术组比较,##P<0.01;与模型组比较,*P<0.05。图2 各组大鼠脑组织TTC染色及梗死体积比较
3.3 羟基红花黄色素A对pMCAO大鼠脑组织形态学的影响HE结果显示,假手术组大脑皮层组织细胞结构清晰,染色均匀,细胞间隙致密;模型组细胞结构破坏,排列不整齐,细胞核皱缩,细胞间隙疏松,可见明显空洞;与模型组比较,羟基红花黄色素A各组脑组织病理损伤均有所减轻。Nissl染色结果可见,假手术组神经元形态正常,排列规整,尼氏体数目丰富,着色均匀;模型组尼氏体着色较浅,神经元形态异常,细胞核皱缩,呈空泡样变化,排列紊乱,核膜模糊不清;与模型组比较,羟基红花黄色素A各组脑组织神经元形态明显好转,染色较均匀。见图3。

图3 各组大鼠HE染色及Nissl染色(比例尺:50 μm)
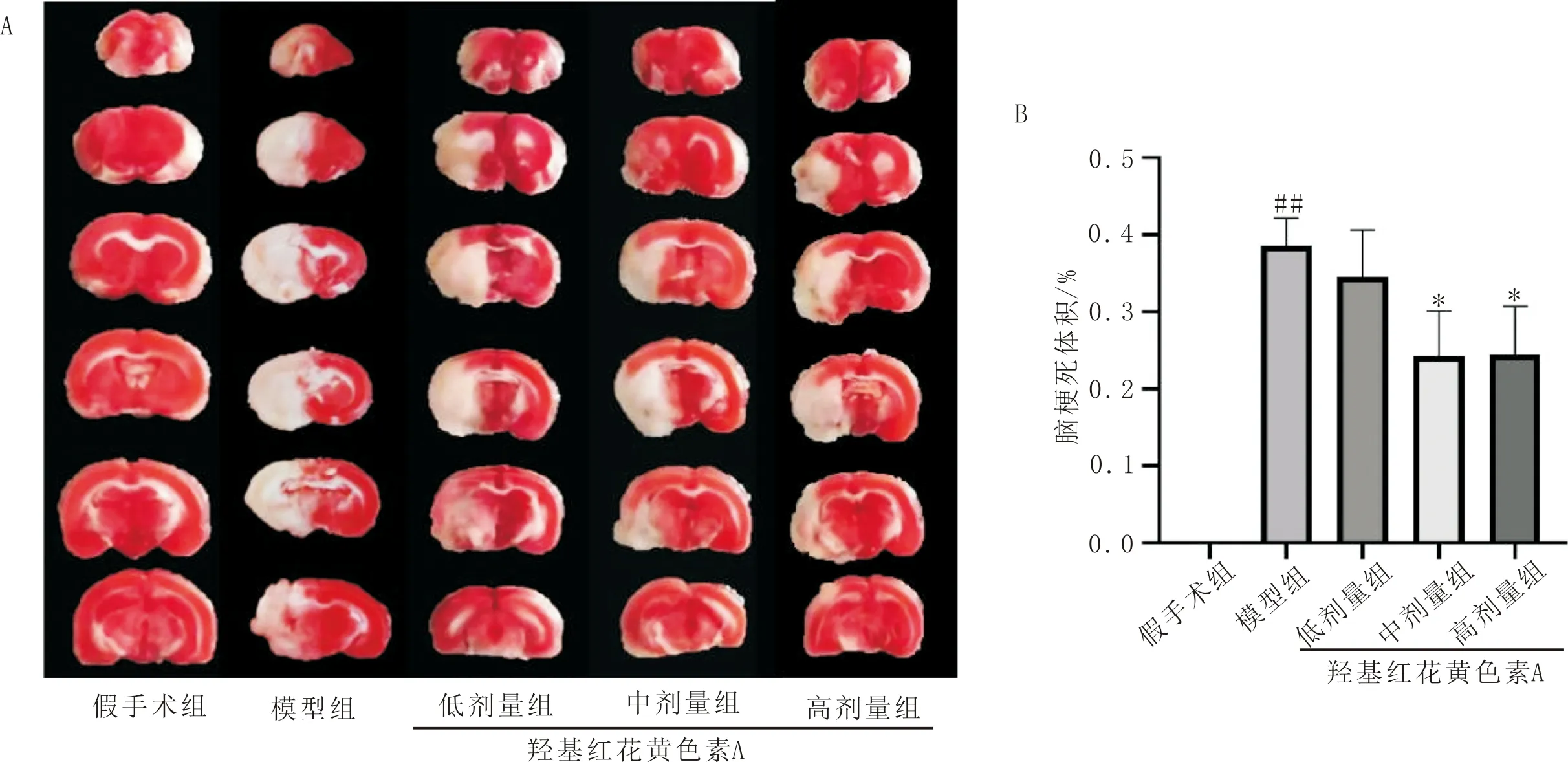
3.4 羟基红花黄色素A对pMCAO大鼠血浆中氧化因子MDA和SOD的影响MDA检测显示:与假手术比较,模型组大鼠血浆中MDA水平显著升高(P<0.01);与模型组比较,羟基红花黄色素A各组大鼠血浆MDA水平显著降低(P<0.01),如图4A。SOD检测显示:与假手术组比较,模型组大鼠血浆中SOD水平显著降低(P<0.01);与模型组比较,羟基红花黄色素A中、高剂量组大鼠血浆中SOD水平显著升高(P<0.01),如图4B;表明羟基红花黄色素A可通过提高抗氧化酶SOD的表达并降低脂质过氧化物MDA含量发挥抗氧化作用。
注:A:各组MDA水平比较;B:各组SOD水平比较;与假手术组比较,##P<0.01;与模型组比较,**P<0.01。图4 羟基红花黄色素A对pMCAO大鼠血浆中氧应激相关因子表达的影响
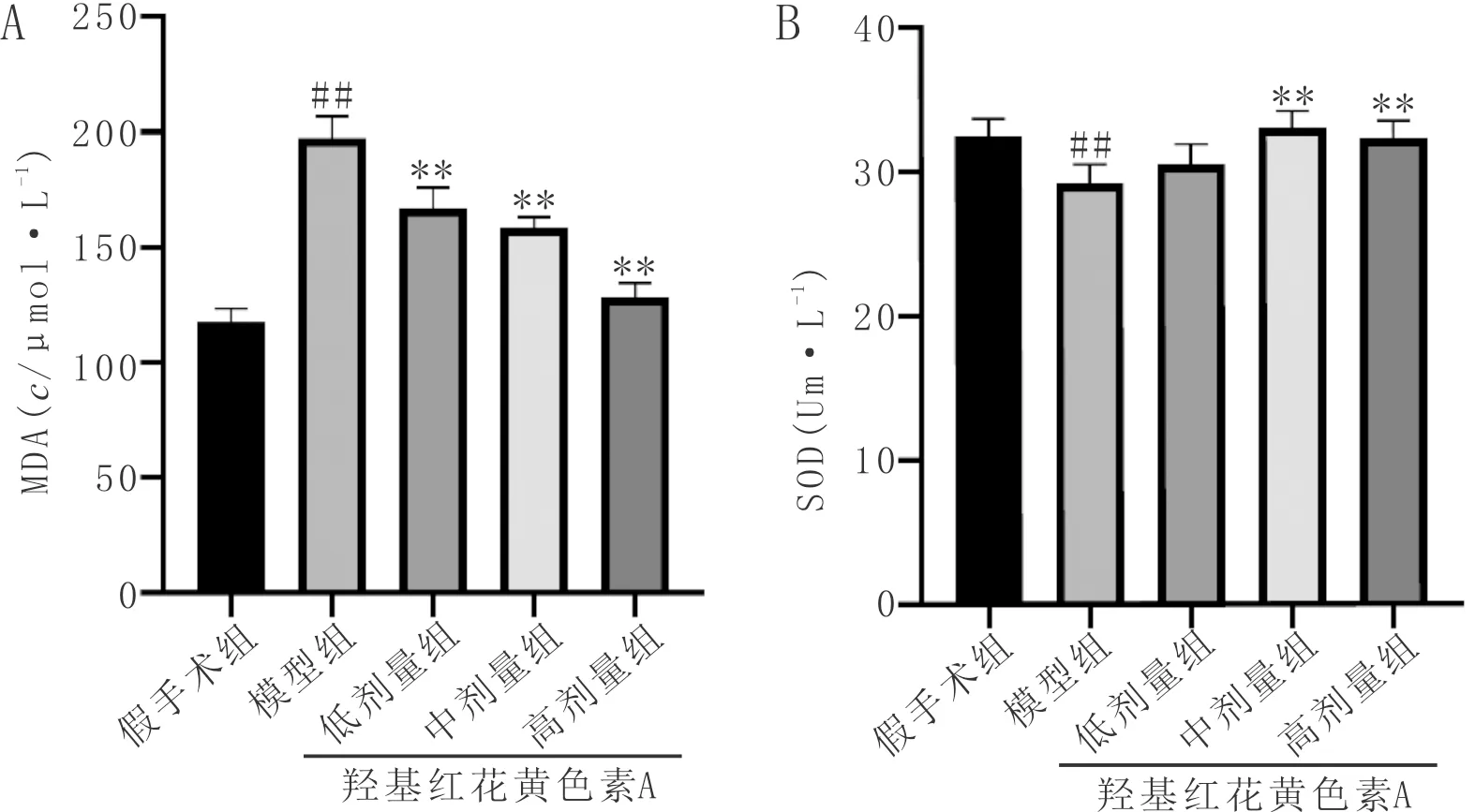
3.5 羟基红花黄色素A对pMCAO大鼠神经细胞凋亡率的影响TUNEL染色结果显示,与假手术组比较,模型组大鼠缺血侧大脑皮层TUNEL阳性细胞显著增加(P<0.01);与模型组比较,各给药组大鼠缺血侧皮层TUNEL阳性细胞显著减少(P<0.01)。见图5。
注:A:各组Tunel染色代表性图像;B:各组Tunel阳性细胞量化结果;与假手术组比较,##P<0.01;与模型组比较,**P<0.01;n=3。图5 各组大鼠缺血半暗带细胞凋亡率(比例尺:100 μm)
3.6 羟基红花黄色素A对pMCAO大鼠脑组织Bax、Bcl-2蛋白的影响与假手术组比较,模型组大鼠脑组织缺血半暗带Bax蛋白表达水平显著升高(P<0.01),Bcl-2蛋白表达水平显著降低(P<0.01),Bcl-2/Bax水平明显降低(P<0.01);与模型组比较,羟基红花黄色素A中、高剂量组可显著下调Bax蛋白表达水平(P<0.05);羟基红花黄色素A低、中剂量组可显著上调 Bcl-2 蛋白表达(P<0.05);羟基红花黄色素A低、中、高剂量组显著升高Bcl-2/Bax水平(P<0.05)。见图6。
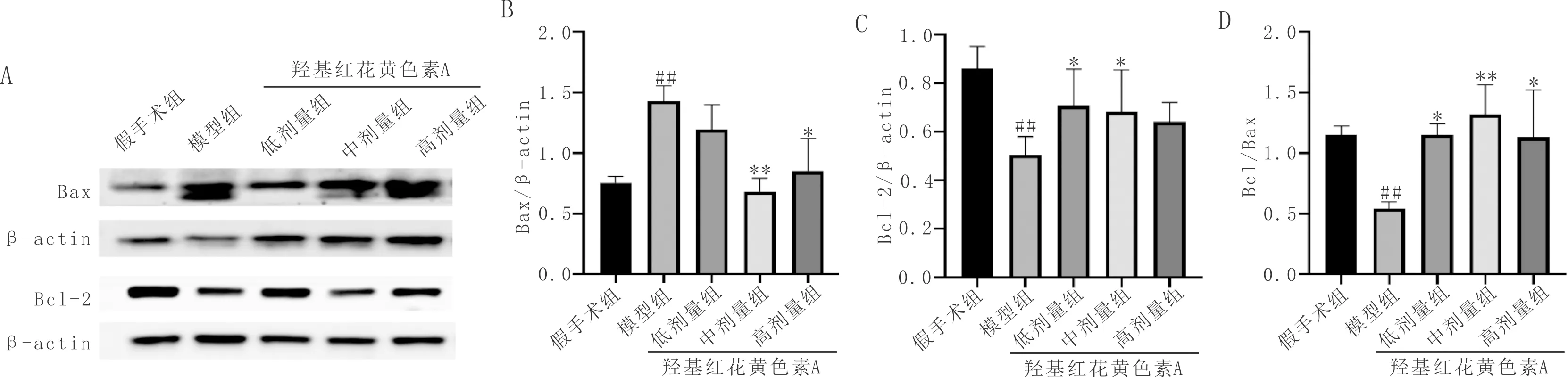
注:A:Bax、Bcl-2蛋白表达条带图;B:Bax蛋白表达定量比较;C:Bcl-2蛋白表达定量比较;D:Bcl-2/Bax相对蛋白表达定量比较;与假手术组比较,##P<0.01;与模型组比较*P<0.05,**P<0.01。图6 各组大鼠脑组织Bcl-2和Bax 蛋白表达情况
3.7 羟基红花黄色素A对pMCAO大鼠脑组织XIAP、Caspase-3蛋白的影响与假手术组比较,模型组大鼠脑组织缺血半暗带XIAP蛋白表达显著降低(P<0.01),Caspase-3蛋白表达显著升高(P<0.05);与模型组比较,羟基红花黄色素A中剂量组可显著上调XIAP蛋白表达(P<0.01);羟基红花黄色素A低、中剂量组可显著下调Caspase-3蛋白表达(P<0.05)。见图7。

注:A:XIAP和Caspase-3蛋白表达条带图;B:XIAP蛋白表达定量比较;C:Caspase-3蛋白表达比较;与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。图7 各组大鼠脑组织XIAP和Caspase-3蛋白表达情况
4 讨论
缺血性脑卒中是最常见的卒中类型。中医认为,痰瘀互结是卒中发病的关键病机,血瘀是主要病因和病理产物,瘀阻脑络则是缺血性中风的病理核心,因此活血化瘀药在脑卒中治疗中被广泛应用[15-16]。中药常见活血化瘀药红花的主要有效成分羟基红花黄色素A具有抗炎、抗氧化、抑制细胞凋亡,保护神经元,改善血管功能等作用,在治疗心脑血管疾病方面表现出巨大的潜力[17-20]。过多的氧化物产生会改变细胞膜通透性,破坏血脑屏障结构和功能。研究表明,羟基红花黄色素A可通过抑制氧化应激调节线粒体功能,改善缺氧/复氧造成的细胞损伤[21]。本研究显示,pMCAO大鼠给药羟基红花黄色素A后血浆中SOD升高、MDA降低,减少缺血引起的细胞凋亡。
长时间的缺血缺氧导致的细胞发生不可逆死亡是缺血性脑卒中致残、致死率高的直接原因[22]。在缺血核心区引发的坏死和半暗带因低灌注和能量代谢障碍导致的凋亡是缺血性脑卒中中最常见的细胞死亡方式。由于核心区细胞死亡的不可逆性,为限制梗死体积进一步扩大,半暗带细胞凋亡的调节可作为缺血性中风发生后主要的治疗方向[23]。XIAP是细胞凋亡的重要调节因子,参与坏死性凋亡等多种细胞死亡途径的调节。Bcl-2家族和Caspase家族是线粒体介导的内源性细胞凋亡机制中的重要组成部分。细胞凋亡过程中,抗凋亡蛋白Bcl-2被抑制,促凋亡蛋白Bax被激活,导致线粒体外膜透化,线粒体释放细胞色素C和半胱氨酸蛋白酶激动剂(second mitochondria-derived activator of caspases,Smac)引发Caspase级联反应[15]。XIAP通过抑制凋亡效应子Caspase-3发挥抗凋亡作用,同时XIAP也受Smac负调节,可解除对Caspase-3的抑制作用,进而促进凋亡[25]。由于XIAP的结构具有E3泛素化酶活性,可参与NF-κB、MAPK/JNK、Wnt/β-catenin等多条信号通路的调节[26]。Zhou等[27]研究发现XIAP 可通过介导NF-κB活化,减少缺血所致的氧化应激损伤,抑制细胞凋亡。近几年研究表明,XIAP在MCAO大鼠模型中表达降低[28];通过上调XIAP可减少miR-186-5p对OGD诱导的神经细胞凋亡[29];长链非编码RNA Peg13通过上调XIAP 可减轻新生小鼠缺氧缺血性脑损伤所致的海马神经元凋亡[30]。本研究显示,羟基红花黄色素A给药后,pMCAO大鼠Caspase-3表达降低,Bcl-2/Bax相对蛋白表达升高,XIAP表达升高,提示羟基红花黄色素A通过抗细胞凋亡发挥脑保护作用的机制可能与调节XIAP表达有关。
综上所述,羟基红花黄色素A可改善脑缺血所致的神经功能缺损,减少脑梗死面积,其机制可能与提高XIAP的表达,抑制Caspase-3表达,促进Bcl-2/Bax相对蛋白表达,从而抑制线粒体介导的内源性凋亡途径,同时抑制过氧化物产生,减少缺血导致的氧化应激损伤,抑制细胞凋亡有关。本研究以XIAP为靶点探讨羟基红花黄色素A对脑缺血后细胞凋亡的影响,以期为进一步研究羟基红花黄色素A治疗脑卒中的作用机制提供理论和实验基础。

