神经内镜经鼻蝶入路切除无功能性垂体腺瘤的效果及对视觉功能的影响研究
杨震宇
佳木斯市中心医院二部内分泌科,黑龙江 佳木斯 154002
垂体腺瘤(PA)是来源于垂体及颅咽管上皮残余细胞的良性病变,发生率约为颅内肿瘤的10%~15%[1]。PA有功能性、无功能性腺瘤两种类型,其中无功能性垂体腺瘤(NFPA)约占PA 总数的14%~54%[2]。NFPA 因无分泌激素的功能,早期基本无明显症状,后期可出现头痛、视觉功能障碍等压迫症状和(或)尿崩症、泌乳等激素分泌紊乱症状[3]。手术切除为当前NFPA 的首选治疗方式,而经鼻蝶入路是NFPA 切除的标准术式,可解除肿瘤压迫,保护正常垂体功能与神经功能,恢复代谢紊乱,但术中利用神经内镜或者显微镜开展尚未统一[4]。本研究旨在探讨神经内镜经鼻蝶入路切除NFPA的效果及对视觉功能的影响,现将研究结果报告如下。
1 资料与方法
1.1 一般资料
选取2019 年6 月—2021 年6 月佳木斯市中心医院内分泌科收治的86 例NFPA 患者作为研究对象,采用随机数表法分为对照组和观察组,每组各43例。对照组:男23例,女20 例;年龄34~59 岁,平均年龄(43.39±4.26)岁;病程8~39 个月,平均病程(19.19±1.86)个月;肿瘤直径0.24~5.98 cm,平均肿瘤直径(3.23±0.30)cm;肿瘤部位为仅位于鞍内25 例,侵袭海绵窦9 例,侵袭蝶窦9 例;Knosp 分 级 为0 级10 例,1 级8 例,2 级7 例,3 级9 例,4级9 例。观察组:男24 例,女19 例;年龄34~61 岁,平均年龄(43.41±4.27)岁;病程8~38 个月,平均病程(19.21±1.87)个月;肿瘤直径0.26~5.97 cm,平均肿瘤直径(3.21±0.31)cm;肿瘤部位为仅位于鞍内26 例,侵袭海绵窦8 例,侵袭蝶窦9 例;Knosp 分级为0 级10 例,1 级9 例,2 级7 例,3 级8 例,4 级9 例。两组患者一般资料具有可比性(P>0.05)。本研究经医院医学伦理委员会批准通过。纳入标准:(1)经MRI检查、病理学与内分泌学确诊,且诊断符合《中国垂体腺瘤外科治疗专家共识》[5]标准。(2)患侧术前经视野检查,有视野缺损。(3)术前蝶窦气化良好。(4)无麻醉或手术禁忌证。(5)近期无急性脑血管疾病。(6)精神正常,可配合研究。(7)签署知情同意书。排除标准:(1)肿瘤突入颅中窝或者颅后窝。(2)肿瘤呈向鞍上、鞍侧生长,无法行经鼻蝶入路术。(3)合并其他恶性肿瘤、造血系统疾病、免疫功能障碍、重要脏器功能障碍。(4)有鼻腔、鼻窦感染、鼻腔疾病或者蝶窦解剖异常。(5)术前有药物治疗、放射治疗史。(6)合并颅脑外伤、颅脑占位性病变或有颅内手术史。(7)因外伤、青光眼、黄斑病变、球后视神经炎等其他原因所致的视野缺损。
1.2 方法
观察组给予神经内镜经鼻蝶入路切除术。取仰卧位,全麻,双侧鼻腔暴露消毒。将棉片浸入0.01%肾上腺素溶液中,取出后去除多余药液,塞入鼻腔使鼻腔收缩,形成手术通道。经鼻置入神经内镜(德国卡尔史托斯,国械注进20152061295,型号8403ZX),探查蝶窦开口,切开蝶窦前壁黏膜,以暴露蝶窦前下壁与骨性鼻中隔。咬骨钳咬除前下壁骨质,显露鞍底。用磨钻磨除鞍底骨质,直至显露鞍底硬膜。使用细针行鞍底硬脑膜穿刺,确认无脑脊液及血液。按照十字形常规切开硬脑膜,内镜直视下分块切除肿瘤组织。采用明胶海绵填塞瘤腔,生物胶封闭鞍底。进行蝶窦前壁黏膜复位,鼻腔采用膨胀海绵填塞,防止出血。术后3~5 d拔除。
对照组给予显微镜经鼻蝶入路切除术。体位、麻醉、消毒同观察组。扩张手术通道,安放手术显微镜(德国卡尔蔡司医疗,国械注进20162064391,型号S7/OPMI Sensera),将鼻窥器插至蝶窦前壁,将鼻中隔和黏膜推向对侧,以扩大手术视野。显微镜下找到蝶窦开口,剥离蝶窦开口部分黏膜,显露骨性蝶窦开口和前壁,咬除蝶窦前壁进入蝶窦腔,后续操作同观察组。
1.3 观察指标
(1)比较两组患者肿瘤切除率。术后48 h 行增强MRI检查,若显示无残留肿瘤则为全切除,残留肿瘤体积<10%为次全切,残留肿瘤体积<20%为部分切除。(2)比较两组患者围术期指标。(3)比较两组患者视野指标。术前与术后7 d,采用全自动视野计(重庆艾尔曦医疗,渝械注准20172220174,型号IFA-960)评估患侧眼球加权视野指数(VFI)、视野平均缺损(MD)、模式标准差(PSD)。(4)比较两组患者脑脊液鼻漏、垂体功能损伤、嗅觉障碍等并发症发生率。
1.4 统计学方法
采用SPSS 25.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者肿瘤切除情况
观察组肿瘤全切除率高于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组患者肿瘤切除情况 例(%)
2.2 两组患者围术期指标情况
观察组手术时间长于对照组,观察组术中失血量少于对照组,观察组住院时间短于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者围术期指标情况(±s)
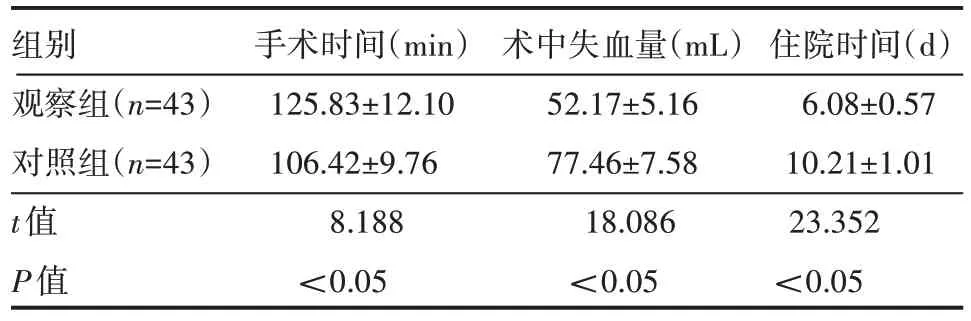
表2 两组患者围术期指标情况(±s)
组别观察组(n=43)对照组(n=43)t值P值手术时间(min)125.83±12.10 106.42±9.76 8.188<0.05术中失血量(mL)52.17±5.16 77.46±7.58 18.086<0.05住院时间(d)6.08±0.57 10.21±1.01 23.352<0.05
2.3 两组患者术前、术后视野指标情况
术后,两组患者患侧眼球VFI 增加,MD、PSD 减少,且观察组患侧眼球VFI 高于对照组,MD、PSD 低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者术前、术后视野指标情况(±s)
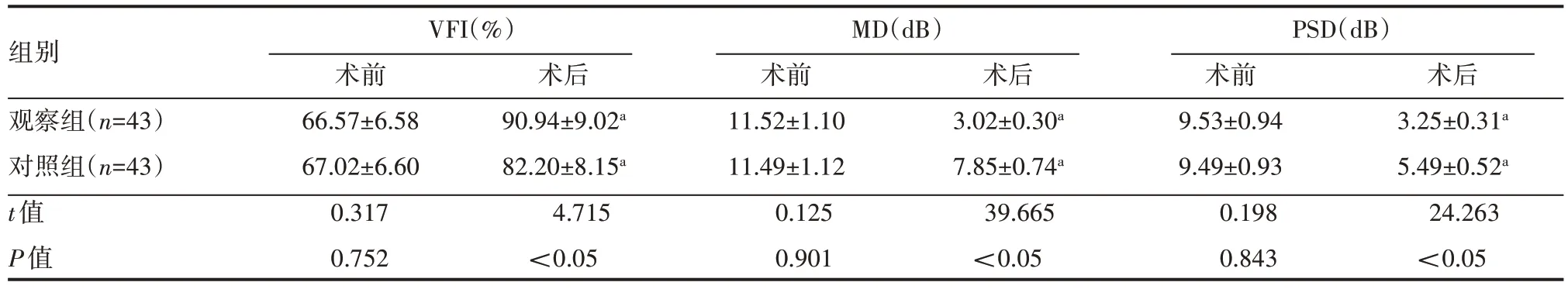
表3 两组患者术前、术后视野指标情况(±s)
a表示与本组术前比较,P<0.05。
组别观察组(n=43)对照组(n=43)t值P值VFI(%)术前66.57±6.58 67.02±6.60 0.317 0.752术后90.94±9.02a 82.20±8.15a 4.715<0.05 MD(dB)术前11.52±1.10 11.49±1.12 0.125 0.901术后3.02±0.30a 7.85±0.74a 39.665<0.05 PSD(dB)术前9.53±0.94 9.49±0.93 0.198 0.843术后3.25±0.31a 5.49±0.52a 24.263<0.05
2.4 两组患者并发症发生情况
观察组并发症发生率明显低于对照组,差异有统计学意义(P<0.05),见表4。
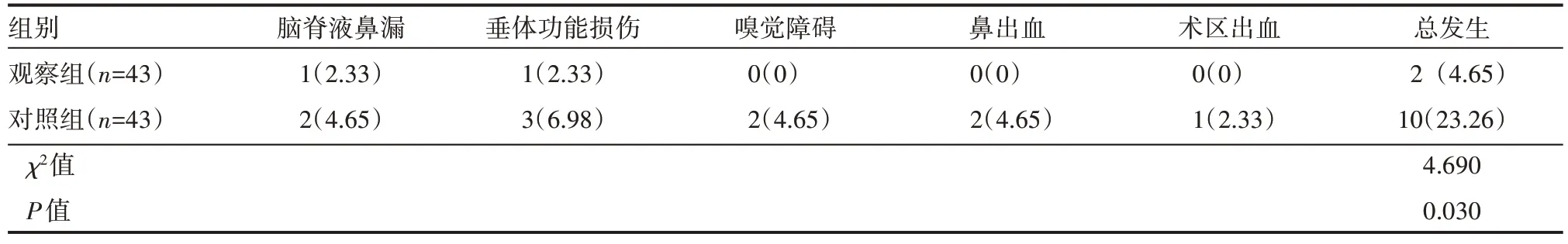
表4 两组患者并发症发生情况 例(%)
3 讨论
NFPA 为常见的PA,发病机制复杂,初期症状隐匿,确诊时,多已出现明显占位效应,导致压迫视神经,引起头晕、头痛、视力下降等症状[6]。手术切除为当前NFPA的首选治疗方式,可彻底切除肿瘤,保护正常垂体功能,消除临床症状[7]。经鼻窦入路仅需打开蝶窦、分离部分黏膜,因此,相较于传统的经颅切除术,其具有手术路径短,避免损伤下丘脑、额叶、视神经、嗅神经的优势[8]。
本研究结果与屈浙等[9]的报道一致。这提示NFPA 治疗中,神经内镜手术方式的肿瘤切除效果、安全性均优于显微镜,原因在于,显微镜下立体感良好,双手操作,可节省手术时间。但“管状”术野的深部照明欠佳,较难清晰显示蝶鞍区解剖情况,易残留肿瘤与损伤周围正常组织,增加术中出血量与术后并发症发生率[10]。而神经内镜的图像立体感虽然稍逊于显微镜,在切除肿瘤操作过程中,需一手持镜,一手持器械,单手操作难度加大,手术时间延长[11]。但神经内镜的多视觉与广角观察功能以及全景术野照明,可更清晰地显示鞍区解剖结构,促进彻底切除肿瘤组织,更有利于观察蝶窦内全貌,清晰辨认视神经、颈内动脉、海绵窦等解剖标志,减少垂体功能损伤与副损伤,减少出血情况,降低术后并发症发生率,有利于患者术后恢复。由于垂体肿瘤解剖位置的特殊性,肿块会压迫垂体周围组织,视觉神经束被压迫后,引起视觉功能障碍。本研究结果显示,两组患者患侧眼球VFI 增加,MD、PSD 减少,且观察组患侧眼球VFI高于对照组,MD、PSD 低于对照组,与潘东等[12]的报道一致。这提示NFPA手术治疗中,神经内镜经鼻蝶入路方式更利于促使患者缺损的视野恢复,优于显微镜手术方式,原因在于,神经内镜下可更充分地切除病灶,解除神经压迫,使术后视觉功能恢复更佳。
综上所述,神经内镜经鼻蝶入路切除NFPA 可明显提高患者肿瘤全切除率,促进其视觉功能恢复,降低其术后并发症发生率。本研究仍存在样本量小、观察期短等不足,神经内镜经鼻蝶入路切除术的临床价值今后仍需多中心、大样本、大数据加以验证。

